Benzotrichloride: Eigenschappen, Reacties, Productie en Toepassingen
Wat is benzotrichloride?
Benzotrichloride is het product dat ontstaat door uitputtende chlorering van de zijketen van tolueen, ook bekend als trichloormethylbenzeen, α,α,α-trichloortolueen en fenylchloroform. Het is een chemische verbinding met de formule C7H5Cl3.
De synthese van benzotrichloride werd aanvankelijk in 1858 uitgevoerd door L. SCHISCHKOFF en A. ROSING, waarbij gebruik werd gemaakt van de reactie tussen PCl5 en benzoylchloride.
Tegenwoordig wordt benzotrichloride op grote schaal geproduceerd vanwege de belangrijke rol die het speelt als belangrijk tussenproduct bij de synthese van zuurchloriden (met name benzoylchloride), kleurstoffen, herbiciden, pesticiden en verschillende andere producten.
Inhoudsopgave
Fysische eigenschappen van benzotrichloride
Benzotrichloride is een kleurloze vloeistof met een scherpe geur en is irriterend voor de ogen en slijmvliezen. Het genereert dampen bij blootstelling aan vochtige lucht.
Ethanol, di-ethylether en chloroform zijn goede oplosmiddelen voor benzotrichloride. De oplosbaarheid ervan in water is echter beperkt, met slechts 0,05 g per liter bij 5 °C en 0,25 g per liter bij 39 °C. Met name hydrolyse vindt plaats tijdens het oplossen in water.
De hoeveelheid chloor die kan worden opgelost in 100 gram benzotrichloride is afhankelijk van de temperatuur. Bij 30 °C is de oplosbaarheid 5,1 gram, terwijl deze bij 50 °C afneemt tot 3,4 gram en bij 100 °C verder afneemt tot 1,3 gram.
De fysieke eigenschappen van benzotrichloride zijn de volgende:
- Molaire massa = 195,48 g/mol
- Kookpunt = 220,7 °C
- Smeltpunt = -4,5 °C
- Dichtheid = 1,373 bij 20 °C
- Breukindex = 1,558 bij 20 °C
- Vlampunt = 108 °C
- Ontstekingstemperatuur = 420 °C
Chemische reacties van benzotrichloride
Benzoëzuur wordt geproduceerd door zure of alkalische hydrolyse van benzotrichloride, terwijl gedeeltelijke hydrolyse benzoylchloride produceert.
Wanneer benzotrichloride reageert met carbonzuren, levert het de overeenkomstige zuurchloriden en benzoylchloride op.
De condensatie van benzotrichloride met benzeen, in aanwezigheid van katalysatoren zoals FeCl3, AlCl3 of ZnCl2, leidt tot de vorming van difenyl- en trifenylmethaan.
Behandeling van benzotrichloride met waterstoffluoride of fluoriden maakt het mogelijk om alle drie de chlooratomen te vervangen door fluor.
Door benzotrichloride te laten reageren met watervrije alcoholen, kunnen ortho-esters van benzoëzuur worden bereid.
Hydrolyse van benzotrichloride kan worden bereikt door te reageren met water.
Productie van benzotrichloride
Een methode die verwant is aan de procedure die wordt gebruikt voor benzylchloride, kan worden gebruikt voor de uitgebreide chlorering van de zijketen van tolueen, waardoor de productie van benzotrichloride wordt vergemakkelijkt. Fotochemische chlorering wordt in het bijzonder vaak voor dit doel gebruikt.
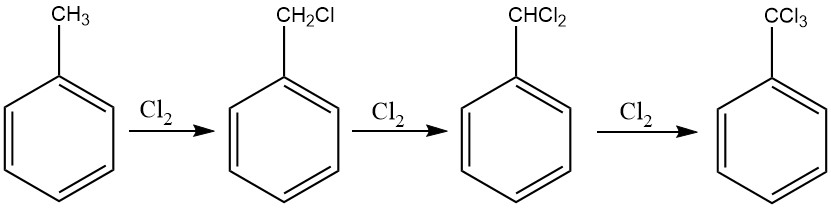
Bij continue processen is het raadzaam om een cascade van zes tot tien reactoren te implementeren om de vorming van ringgechloreerde derivaten te voorkomen. Deze aanpak maakt controle over de chloortoevoer mogelijk, waardoor benzotrichloride met minimale hoeveelheden benzalchloride wordt verkregen.
Figuur 1 toont een continu werkende installatie die is ontworpen voor de productie van benzotrichloride. Verse tolueen wordt door de voorchlorinator (R0) geleid en komt vervolgens de eerste reactor in de cascade van acht reactoren binnen. De reactoren worden gevuld met afnemende hoeveelheden chloor.
Meestal wordt de laatste reactor in de cascade gespoeld met zuivere stikstof om restchloorgas te verwijderen. Voor het doel van het verwijderen van afvalgas (aangegeven met stippellijnen) kunnen de reactoren worden gecategoriseerd in drie groepen.
Reactoren R1-R3 ontvangen nauwkeurige chloormeting, waarvan het grootste deel tijdens de reactie wordt verbruikt. Het afgas van reactoren R4-R8 bevat een hogere concentratie chloor vanwege de geavanceerde chlorering van het materiaal in deze reactoren. Dit gas wordt vervolgens gerecycled naar reactoren R1 en R2.
Op dezelfde manier wordt het afgas van reactoren R1-R4 in de voorchlorinator (R0) gebracht, die het hoogste percentage tolueen bevat, om alle resterende sporen chloor te verwijderen. Het afgas van reactor R0 is dus vrij van chloor en wordt naar het scrubbersysteem geleid om HCl te verwijderen.
Door de toevoer van chloor en tolueen nauwkeurig te regelen, bereikt deze techniek een bijna volledige omzetting van tolueen in benzotrichloride, waarbij afvalgassen worden gegenereerd die voornamelijk bestaan uit waterstofchloride en stikstof, zonder dat er chloor aanwezig is.

Om de opbrengst en reactiesnelheid te verbeteren, is het uitsluiten van zuurstof noodzakelijk en kunnen katalytische hoeveelheden broom, ammoniumchloride of een combinatie van fosfortrichloride en bis(dimethylthiocarbamoyl)disulfide worden toegevoegd.
De chlorering van methylbenzenen in de overeenkomstige trichloriden als oplosmiddelen, waarvan wordt beweerd dat het een hoge opbrengst aan zeer zuivere producten biedt, biedt een alternatieve methode voor de productie van benzotrichloride.
Een ander productieproces voor benzotrichloride omvat het chloreren van dibenzylether, een bijproduct dat wordt verkregen tijdens de omzetting van benzylchloride in benzylalcohol. Dit chloreringsproces levert een mengsel van benzotrichloride en benzoylchloride op, dat vervolgens kan worden verwerkt om zuiver benzoylchloride te verkrijgen.
Deze aanpak verbetert indirect de economische levensvatbaarheid van de productie van benzylalcohol.
Toepassingen van benzotrichloride
De primaire toepassing van benzotrichloride ligt in het gebruik ervan voor de productie van benzoylchloride door gedeeltelijke hydrolyse met water of reactie met benzoëzuur.
Benzotrichloride vindt ook kleinschalige toepassingen in verschillende industrieën. Het wordt gebruikt bij de productie van farmaceutische producten en agrochemicaliën, met name na een transformatie in benzotrifluoride. Bovendien dient het als een voorloper voor de synthese van benzofenon-type UV-stabilisatoren en kleurstoffen.
Toxicologie van benzotrichloride
Benzotrichloride is een giftige chemische stof die irritatie aan de huid, ogen en luchtwegen kan veroorzaken. Het is ook een waarschijnlijke kankerverwekkende stof voor mensen.
De acute orale toxiciteit (LD50) van benzotrichloride is 2188 mg/kg bij mannelijke ratten en 1590 mg/kg bij vrouwelijke ratten. Dit betekent dat 50% van de ratten zal sterven als ze respectievelijk 2188 mg/kg of 1590 mg/kg benzotrichloride binnenkrijgen.
De LC50-waarden voor benzotrichloride zijn hoger dan 600 mg/m³ bij mannelijke ratten en ongeveer 500 mg/m³ bij vrouwelijke ratten na een blootstellingsperiode van 4 uur. Dit betekent dat 50% van de ratten zal sterven als ze gedurende 4 uur worden blootgesteld aan benzotrichloridedamp in een concentratie van respectievelijk meer dan 600 mg/m³ of ongeveer 500 mg/m³.
Benzotrichloride is ook mutageen gebleken in bacteriële testsystemen. Dit betekent dat het veranderingen in het DNA kan veroorzaken die tot kanker kunnen leiden.
Inhalatieblootstelling van vrouwelijke muizen aan benzotrichloride heeft geleid tot zowel goedaardige als kwaadaardige long- en huidtumoren. In een onderzoek naar longtumoren bij muizen verhoogde intraperitoneale injectie van benzotrichloride de incidentie van longadenomen.
Bovendien veroorzaakte orale toediening van benzotrichloride aan 40 vrouwelijke muizen gedurende 25 weken neoplasmata in de voormaag, longen en thymusklier bij de hoogste dosis.
Deze bevindingen suggereren dat benzotrichloride een potentieel carcinogeen is voor mensen. Het is belangrijk om blootstelling aan deze chemische stof te vermijden door passende veiligheidsmaatregelen te nemen bij het hanteren ervan.
Referentie
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
