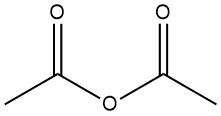
Azijnzuuranhydride: eigenschappen, reacties, productie en toepassingen
Wat is azijnzuuranhydride?
Azijnzuuranhydride is een organische verbinding met de chemische formule (CH3CO)2O. Het is een kleurloze vloeistof met een scherpe geur en wordt vaak gebruikt als acetyleringsmiddel en dehydratiemiddel. Het werd in 1852 bereid door de reactie van benzoylchloride en gesmolten kaliumacetaat.
Sindsdien is azijnzuuranhydride uitgegroeid tot een prominent organisch tussenproduct met een aanzienlijke betekenis in verschillende onderzoeks- en industriële toepassingen. Momenteel wordt het veel gebruikt in zowel academische als industriële synthese.
Azijnzuuranhydride wordt in sporen aangetroffen in wijndruiven (Vitis vinifera), maar wordt voornamelijk industrieel geproduceerd.
Inhoudsopgave
1. Fysieke eigenschappen van azijnzuuranhydride
Azijnzuuranhydride is een kleurloze vloeistof die wordt gekenmerkt door een scherpe geur en sterke traanverwekkende eigenschappen bezit. De belangrijkste fysieke gegevens die verband houden met azijnzuuranhydride worden hieronder gegeven.
| Eigenschap | Waarde |
|---|---|
| Moleculaire formule | (CH3CO)2O |
| Moleculair gewicht | 102,09 g/mol |
| Uiterlijk | Kleurloze vloeistof |
| Dichtheid | 1,08 g/cm3 |
| Kookpunt | 140,1 °C |
| Smeltpunt | -73,1 °C |
| Oplosbaarheid in water | Reageert heftig; mengbaar |
| Geur | Stevig |
| Dampspanning | 13 mmHg bij 25 °C |
| Vlampunt | 49 °C (gesloten beker) |
| Zelfontbrandingstemperatuur | 485 °C |
| Breukindex | 1,392 |
| Viscositeit | 1,3 cP bij 25 °C |
| Explosieve limieten | 2,3 - 10,6% (volume) |
Bij een temperatuur van -73,1 °C ondergaat azijnzuuranhydride een vaste-naar-vloeibare faseovergang (smeltpunt). Aan de andere kant kookt het bij 140 °C onder een druk van 101,3 kPa (kookpunt).
Azijnzuuranhydride vertoont mengbaarheid met polaire oplosmiddelen en vertoont oplosbaarheid in koude alcohol, zij het met een langzame ontledingssnelheid. Wanneer opgelost in water bij een temperatuur van 20 °C, is de oplosbaarheid van azijnzuuranhydride ongeveer 2,6 gew.%, vergezeld van een geleidelijk ontledingsproces.
Omgekeerd, bij een temperatuur van 15 °C, is de oplosbaarheid van water in azijnzuuranhydride ongeveer 10,7 gew.%, ook met een geleidelijke ontledingsneiging.
2. Chemische reacties van azijnzuuranhydride
Azijnzuuranhydride vertoont een breed scala aan chemische reacties en is uitgebreid bestudeerd als een alifatisch carbonzuuranhydride.
In de afgelopen 25 jaar is azijnzuuranhydride gebruikt in talloze publicaties en patenten, met name voor de acetylering van hydroxyl- (OH) of aminogroepen (NH), en dient als een primaire stap in deze reacties.
2.1. Acetylering
Azijnzuuranhydride in pyridine wordt gebruikt om de acetylgroep te introduceren in verschillende moleculen, waaronder hydroxy-, amino- en thiolgroepen.
2.1.1. O-acetylering
Azijnzuuranhydride is zeer geschikt voor veresteringsreacties met alcoholen, die vaak lastig of onmogelijk te bereiken zijn met azijnzuur. Tijdens dit proces komt azijnzuur vrij. Katalysatoren zoals basen, sterke zuren en zouten zoals natriumacetaat worden vaak gebruikt.
Opvallende voorbeelden van de reactie van azijnzuuranhydride met hydroxylgroepen zijn de vorming van acetylcellulose, acetylsalicylzuur (algemeen bekend als aspirine) en glyceroltriacetaat.
Wanneer azijnzuuranhydride reageert met waterstofperoxide, produceert het perazijnzuur of diacetylperoxide, waarbij de uitkomst afhankelijk is van de molaire verhouding van de reactanten:
(CH3CO)2O + 2 H2O2 → 2 CH3CO3H
(CH3CO)2O + H2O2 → CH3COOH + CH3CO3H
(CH3CO)2O + CH3CO3H → CH3COOOOCOCH3 + CH3COOH
2.1.2. N-Acetylering
De acetylering van verbindingen die NH-groepen bevatten, levert acetamiden op, volgens de algemene vergelijking:
RR’NH + (CH3CO)2O → RR’NCOCH3 + CH3COOH
Hier staan R en R’ voor waterstof (H) of alkylgroepen. Alifatische aminen reageren doorgaans zonder dat er verhitting nodig is. Aniline produceert bijvoorbeeld acetanilide, dat oxidatie tijdens de daaropvolgende nitrering voorkomt.
N-Acetyleringsreacties verlopen doorgaans sneller dan acetylering van OH-groepen, waardoor gedeeltelijke acetylering van verbindingen met meerdere functionele groepen mogelijk is. Voorbeelden hiervan zijn de productie van N-acetylaminozuren zoals N-acetylmethionine-S-oxide (1) en N-acetylantranilzuren (2).

Amiden en carbamiden met vrije NH-groepen, zowel alifatisch als aromatisch, kunnen worden geacetyleerd met behulp van azijnzuuranhydride.
Zwavelzuur wordt vaak gebruikt als katalysator. Deze reactie vindt toepassing bij de synthese van verschillende producten zoals N,N,N’,N’-tetraacetylethyleendiamine ((CH3CO)2NCH2CH2N(COCH3)2) en 2,4,6,8-tetraacetylazabicyclo[3.3.1]nonaan-3,7-dion.
![2,4,6,8-tetraacetylazabicyclo[3.3.1]nonane-3,7-dione.](https://chemcess.com/wp-content/uploads/2023/07/2468-tetraacetylazabicyclo3.3.1nonane-37-dione.jpg)
2.1.3. C-Acetylering
Verbindingen met reactieve CH-bindingen kunnen acetylering ondergaan met azijnzuuranhydride, waarvoor soms een katalysator nodig is. Bekende voorbeelden zijn de productie van ethyl-α-cyanoacetoacetaat (CH3COCH(CN)COOC2H5) met kaliumcarbonaat als katalysator en de Friedel-Crafts-reactie tussen azijnzuuranhydride en aromatische koolwaterstoffen zoals benzeen, wat resulteert in de vorming van acetofenon.
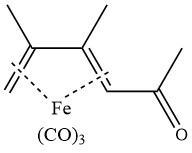
Acetylering van 2,3-dimethylbutadieentricarbonylijzer in aanwezigheid van aluminiumchloride levert het volgende complex op:
De reactie van ketonen met azijnzuuranhydride, gekatalyseerd door boortrifluoride, leidt tot de vorming van β-diketonen.
Triacetylmethaan kan direct worden gesynthetiseerd uit isopropenylacetaat, azijnzuuranhydride en een aluminiumchloridekatalysator.
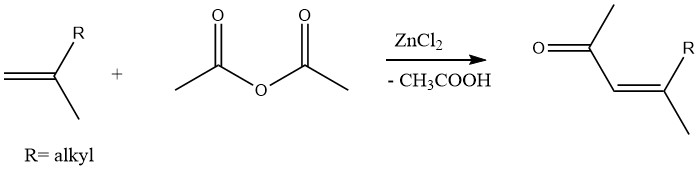
Op dezelfde manier kunnen onverzadigde methylketonen worden geproduceerd door de acetylering van olefinen met azijnzuuranhydride in aanwezigheid van zinkchloride als katalysator:
2.1.4. Acetylering van minerale zuren
De reactie van azijnzuuranhydride met salpeterzuur resulteert in de vorming van acetylnitraat, dat vaak wordt gebruikt als nitreringsmiddel in de organische chemie. Acetylnitraat kan ook worden gesynthetiseerd met behulp van distikstofpentoxide en azijnzuuranhydride.
Andere sterke zuren zoals zwavelzuur, sulfonzuren en zoutzuur kunnen gemengde anhydriden vormen met azijnzuuranhydride. Door azijnzuuranhydride te laten reageren met fosforzuur ontstaat 1-hydroxyethaan-1,1-difosfonzuur.

2.1.5. Acetylering van oxiden
Antimoontrioxide reageert met azijnzuuranhydride om antimoontriacetaat (Sb(OCOCH3)3) te produceren. Een soortgelijke reactie met chroomtrioxide leidt tot chromylacetaatoplossingen, die vaak worden gebruikt bij de oxidatie van olefinen en koolwaterstoffen, maar voorzichtigheid is geboden omdat ze soms explosief kunnen zijn.
2.1.6. Acetylering van zouten
Verschillende zouten reageren met carbonzuuranhydriden op een manier die vergelijkbaar is met hun overeenkomstige vrije zuren:
Li−C−CR + (CH3CO)2O → CH3CO−C−CR + CH3COOLi
Bariumperoxide behandeld met azijnzuuranhydride produceert diacetylperoxide:
BaO2 + (CH3CO)2O → (CH3CO)2O2 + BaO
Een algemene methode voor het produceren van vinylketonen omvat de reactie van vinylmagnesiumbromiden met azijnzuuranhydride.
2.1.7. Productie van Acetoxy Silanen
Azijnzuuranhydride reageert met silanen volgens de vergelijking:

waarbij X = H, Cl, OR, NR2.
2.1.8. Additie aan heterocyclische verbindingen met ringsplitsing
Deze reacties zijn conceptueel vergelijkbaar met die hierboven beschreven. Ethyleenglycoldiacetaat kan bijvoorbeeld worden geproduceerd uit ethyleenoxide in aanwezigheid van sterk zure of basische katalysatoren, en oxymethyleendiacetaten kunnen worden verkregen uit trioxaan.
2.1.9. Oxidatieve additie aan koolstof-koolstof dubbele bindingen
Oxidatieve additiereacties resulteren in de vorming van overeenkomstige diacetaten. De additie van ethyleen aan azijnzuuranhydride levert bijvoorbeeld ethyleenglycoldiacetaat op. Op dezelfde manier kan butadieen worden omgezet in 1,4-diacetoxy-2-buteen via een soortgelijk proces.
2.1.10. Productie van gemengde diacylperoxiden
Diacylperoxiden kunnen worden gesynthetiseerd door zuurstof te laten reageren met mengsels van alifatische aldehyden en azijnzuuranhydride in aanwezigheid van natriumacetaat.
2.1.11. Reactie met N-oxiden
Reacties met N-oxiden leveren verschillende producten op, afhankelijk van het specifieke type N-oxide. Pyridine-N-oxide produceert bijvoorbeeld 2-acetyloxypyridine, terwijl 4-picoline-N-oxide een mengsel vormt van 4-acetyloxymethylenepyridine en 3-acetyloxy-4-methylpyridine. De Polonovski-reactie van N-oxiden resulteert in de vorming van formaldehyde, onverzadigde aldehyden en zuuramiden.
2.1.12. Reactie met S-oxiden
De reductie van sulfoxiden tot sulfiden met behulp van azijnzuuranhydride staat bekend als de Pummerer-reactie. Bijvoorbeeld, CH3SOR reageert met azijnzuuranhydride om CH3COOCH2SR en CH3COOH te produceren.
Deze reactie wordt ook gebruikt om primaire en secundaire alcoholen te oxideren, zelfs die welke sterisch gehinderd zijn, met behulp van mengsels van dimethylsulfoxide of tetramethyleensulfoxide samen met azijnzuuranhydride, wat resulteert in de vorming van de overeenkomstige carbonylverbindingen.
2.1.13. Productie van acylalen en vinylacetaten
Aldehyden reageren met azijnzuuranhydride in aanwezigheid van zure katalysatoren om acylalen te vormen. Als het aldehyde een α-waterstofatoom bezit, leidt eliminatie van azijnzuur tot de vorming van het overeenkomstige vinylacetaat. De toevoeging van zink vergemakkelijkt de splitsing van de azijnzuurgroep. Dit proces is met name geschikt voor de synthese van 2,2-dichloorvinylacetaat.
2.1.14. Boortrifluoride
Azijnzuuranhydride en gesubstitueerde azijnzuuranhydriden kunnen worden omgezet in acetylketonen met behulp van een boortrifluoridecomplex dat ontbindt in warm water.
2.2. Dehydratie
Azijnzuuranhydride wordt gebruikt als dehydratiemiddel in verschillende industrieën, waaronder de explosievenindustrie. Een opmerkelijk voorbeeld van de dehydraterende eigenschap is de productie van hexogeen (1,3,5-trinitrohexahydro-1,3,5-triazine).

Bij de synthese van de nitroester van 1,2,4,5-tetrahydroxy-3,6-dinitrocyclohexaan wordt azijnzuuranhydride gebruikt vanwege zijn waterbindend vermogen:

Bovendien wordt azijnzuuranhydride gebruikt bij de productie van alkylcyaniden door aldoximen te dehydrateren:
RCH=NOH + (CH3CO)2O → RCN + 2 CH3COOH
Bovendien dient azijnzuuranhydride als een dehydraterend middel in talrijke cyclisatiereacties.
2.3. Reacties van de α-protonen
De Perkin-reactie is een veelgebruikte methode voor de synthese van α, β-onverzadigde zuren uit aromatische aldehyden, waaronder benzaldehyde. Deze reactie vindt doorgaans plaats in aanwezigheid van kaliumacetaat of natriumacetaat. Het wordt ook gebruikt voor de productie van cinnamalazijnzuur.
Vergelijkbare reacties omvatten oxidatieve carboxymethylering, waarbij azijnzuuranhydride en oxidatiemiddelen worden gebruikt, en de omzetting van langketenige alkenen in hun overeenkomstige carbonzuurderivaten.
2.4. Reacties van een enkele carbonylgroep
In bepaalde gevallen is het mogelijk dat slechts één van de carbonylgroepen in azijnzuuranhydride deelneemt aan een reactie. Wanneer azijnzuuranhydride bijvoorbeeld reageert met waterstofcyanide in aanwezigheid van een base, vormt het verbinding (3). Op dezelfde manier levert azijnzuuranhydride in aanwezigheid van een Grignard-reagens (RMgBr) verbinding (4) op.

2.5. Productie van zilverketeenide
Wanneer zilveracetaat en azijnzuuranhydride reageren in aanwezigheid van pyridine bij kamertemperatuur, ondergaan ze een reactie om een pyridinecomplex van zilverketeenide te vormen. Als een overmaat aan azijnzuuranhydride wordt gebruikt, kan het resulterende mengsel worden onderworpen aan fractionele destillatie van pyridine en azijnzuur, wat leidt tot de isolatie van zilverketeenide.
3. Productie van azijnzuuranhydride
Historisch gezien was de oudste methode voor het produceren van azijnzuuranhydride de omzetting van natriumacetaat met een overmaat aan een anorganisch chloride, zoals thionylchloride, sulfurylchloride of fosforylchloride.
In dit proces wordt de helft van het natriumacetaat omgezet in acetylchloride, dat vervolgens reageert met het resterende natriumacetaat om azijnzuuranhydride te vormen.
Een andere ontwikkeling was de omzetting van azijnzuur met fosgeen in aanwezigheid van aluminiumchloride, wat een continue werking mogelijk maakte:
2 CH3COOH + COCl2 → (CH3CO)2O + 2 HCl + CO2
Twee andere methoden die in het verleden werden gebruikt, omvatten de splitsing van ethylideendiacetaat om acetaldehyde en azijnzuuranhydride te vormen in aanwezigheid van zure katalysatoren zoals zinkchloride, evenals de reactie van vinylacetaat met azijnzuur op palladium(II)-katalysatoren om acetaldehyde en azijnzuuranhydride te vormen. Deze processen zijn echter niet langer van industrieel belang.
Momenteel wordt de productie van azijnzuuranhydride voornamelijk uitgevoerd via het keteenproces of de oxidatie van acetaldehyde. Een andere methode, bekend als de carbonylering van methylacetaat (Halcon-proces), werd in 1983 geïntroduceerd.
In West-Europa wordt ongeveer 77% van het azijnzuuranhydride geproduceerd via het keteenproces, terwijl 23% wordt geproduceerd via de oxidatie van acetaldehyde.
In de Verenigde Staten wordt sinds de introductie van het Halcon-proces in de Tennessee-Eastman-fabriek 25% van het azijnzuuranhydride geproduceerd via deze methode, terwijl 75% wordt geproduceerd via het keteenproces.
3.1. Productie van azijnzuuranhydride via het keteenproces
Het keteenproces omvat twee stappen: de thermische splitsing van azijnzuur om keteen te vormen en de daaropvolgende reactie van keteen met azijnzuur om azijnzuuranhydride te produceren. De algehele reacties kunnen als volgt worden samengevat:
1. Thermische splitsing van azijnzuur:
CH3COOH → CH2=C=O + H2O (ΔH = 147 kJ/mol)
2. Reactie van keteen met azijnzuur:
CH2=C=O + CH3COOH → (CH3CO)2O (ΔH = -63 kJ/mol)
De thermische splitsing van azijnzuur om keteen en water te produceren, wordt uitgevoerd door hete azijnzuurdamp te verhitten tot een temperatuur van 700-750 °C in aanwezigheid van sporen fosforzuurkatalysator.
De reactordruk wordt doorgaans verlaagd om de isolatie van keteen mogelijk te maken voordat het reageert met azijnzuur of water. Het splitsingsproces vindt plaats in een multicoilreactor met spoelen gemaakt van zeer hittebestendige staallegeringen, zoals Sicromal.
Het keteenproces omvat meerdere stappen en apparatuurconfiguraties, afhankelijk van de gewenste productiecapaciteit.
Bij kleinschalige operaties worden aparte voorverwarmings- en splijtovens gebruikt, terwijl middelgrote ovens vaak worden gebouwd als ovens met één kamer die worden verwarmd met gas of olie.
Grote ovens werken effectief met drie- of vierkamersystemen en gedeeltelijke gasstromen. Meerdere ovens kunnen ook worden bediend met azijnzuur dat wordt aangevoerd vanuit een centrale verdamper.
Na de thermische splitsing van azijnzuur wordt het resulterende keteen vervolgens omgezet met azijnzuur om azijnzuuranhydride te produceren. Voor deze reactie worden gewoonlijk twee processen gebruikt: het scrubberproces en het Wackerproces.
Bij het scrubberproces wordt keteen geabsorbeerd door circulerend ijsazijnzuur in scrubbers gevuld met Raschig-ringen. Het keteen wordt grotendeels geabsorbeerd in de eerste scrubber en het vloeibare mengsel dat ruw anhydride bevat, wordt verzameld en gekoeld.
Bij het Wacker-proces wordt het keteen door een vloeistofringpomp gepompt, waar het reageert met azijnzuur bij gecontroleerde temperatuur en druk. Het ruwe anhydride wordt continu verzameld en een deel ervan wordt teruggevoerd naar de reactiepomp.
Het ruwe anhydride dat uit de reactie wordt verkregen, wordt verder gezuiverd door middel van destillatie. Er worden zowel continue als discontinue destillatiemethoden gebruikt.
Bij discontinue destillatie worden drie fracties verkregen: voorloop, middenloop en zuiver anhydride.
Continue destillatie omvat meerdere kolommen om de verschillende fracties te scheiden. De zuiverheid van het anhydride is doorgaans ongeveer 99% bij discontinue destillatie, maar kan worden verbeterd door te werken onder verminderde druk.
Het Wacker-proces wordt ook gebruikt voor het opwerkingsproces, waardoor afvalzuren kunnen worden verwerkt zonder dat er extra materialen nodig zijn. Het proces heeft een hoge betrouwbaarheid en energiebesparende functies.
Voor de productie van 100 kg azijnzuuranhydride is ongeveer 122 kg azijnzuur nodig, rekening houdend met het opnieuw geconcentreerde verdunde azijnzuur. De opbrengst van het proces is meer dan 96% bij ongeveer 75% splitsing.
3.2. Productie van azijnzuuranhydride door oxidatie van Aceetaldehyde
Azijnzuuranhydride kan ook direct worden geproduceerd door de oxidatie van acetaldehyde in de vloeistoffase. Dit proces omvat de reactie van perazijnzuur, gevormd uit zuurstof en acetaldehyde, met een tweede molecuul acetaldehyde om azijnzuuranhydride en water te produceren.
Efficiënte koeling en het gebruik van geschikte katalysatoren zijn cruciaal in dit proces. Metaalzoutcombinaties, zoals mangaanacetaat en koperacetaat, kobaltacetaat en nikkelacetaat, of kobalt- en koperzouten van hogere vetzuren, zijn veelgebruikte katalysatoren.
Om de reactietemperatuur te handhaven en snelle hydrolyse van azijnzuuranhydride te voorkomen, wordt het proces doorgaans uitgevoerd tussen 40 °C en 60 °C.
Effectieve koeling is noodzakelijk vanwege de exotherme aard van de reactie, en de toevoeging van laagkokende oplosmiddelen zoals methylacetaat en ethylacetaat, die azeotrope mengsels vormen met water, helpt bij de scheiding van water uit het reactiemengsel.
De verhouding van azijnzuuranhydride tot azijnzuur in het eindproduct hangt af van de initiële verhouding van ethylacetaat tot acetaldehyde.
In de praktijk wordt een mengsel van acetaldehyde en ethylacetaat geoxideerd door toevoeging van kobaltacetaat- en koperacetaatkatalysatoren. De geoptimaliseerde reactieomstandigheden kunnen leiden tot een hogere verhouding van azijnzuuranhydride tot azijnzuur. Verschillende oplosmiddelen, waaronder methyleenchloride, diisopropylether, cyclohexanon en ethylideendiacetaat, kunnen als verdunningsmiddelen in het proces worden gebruikt.
Het gasmengsel dat zuurstof en acetaldehyde bevat, wordt in de reactor gebracht, waar de oxidatie in de vloeibare fase plaatsvindt in aanwezigheid van katalysatoren. Het reactoreffluent wordt vervolgens door een watergekoelde condensor geleid, die ook fungeert als een separator voor niet-condenseerbare gassen.
Verse acetaldehyde wordt in een gepakte kolom gebracht, waar het zich combineert met het afgas van de condensor. De condensaten van de condensor en de kolom worden gedestilleerd om het gewenste product te verkrijgen.
Acetaldehyde wordt gewonnen uit de niet-condenseerbare gasstroom. Het afgas kan brandbare laagkokende producten en oplosmiddelen bevatten, die kunnen worden afgefakkeld.
Het hierboven beschreven proces is een voorbeeld en variaties van reactorconfiguraties en specifieke reactieomstandigheden kunnen door verschillende fabrikanten worden gebruikt.
3.3. Productie van azijnzuuranhydride door carbonylering van methylacetaat
Het conventionele proces voor de productie van azijnzuuranhydride omvat de thermische ontleding van azijnzuur om keteen te vormen, wat een aanzienlijke hoeveelheid energie vereist.
Er zijn echter alternatieve processen ontwikkeld, zoals het azijnzuurproductieproces van Monsanto en de carbonylering van methylacetaat.
De carbonylering van methylacetaat om azijnzuuranhydride te vormen werd in 1973 gepatenteerd door Halcon en de eerste fabriek die dit proces gebruikte, was operationeel in 1983. In dit proces wordt methylacetaat gecarbonyleerd in de vloeibare fase bij temperaturen variërend van 160 °C tot 190 °C en een koolmonoxidepartiële druk van 2-5 MPa.
Verschillende katalysatoren kunnen worden gebruikt voor de carbonyleringsreactie, waaronder rhodium- en nikkelverbindingen geactiveerd door jodiden of andere jodiumhoudende stoffen. Rhodiumkatalysatoren vertonen een hogere activiteit dan nikkelkatalysatoren en beide katalysatoren vertonen een selectiviteit van meer dan 95%.
De toevoeging van een klein percentage waterstof aan het koolmonoxide dat wordt gebruikt bij de synthese verbetert de activiteit en levensduur van de katalysatoren. Chroomverbindingen kunnen ook worden gebruikt om de inductiefase van de reactie te verkorten.
Het carbonyleringsproces kan beginnen met methylacetaat of dimethylether, waarbij de laatste wordt omgezet in methylacetaat voordat deze wordt getransformeerd tot azijnzuuranhydride.
Het Halcon-proces (Figuur 1) omvat bijvoorbeeld het continu voeden van gedroogd methylacetaat in een reactor die is bekleed met Hastelloy, waar het wordt gecarbonyleerd bij 175 °C in aanwezigheid van een katalysatormengsel.

a) Compressor; b) Carbonyleringsreactor; c) Verdamper; d) Adsorber; e) Destillatiekolom; f) Condensor; g) Scrubber
De warmte die tijdens de reactie wordt gegenereerd, wordt afgevoerd door warmtewisseling en gebruikt voor het voorverwarmen van methylacetaat en het genereren van lagedrukstoom. Niet-gereageerde koolmonoxide wordt gerecycled na het verwijderen van condenseerbare gassen.
Een zijstroom wordt gewassen met zuiver azijnzuuranhydride om de opbouw van inerte gassen te voorkomen. Het vloeibare reactieproduct dat de reactor verlaat, ondergaat flashdestillatie om katalysatorbevattende vloeistof af te scheiden voor recycling.
Het ruwe anhydride wordt verder gezuiverd door destillatie in drie opeenvolgende kolommen, waarbij de laatste kolom azijnzuuranhydride produceert met een zuiverheid van 99%.
Om het jodidegehalte in het zuivere anhydride te verlagen, kan een oplossing van kaliumacetaat in azijnzuuranhydride worden toegevoegd tijdens het destillatieproces.
Deze alternatieve processen bieden voordelen ten opzichte van de conventionele thermische ontledingsroute in termen van energieverbruik en grondstofgebruik, waardoor de productie van azijnzuuranhydride uit andere bronnen dan olie, zoals steenkool, mogelijk is.
4. Toepassingen van azijnzuuranhydride
Azijnzuuranhydride wordt gebruikt als acetyleringsmiddel en dehydratiemiddel. Een belangrijke toepassing is de acetylering van cellulose op grote schaal. Er zijn echter verschillende andere gebieden waar azijnzuuranhydride wordt gebruikt:
- Productie van poly(methylacrylimide) hardschuim, waar het fungeert als bindmiddel voor vrijgekomen ammoniak tijdens de omzetting van amidegroepen in imidegroepen.
- Geacetyleerde kunststofhulpstoffen, waaronder glyceroltriacetaat, acetyltributylcitraat en acetylricinolaat.
- Productie van explosieven, met name bij de vervaardiging van hexogeen.
- Productie van bepaalde soorten remvloeistoffen.
- Productie van hulpstoffen voor boorvloeistoffen.
- Detergentenindustrie, met name bij de productie van koudbleekactivatoren zoals tetraacetylethyleendiamine.
- Verfindustrie, waar azijnzuuranhydride, in combinatie met salpeterzuur, wordt gebruikt als nitreringsmiddel, gebruikmakend van de oplosmiddel- en dehydraterende eigenschappen.
- Bereiding van verschillende organische tussenproducten, zoals chlooracetylchloride, diacetylperoxide, hogere carbonzuuranhydriden, acetaten en het boortrifluoridecomplex.
- Productie van farmaceutische producten, waaronder acetylsalicylzuur (aspirine), p-acetylaminofenol, acetanilide, acetofenacetine, theofylline, acetylcholinechloride, sulfonamiden, hormonen, vitaminen en het röntgencontrastmiddel 2,4,6-trijood-3,5-diacetylamidobenzoëzuur.
- Toepassingen in de voedingsmiddelenindustrie, voornamelijk in de acetylering van dierlijke en plantaardige vetten om de gewenste oplosbaarheid te bereiken, productie van acetostearines (eetbare verpakkingsmaterialen) en klaring van plantaardige oliën.
- Smaken en geuren, waar het wordt gebruikt bij de productie van esters en cumarine.
- Herbiciden zoals metolachloor (Dual) en alachloor (Lasso).
Referenties
- Acetic Anhydride and Mixed Fatty Acid Anhydrides; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_065
- https://lotus.naturalproducts.net/compound/lotus_id/LTS0216280
