Trimetilammina: proprietà, reazioni, produzione e usi
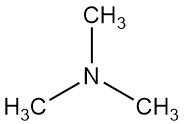
La trimetilammina è un composto organico con formula N(CH3)3. È un gas incolore o un liquido compresso con un forte odore di pesce a basse concentrazioni. A concentrazioni più elevate, l’odore diventa più simile all’ammoniaca.
La trimetilammina è un composto naturale presente in piccole quantità in molte piante e animali. È anche prodotto dalla scomposizione di materia organica, come pesce e altri frutti di mare. Nel corpo umano, è prodotto dai batteri intestinali quando scompongono determinati alimenti.
Sommario
1. Proprietà fisiche della trimetilammina
La trimetilammina ha un odore di pesce più forte rispetto alle altre metilammine (metilammina e dimetilammina). Il naso umano può rilevare la trimetilammina a una bassa concentrazione di <10 ppb prodotta dalla decomposizione di piante e animali.
L’idrato cristallino (CH3)3N·10 H2O si forma raffreddando soluzioni acquose sature di trimetilammina. A pressione atmosferica, forma azeotropi a minimo punto di ebollizione con ammoniaca e altre metilammine.
La trietilammina è solubile in vari solventi organici, tra cui metanolo, etanolo, dimetilformammide ed etilenglicole, e le sue soluzioni acquose possono dissolvere molti composti inorganici e organici.
Alcune proprietà fisiche della trimetilammina sono elencate nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Peso molecolare, g/mol | 59,11 |
| Punto di ebollizione (101,33 kPa), °C | 2,8 |
| Punto di fusione, °C | -117,1 |
| Densità (a 25 °C, liquido), g/cm3 | 0,6331 |
| pKa (a 25 °C) | 9,80 |
| Indice di rifrazione a 0 °C | 1,3631 |
| Tensione superficiale (25 °C), 10-3 N/m | 13,47 |
| Calore di vaporizzazione a 25 °C, kJ/mol | 22,864 |
| Calore di vaporizzazione al punto di ebollizione, kJ/mol | 27,708 |
| Calore di fusione, kJ/mol | 6,548 |
| Calore di formazione standard a 25 °C (liquido), kJ/mol | -45,80 |
| Calore di formazione standard a 25 °C (gas), kJ/mol | -23,86 |
| Calore di combustione, stato standard a 25 °C, liquido, kJ/mol | -2422,60 |
| Capacità termica, gas ideale (25 °C), J K-1 mol-1 | 91,8 |
| Temperatura critica, °C | 160,1 |
| Pressione critica, MPa | 4,07 |
| Costante dielettrica (25 °C), liquido | 2,44 |
| Momento di dipolo nel benzene (25 °C), D | 0,87 |
| Punto di infiammabilità (vaso chiuso), °C | -71 |
| Temperatura di accensione nell'aria, °C | 190 |
| Limite inferiore di esplosione in aria, vol % | 2 |
| Limite superiore di esplosione in aria, vol % | 11,6 |
2. Reazioni chimiche della trimetilammina
La trimetilammina è una base debole che forma sali come il cloruro di trimetilammonio con acido cloridrico. Questa reazione coinvolge la coppia solitaria di elettroni sull’atomo di azoto.
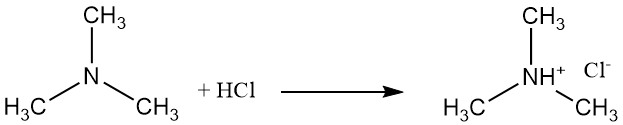
Nella fase gassosa, la basicità delle metilammine aumenta in base alla sostituzione del gruppo metilico, come segue:
(CH3)3N > (CH3)2NH > CH3NH2 > NH3
Tuttavia, in soluzione acquosa, la basicità della trimetilammina è inferiore a quella della dimetilammina e della metilammina. Ciò è attribuito alla più scarsa solvatazione dello ione trimetilammonio, (CH3)3NH+, che ha solo un idrogeno disponibile per il legame idrogeno con le molecole d’acqua.
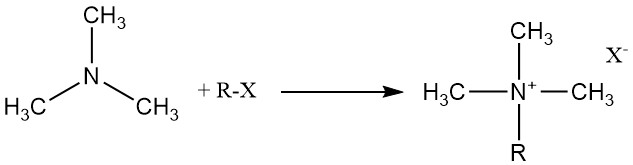
La trimetilammina reagisce con acidi organici e inorganici, alogenuri alchilici ed epossidi per formare sali di ammonio quaternario.
La reazione della trimetilammina con l’ossido di etilene produce una base di colina o cloruro di colina quando si utilizza il cloruro di trimetilammonio.

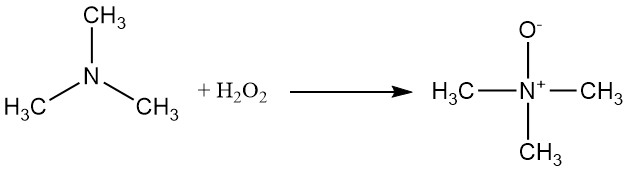
La trimetilammina può essere ossidata con perossido di idrogeno o un peracido per produrre ossido di trimetilammina.
3. Produzione industriale di trimetilammina
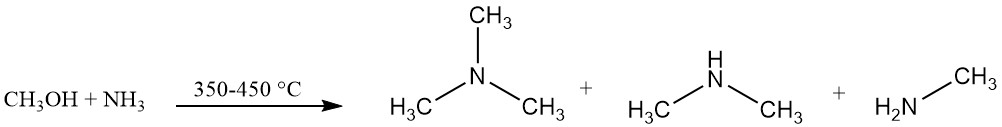
La trimetilammina viene prodotta industrialmente dalla reazione di ammoniaca e metanolo in presenza di un catalizzatore, in genere un catalizzatore a base di allumina, a 350–450 °C. Questa reazione produce trimetilammina insieme a dimetilammina e metilammina.
L’equilibrio di reazione favorisce la formazione di trimetilammina, ma la domanda di mercato è maggiore per la monoetilammina e in particolare per la dimetilammina.
L’uso di catalizzatori acidi solidi amorfi, tra cui allumine, silici e fosfati, favorisce la formazione di trimetilammina in contrasto alle zeoliti selettive per forma che sono selettive per la produzione di dimetilammina.
La miscela risultante contiene materiali non reagiti (ammoniaca, metanolo) insieme ai prodotti desiderati (monoetilammina, dimetilammina e trimetilammina), acqua generata durante la reazione e altri sottoprodotti.
Una serie di quattro o cinque colonne di distillazione separa e purifica i singoli componenti. La trimetilammina anidra pura viene recuperata dalla miscela mediante distillazione estrattiva con acqua per rompere la miscela azeotropica formata con le altre metilammine.
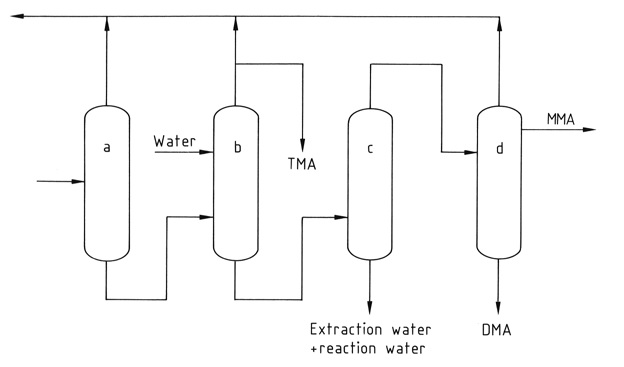
a) Colonna di ammoniaca; b) Colonna di distillazione estrattiva; c) Colonna per la rimozione dell'acqua; d) Colonna di prodotto MMA e DMA
*MMA: metilammina; DMA: dimetilammina; TMA; trimetilammina
4. Usi della trimetilammina
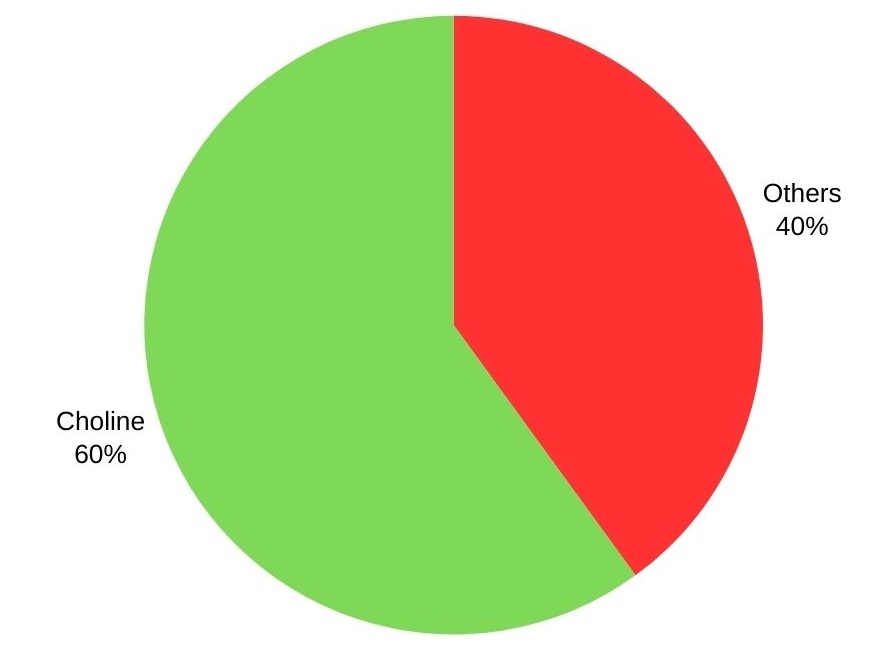
La trimetilammina è usata principalmente per produrre colina e i suoi sali, con oltre il 60%. Altre applicazioni includono la produzione di amidi cationici, disinfettanti, agenti di flottazione, dolcificanti intensi e resine a scambio ionico.
La trimetilammina è usata come catalizzatore nella produzione di idrossidi e sali di ammonio quaternario.
Può anche essere usata per attrarre insetti e viene aggiunta al gas naturale inodore come misura di sicurezza per rilevare perdite.
5. Tossicologia della trimetilammina
La trimetilammina è un liquido o gas altamente infiammabile irritante per la pelle, gli occhi e le vie respiratorie e causa edema polmonare (accumulo di liquidi nei polmoni).
Limiti di esposizione
- National Institute for Occupational Safety and Health (NIOSH): 10 ppm (media) e 15 ppm (a breve termine)
- American Conference of Governmental Industrial Hygienists (ACGIH): 5 ppm (media) e 15 ppm (a breve termine)
Effetti sulla salute
- Acuto (a breve termine): irritazione della pelle e degli occhi, irritazione delle vie respiratorie, tosse, mancanza di respiro. Un’esposizione grave può causare edema polmonare.
- Cronico (a lungo termine): non vi sono prove conclusive di cancerogenicità o effetti riproduttivi. Altri effetti sulla salute a lungo termine non sono ancora completamente caratterizzati.
Manipolazione e stoccaggio
- Conservare lontano da agenti ossidanti, mercurio, ossido di etilene, acidi forti, metalli e basi forti.
- Mantenere un’area di stoccaggio fresca e ben ventilata.
- Eliminare fonti di accensione come fumo e fiamme libere.
- Mettere a terra e collegare i contenitori metallici durante il trasferimento.
- Utilizzare utensili e attrezzature antiscintilla.
Riferimenti
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/1927.pdf
