Reazioni chimiche delle ammine alifatiche
Le ammine alifatiche, caratterizzate dalla presenza di un gruppo funzionale amminico legato a una catena di carbonio, esibiscono diverse reazioni chimiche dovute alla coppia di elettroni solitaria sull’atomo di azoto e alla tendenza degli atomi di idrogeno legati all’azoto a essere sostituiti da altri gruppi.
Sommario
1. Formazione di sali di ammine
Un aspetto importante delle ammine alifatiche è la loro capacità di formare sali quando reagiscono con gli acidi. A causa dei sostituenti alchilici che trasportano, le ammine alifatiche sono basi più forti dell’ammoniaca. Di conseguenza, reagiscono facilmente con gli acidi per formare sali solubili in acqua che sono insolubili nei solventi organici.

Questa proprietà rende le ammine eccellenti accettori di acidi e solventi utili nei processi di lavaggio e estrazione dei gas (ad esempio, nella sintesi di penicilline semisintetiche).
In particolare, le ammine terziarie come trimetilammina, tributilammina ed etildiisopropilammina sono ampiamente impiegate come accettori di protoni e catalizzatori nella sintesi organica perché possono essere rimosse dalla miscela organica dopo la reazione.
2. Conversione in carbossammidi
La reazione tra ammine e acidi carbossilici, nonché i loro esteri, cloruri e anidridi, porta alla produzione di carbossammidi sostituite:

Questa trasformazione generalmente si traduce in rese elevate, in particolare quando si impiegano cloruri di acido carbossilico, che è una reazione altamente esotermica. Quando si reagisce con acidi carbossilici, la reazione spesso cessa alla formazione del sale di ammonio iniziale.
Questo tipo di reazione trova un’applicazione industriale significativa, come nella sintesi di vari erbicidi che possiedono una struttura di ammide acida.
Quando un’alchilammina reagisce con un lattone attraverso questo processo, viene generato un lattame. Un esempio notevole di questa reazione è la formazione di 1-etil-2-pirrolidone dalla combinazione di etilammina e γ-butirrolattone.
3. Conversione di ammine in sulfonamidi
La reazione di ammine alifatiche con cloruro di benzenesolfonile viene utilizzata per distinguere tra ammine primarie, secondarie e terziarie, comunemente nota come test di Hinsberg. Inoltre, questa reazione può essere utilizzata per la separazione preparativa di questi tipi di ammine.
In questo test, le ammine primarie producono N-alchil benzenesolfonammidi solubili in alcali, mentre le ammine secondarie producono N,N-dialchil benzenesolfonammidi insolubili in alcali. Le ammine terziarie, d’altro canto, non mostrano alcuna reattività in queste condizioni specifiche.
Va notato che possono sorgere delle limitazioni con le ammine primarie a catena lunga, in quanto possono rimanere insolubili in alcali nonostante la presenza di idrogeno acido. Le ammine terziarie possono anche subire la quaternizzazione con cloruro di solfonile, portando a risultati di reazione alterati.

Le sulfonamidi un tempo hanno svolto un ruolo fondamentale come farmaci nel trattamento delle infezioni batteriche, salvando innumerevoli vite durante la seconda guerra mondiale. Tuttavia, da allora sono state sostituite da alternative più sicure come la penicillina e altri antibiotici.
4. Reazione delle ammine con composti carbonilici
In condizioni di reazione specifiche e con composti adatti, i composti carbonilici possono subire reazioni con le ammine, con conseguente formazione di immine (basi di Schiff) (2) o enammine (3). Questi prodotti possono ulteriormente subire idrogenazione per produrre ammine più altamente alchilate. Questa reazione ha un’importanza significativa come metodo per sintetizzare ammine superiori.
Vale la pena notare che gli emiaminali intermedi (1) formati durante la reazione di solito non sono isolabili. Le aldeidi generalmente reagiscono più velocemente dei chetoni. Le ammine secondarie formano esclusivamente enammine, mentre le ammine terziarie non producono nessuno dei due prodotti.

Una reazione che coinvolge un’ammina, un’aldeide e un composto che possiede un atomo di idrogeno attivato, come un chetone, porta alla formazione di una base di Mannich.
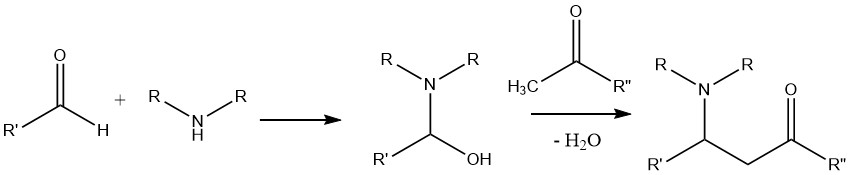
In questa reazione, il prodotto di condensazione formato tra l’aldeide e l’ammina è soggetto all’attacco del composto acido α-C—H, che ha origine dal chetone.
5. Reazione delle ammine con anidride carbonica e disolfuro di carbonio
L’acido carbammico o ditiocarbammico generato durante questa reazione mostra instabilità, ma può essere isolato sotto forma di sale o estere.

I ditiocarbammati derivati da diverse ammine hanno un’importanza significativa come acceleratori di vulcanizzazione nell’industria della gomma.
6. Reazione delle ammine con gli epossidi
Quando le ammine primarie subiscono una reazione con gli epossidi, si forma una miscela di derivati mono- e diossialchilati. D’altro canto, le ammine secondarie producono esclusivamente composti monoossialchilati, mentre le ammine terziarie producono composti di ammonio quaternario.
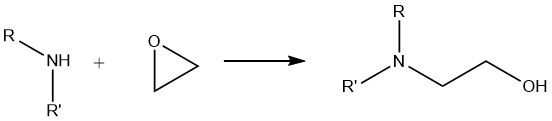
Questa reazione di alcossilazione è molto importante nell’applicazione industriale delle ammine alifatiche. È ampiamente utilizzata nella sintesi di flocculanti, resine di rivestimento superficiale, intermedi farmaceutici e prodotti impiegati nei processi di lavaggio dei gas come etanolammina e propanolamina.
7. Alchilazione delle ammine
La reazione delle ammine con alogenuri alchilici e solfati dialchilici porta infine alla formazione di composti di ammonio quaternario, che trovano ampia applicazione nella chimica farmaceutica preparativa e nella sintesi di agenti anticorrosione e biocidi.
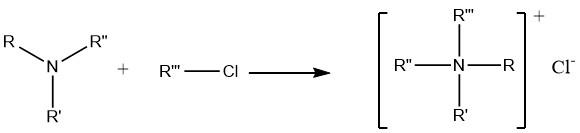
Tuttavia, la reazione tra alogenuri alchilici e ammoniaca non è particolarmente utile per la preparazione di ammine primarie o secondarie. Ciò è dovuto alla maggiore basicità delle ammine primarie e secondarie, che le porta ad attaccare preferenzialmente gli alogenuri piuttosto che subire reazioni di sostituzione.
Tuttavia, le ammine terziarie possono ancora essere preparate tramite queste reazioni. Nelle sintesi su scala di laboratorio, le ammine primarie possono essere ottenute utilizzando esametilentetrammina, mentre le ammine secondarie possono essere sintetizzate utilizzando cianammide.
8. Formazione di isocianati e uree
La reazione tra fosgene e ammine primarie produce inizialmente il corrispondente cloruro di carbonile. La successiva scissione dell’acido cloridrico porta alla formazione di isocianato di alchile. L’ammina in eccesso reagisce quindi con l’isocianato, con conseguente formazione di uree.
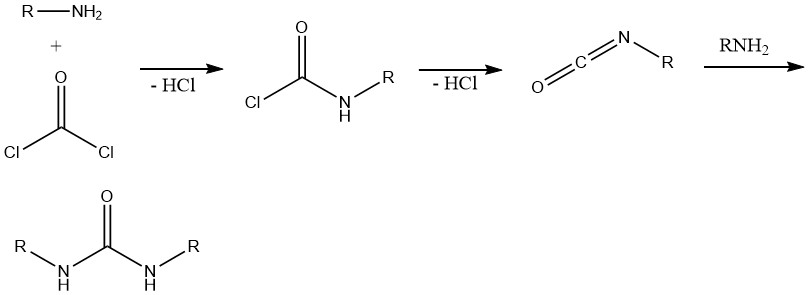
Questa reazione è importante nella sintesi di vari erbicidi contenenti strutture di urea, carbammato o tiocarbammato e nei sistemi amminici polifunzionali, principalmente nella chimica del poliuretano.
Allo stesso modo, le ammine secondarie reagiscono con il fosgene tramite un analogo cloruro intermedio, portando alla formazione di N,N’-tetraalchiluree.
9. Reazione delle ammine con l’acrilonitrile
L’aggiunta su scala industriale di un’ammina primaria o secondaria all’acrilonitrile, nota come addizione di 1,2-Michael, è ampiamente utilizzata per la sintesi di diammine e poliammine superiori. Questa reazione è favorita perché la funzionalità nitrilica può essere facilmente idrogenata nell’ammina corrispondente.

10. Formazione di isonitrili
In condizioni basiche, le ammine primarie subiscono una reazione con il triclorometano per produrre isonitrili.
L’odore forte e sgradevole degli isonitrili consente di utilizzare questa reazione come test per la presenza di ammine primarie. Inoltre, per le ammine inferiori, questa reazione può anche essere impiegata come metodo di sintesi.
Un approccio alternativo prevede l’uso di N-alchilformammidi come materiali di partenza per la sintesi di isonitrili.
11. Ossidazione delle ammine
Le ammine libere sono sensibili all’ossidazione, contrariamente ai loro sali, con conseguente formazione di vari prodotti a seconda dell’agente ossidante e del tipo di ammina coinvolta.
Le ammine terziarie, quando ossidate con perossido di idrogeno, formano ossidi di ammina. D’altro canto, le ammine primarie e secondarie, per ossidazione, producono le corrispondenti idrossilammine o aldossime tramite reazioni successive con i composti formati.

L’uso di acido nitroso per l’ossidazione serve come mezzo per distinguere tra ammine primarie, secondarie e terziarie. Le ammine primarie subiscono diazotazione, seguita dall’eliminazione dell’azoto gassoso e alla fine formano alcoli attraverso la reazione dello ione intermedio carbenio con acqua.
Le ammine secondarie reagiscono per produrre N-nitrosoammine gialle. In genere, le ammine terziarie non mostrano reattività in queste condizioni.
La formazione di nitrosammine può essere un problema significativo, in particolare con le ammine secondarie, in quanto sono altamente mutagene. Sebbene non si formino in genere durante l’uso normale, tracce possono formarsi a contatto con nitriti o ossidi di azoto, con conseguenti problemi di manipolazione. La contaminazione dell’aria dovuta alle ammine secondarie è quindi considerata problematica.
12. Dealchilazione delle ammine
Dopo aver convertito le ammine terziarie in sali basici di ammonio quaternario, subiscono dealchilazione per riscaldamento. Nei casi in cui sono presenti solo gruppi metilici, vengono eliminati come metanolo o etere dimetilico. Tuttavia, quando sono presenti gruppi alchilici superiori, producono alcheni, come esemplificato nella reazione:

Questa reazione, comunemente nota come degradazione di Hofmann, non è frequentemente impiegata nelle applicazioni sintetiche. Tuttavia, ha svolto un ruolo significativo in passato nel chiarire le caratteristiche strutturali di ammine sconosciute.
Riferimento
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
