Produzione di soluzione di idrossido di sodio
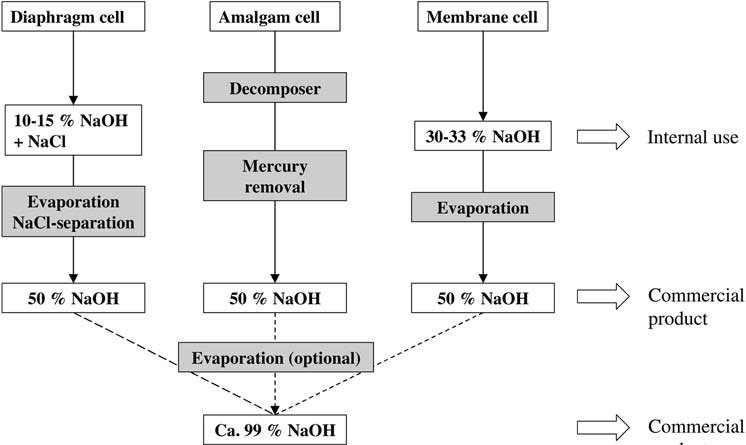
1. Produzione di idrossido di sodio mediante elettrolisi del cloruro di sodio
La produzione industriale di una soluzione di idrossido di sodio comporta principalmente l’elettrolisi del cloruro di sodio.
La reazione produce una soluzione di idrossido di sodio, gas di cloro e gas di idrogeno nel rapporto di massa di 1: 0,88: 0,025, come rappresentato dall’equazione complessiva:
2 NaCl + 2 H2O → 2 NaOH + Cl2 + H2
Il processo a membrana è stato introdotto nei primi anni ’80 come alternativa ai processi ad amalgama e a diaframma per la produzione di cloro-alcali.
Nel 2004, il processo a membrana rappresentava oltre il 44% della capacità totale di cloro-alcali installata. Questo processo consente di risparmiare circa il 30% di energia elettrica ed è considerato la migliore tecnica disponibile, portando a un crescente utilizzo della tecnologia in nuove unità.
In Giappone, il processo di amalgama è stato gradualmente eliminato e alcuni impianti a diaframma sono stati sostituiti da impianti a membrana per motivi di costi e qualità entro il 1988.
Nel processo di amalgama, la soluzione di idrossido di sodio viene prodotta da amalgama di sodio e acqua su un catalizzatore di grafite a 80-120 °C, producendo una soluzione al 50% in peso che viene raffreddata e poi venduta senza ulteriori trattamenti dopo che il mercurio è stato rimosso tramite centrifugazione o filtrazione.
La cella a diaframma produce una soluzione contenente circa il 18% in peso di cloruro di sodio e il 10-15% in peso di idrossido di sodio.
Durante l’evaporazione, le impurità trasportate dalla soluzione di cloruro di sodio impoverita vengono rimosse fino alla loro solubilità limite mediante cristallizzazione frazionata e il contenuto di cloruro di sodio può essere ridotto solo a circa l’1-1,5% in peso.
Il processo a membrana prevede l’uso di una membrana idraulicamente impermeabile per impedire la miscelazione degli elettroliti.
Questo processo produce una soluzione di idrossido di sodio ad alta purezza, praticamente priva di cloruri, paragonabile a quella del processo di amalgama. Tuttavia, il contenuto di cloruri aumenta di un fattore di circa 10 se il funzionamento della cella viene interrotto a causa della diffusione di ioni Cl– attraverso la membrana.
Il solfato e il clorato presenti nell’anolita influenzano anche la concentrazione di impurità nel liquido caustico dalla cella a membrana. Questo perché la membrana selettiva per i cationi ha una permeabilità residua apprezzabile per gli anioni. La maggior parte delle celle a membrana offre prestazioni economiche ottimali a una concentrazione di NaOH del 30-35% in peso.
È stata sviluppata una membrana a scambio ionico che consente la produzione di una soluzione di idrossido di sodio al 50% in peso nella cella, ma a scapito di un notevole aumento della tensione. Tali membrane sono realizzabili solo se i costi del vapore sono elevati e i costi dell’elettricità sono bassi.
La soluzione di idrossido di sodio al 30-33% in peso è solitamente concentrata in un evaporatore a film cadente a due o tre stadi, a seconda dei costi del vapore e delle dimensioni dell’impianto, per ottenere una soluzione commerciale al 50% in peso.
Il consumo di vapore per un evaporatore a tre stadi è di 0,55 t per tonnellata di NaOH (100%) e per un evaporatore a due stadi è di 0,71 t per tonnellata di NaOH (100%), con la soluzione di idrossido di sodio e il vapore in flusso controcorrente.
A differenza del liquore della cella a diaframma, l’evaporazione del liquore della cella a membrana non produce alcun materiale solido che possa sporcare lo scambiatore di calore o erodere le tubazioni.
L’assorbimento di metalli durante l’evaporazione è di circa 1 ppm in peso se vengono utilizzati materiali di costruzione appropriati come nichel e acciaio inossidabile.
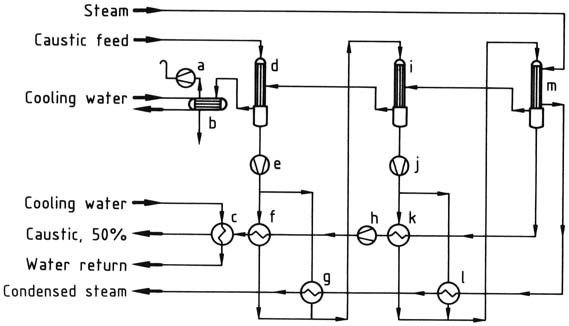
a) Pompa a vuoto; b) Condensatore; c) Refrigeratore caustico; d) Primo evaporatore; e) Pompa caustica; f) Primo scambiatore di calore caustico; g) Secondo scambiatore di calore; h) Pompa caustica; i) Secondo evaporatore; j) Pompa caustica; k) Secondo scambiatore di calore caustico; l) Primo scambiatore di calore; m) Terzo evaporatore
I tre diversi processi elettrolitici utilizzati per produrre idrossido di sodio hanno requisiti energetici variabili.
Il processo a membrana richiede la quantità minima di energia elettrica, che varia da 2200 a 2500 kWh per tonnellata di NaOH. Tuttavia, per generare una soluzione al 50% in peso, sono necessari 200-300 kWh in più per tonnellata di NaOH sotto forma di vapore.
Al contrario, il processo a diaframma utilizza meno energia elettrica rispetto al processo ad amalgama, ma necessita di 700-900 kWh per tonnellata di NaOH per la fase di evaporazione. Di conseguenza, il processo a diaframma ha il consumo energetico totale più elevato.
A causa dell’elevata richiesta di energia elettrica, i ricercatori si sono concentrati sulla riduzione della tensione della cella. Il processo a cella a membrana può ottenere una riduzione della tensione di circa 1 V utilizzando un catodo a diffusione di ossigeno, simile a una cella a combustibile. Tuttavia, in questo caso, non vengono generati sottoprodotti di idrogeno.
Questa tecnologia ha suscitato un notevole interesse. Lo sviluppo del design delle celle, dei catodi di diffusione dell’ossigeno e la loro integrazione nel design delle celle sono le aree di interesse principali. Gli sforzi di ricerca sono inoltre diretti all’esplorazione dei parametri operativi e delle periferiche delle celle.
L’elettrolisi di NaCl fuso a 350 °C con un diaframma di β-Al2O3 è una tecnica promettente. Le celle su scala di laboratorio hanno raggiunto un consumo energetico di 2350 kWh per tonnellata di NaOH. Tuttavia, questa tecnica deve ancora essere utilizzata su scala commerciale.
2. Altri processi
La produzione di idrossido di sodio utilizzando la caustizzazione della soluzione di carbonato di sodio è il metodo più antico conosciuto. Era l’unico metodo disponibile fino all’avvento dell’elettrolisi. Questo metodo ha riacquistato interesse tra le aziende che hanno accesso al carbonato di sodio sintetico o naturale.
In questo processo, una soluzione calda di circa il 12% di carbonato di sodio viene combinata con calce viva. Il carbonato di calcio precipitato viene eliminato e la soluzione di idrossido di sodio al 12% circa viene evaporata in più fasi.
Na2CO3 + CaO·H2O → 2 NaOH + CaCO3
Le impurità che precipitano, tra cui NaCl e Na2SO4, vengono filtrate.
La combinazione di celle elettrolitiche e di dialisi è un modo per dividere i sali di sodio nei corrispondenti acidi e alcali:
Na2SO4 + 2 H2O → 2 NaOH + H2SO4
In una cella a due camere, può essere utilizzata una membrana a scambio cationico o anionico. In una cella a tre camere, può essere utilizzata una membrana a scambio cationico e una a scambio anionico. In alternativa, può essere utilizzata una cella multicamera, che utilizza una combinazione di membrane cationiche, anioniche e bipolari.
Tuttavia, tutte le celle utilizzate industrialmente producono una soluzione di idrossido di sodio diluita (15-30% in peso) contenente un po’ di sale di partenza.
Pertanto, questo tipo di processo è più adatto per il trattamento di acque reflue contenenti sale di sodio da processi in cui la soluzione diluita di idrossido di sodio ottenuta può essere riciclata per scopi di neutralizzazione.
Il processo di recupero della ferrite fornisce un modo alternativo di produrre una soluzione di idrossido di sodio adatta a piccoli impianti di pasta per carta.
Questo processo comporta l’evaporazione di liquami di scarto contenenti sali di sodio e sostanze organiche. Il residuo risultante viene miscelato con Fe2O3 e calcinato, formando ferrite di sodio che, quando decomposta dall’acqua, produce NaOH e Fe2O3.
Riferimenti
- Idrossido di sodio; Enciclopedia di chimica industriale di Ullmann. Weinheim: Wiley-VCH.- https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_345.pub2
