Pirogallolo: produzione, reazioni e usi

Cos’è il pirogallolo?
Il pirogallolo, noto anche come 1,2,3-triidrossibenzene, è un solido cristallino bianco con formula C6H6O3. Il pirogallolo esiste sotto forma di aghi o foglioline incolori, che cambiano gradualmente colore in grigio scuro se esposti all’aria o alla luce.
È un polifenolo scoperto inizialmente da SCHEELE nel 1786 eseguendo la distillazione a secco di acido gallico (acido 3,4,5-triidrossibenzoico).
I derivati del pirogallolo si trovano naturalmente in diversi composti, tra cui tannino, antocianina e alcaloidi.
Sommario
1. Produzione di pirogallolo
Il pirogallolo è prodotto commercialmente tramite decarbossilazione dell’acido gallico, che viene preparato tramite idrolisi del tannino.
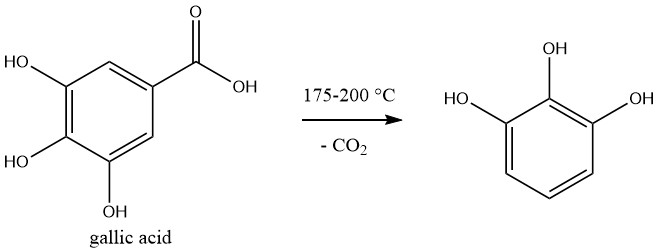
La reazione viene eseguita in batch. Una soluzione acquosa al 50% di acido gallico viene riscaldata a 175-200 °C in un’autoclave e la pressione aumenta a 1,2 MPa durante la reazione.
Al termine dello sviluppo di anidride carbonica, la soluzione viene raffreddata. La reazione procede in modo quantitativo.
Dopo la decolorazione della miscela di reazione con carbone, si ottiene un prodotto grezzo, che viene purificato tramite sublimazione o distillazione sotto vuoto.
Il costo per ottenere il pirogallolo è relativamente elevato, poiché il materiale di partenza, l’acido gallico, deriva da un prodotto naturale la cui disponibilità è limitata. Di conseguenza, sono stati ricercati metodi alternativi per produrre acido gallico.
La condensazione catalizzata da basi del trimetil propano-1,2,3-tricarbossilato con il dimetil chetale dell’acido mesossalico, seguita da idrolisi e decarbossilazione, fornisce acido gallico con una resa del 74%. La reazione dell’estere chetale e glutarico produce pirogallolo senza la generazione di acido gallico.
Sono stati sviluppati anche altri metodi per produrre pirogallolo, come l’ossidazione del resorcinolo con perossido di idrogeno, l’idrolisi del 2,6-diammino-4-butilfenolo, la demetilazione dei 2,6-dimetossifenoli 4-sostituiti, l’ossidazione del 2,6-dimetilfenolo, l’idrolisi del 2,2,6,6-tetraclorocicloesanone, la deossimazione dell’1,2,3-cicloesanetrion-1,3-diossima e la deidrogenazione dell’1,2,3-triidrossicicloesano.
2. Reazioni chimiche del pirogallolo
Il pirogallolo, un poliidrossibenzene, è considerato l’agente riducente più potente. La sua soluzione acquosa assorbe rapidamente l’ossigeno gassoso e precipita una sostanza marrone scuro.
Il pirogallolo è stato ampiamente utilizzato per la determinazione quantitativa dell’ossigeno grazie a questa proprietà.
Il comportamento chimico del pirogallolo è paragonabile a quello dei fenoli. I prodotti mono-, di- e trisostituiti possono essere sintetizzati tramite metodi tradizionali come l’esterificazione e l’eterificazione dei gruppi idrossilici.
Dopo riscaldamento con bicarbonato di potassio acquoso, il pirogallolo produce prevalentemente acido pirogallol-4-carbossilico (acido 2,3,4-triidrossibenzoico), con acido gallico come sottoprodotto.
Il pirogallolo può subire formilazione, acilazione e reazione di Mannich per formare cicloesenoni 4-sostituiti come prodotto primario.
La bromurazione con bromo alla fine produce 1,2,6,6-tetrabromocicloesene-3,4,5-trione. La reazione con il fosgene produce carbonato di pirogallolo e con il tionilbromuro produce 4,5,6-tribromopirogallolo.
L’analisi quantitativa degli ioni di metalli pesanti viene eseguita tramite le reazioni di colore altamente sensibili della soluzione acquosa di pirogallolo con essi. Gli ioni di metalli preziosi (ad esempio, Ag+, Au2+, Hg2+) vengono ridotti a metalli elementari.
Un catalizzatore per la polimerizzazione alternata di anidride carbonica e ossido di propilene viene creato da un complesso formato da dietilzinco e pirogallolo.
3. Usi del pirogallolo
Il pirogallolo è un composto versatile che trova utilità in fotografia, litografia e tinture per capelli ed è impiegato come antiossidante e stabilizzante in varie applicazioni.
L’uso del pirogallolo nel campo dei cosmetici e dei medicinali è diminuito negli ultimi tempi, attribuito alla sua significativa tossicità.
Riferimento
- Phenol Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_313
