Nitrobenzene: proprietà, reazioni, produzione e usi
Il nitrobenzene è un composto chimico organico con formula molecolare C6H5NO2. È un liquido giallo pallido con un odore caratteristico simile alle mandorle amare.
Sommario
1. Proprietà fisiche del nitrobenzene
Il nitrobenzene è noto come olio di mirbane. Ha la formula chimica C6H5NO2 e una massa molare di 123,1 g/mol. Questo liquido giallo pallido emana un aroma che ricorda le mandorle amare e mostra un’elevata solubilità in vari solventi organici.
Mostra una completa miscibilità con il benzene in tutte le proporzioni. In particolare, il nitrobenzene funge da solvente efficace per il cloruro di alluminio, rendendolo un componente prezioso nell’acilazione di Friedel-Crafts e nell’alchilazione.
Il composto mostra una leggera solubilità in acqua, pari a circa lo 0,19% a 20 °C e lo 0,8% a 80 °C. Inoltre, è facilmente volatile con il vapore.
Di seguito sono riportate altre proprietà fisiche del nitrobenzene:
| Proprietà | Valore |
|---|---|
| Punto di fusione | 5,85 °C |
| Punto di ebollizione a 101 kPa | 210,9 °C |
| Punto di ebollizione a 13 kPa | 139,9 °C |
| Punto di ebollizione a 4 kPa | 108,2 °C |
| Punto di ebollizione a 0,13 kPa | 53,1 °C |
| densità (solido) | 1,344 |
| densità (liquido) 25°C | 1,199 |
| Viscosità (15 °C) | 2,17 × 102 mPa · s |
| Tensione superficiale (20 °C) | 43,35 mN/m |
| Costante dielettrica a 20 °C | 35,97 |
| Costante dielettrica a 170 °C | 18,15 |
| Calore specifico (30 °C) | 1,418 J/g |
| Calore latente di fusione | 94,1 J/g |
| Calore latente di vaporizzazione | 331 J/g |
| Punto di infiammabilità (vaso chiuso) | 88 °C |
| Temperatura di autoaccensione | 482 °C |
| Limite di esplosività in aria (93 °C) | 1,8 vol% |
| Densità di vapore | 4,1 |
| Indice di rifrazione (15 °C) | 1,55457 |
2. Reazioni chimiche del nitrobenzene
Il nitrobenzene subisce varie reazioni chimiche dovute alla presenza del gruppo nitro (-NO2) legato all’anello benzenico. Il gruppo nitro è un gruppo che attrae gli elettroni, il che influenza la reattività dell’anello benzenico.
Ritira la densità elettronica dall’anello, disattivandolo verso reazioni di sostituzione aromatica elettrofila (EAS). Ciò significa che l’anello è meno reattivo verso la sostituzione di un elettrofilo al posto di un altro elettrofilo, come l’idrogeno.
Le reazioni chimiche che coinvolgono il nitrobenzene comprendono la meta sostituzione elettrofila dell’anello aromatico attraverso processi come nitrazione, solfonazione o alogenazione.
Il nitrobenzene può agire come un agente ossidante blando nella sintesi di composti come chinolina e fucsina.
Al contrario, la riduzione del gruppo nitro porta a una vasta gamma di prodotti, come presentato nella seguente tabella:
| Agente riducente | Prodotto |
|---|---|
| Fe, Zn o Sn/HCl, catalizzatore H2 | anilina |
| Zn – H2O | N-fenilidrossilammina (si riorganizza con l'acido in 4-amminofenolo) |
| Na3AsO3 | azossibenzene |
| Zn – NaOH | azobenzene, idrazobenzene (si riorganizza con l'acido in benzidina ) |
| LiAlH4 | azobenzene |
| Na2S2O3– Na3PO4 | fenilsolfamato di sodio (C6H5NHSO3Na) |
| Riduzione elettrolitica | 4-amminofenolo |
I prodotti primari della riduzione sono nitrosobenzene, N-fenilidrossilammina e anilina, mentre altri prodotti derivano da interazioni e riarrangiamenti successivi.
È essenziale impiegare condizioni di riduzione altamente specifiche per ottenere prodotti puri e gli stadi intermedi, come il nitrosobenzene, sono in genere difficili da isolare.
3. Produzione di nitrobenzene
La tradizionale procedura di nitrazione in batch prevede l’aggiunta di acido misto (acido nitrico/acido solforico/acqua) (composto da 27 – 32/56 – 60/8 – 17% in peso) a un leggero eccesso di benzene (per impedire la presenza di acido nitrico nell’acido esaurito). La reazione viene controllata a una temperatura di 50 – 55 °C e quindi completata riscaldando a 80 – 90 °C.
Tuttavia, i processi continui hanno sostituito questo approccio, operando in condizioni simili. Questi processi continui offrono maggiore economia e sicurezza grazie alla migliore miscelazione e alle velocità di reazione più elevate ottenibili in reattori più piccoli.
Sorprendentemente, un reattore continuo da 120 L può produrre la stessa quantità di nitrobenzene di un reattore batch da 6000 L. Le configurazioni del reattore variano, ma un esempio tipico è un reattore cilindrico agitato che funziona a 50 – 100 °C.
Il riutilizzo dell’acido esausto è importante, ottenuto tramite concentrazione continua e aggiunta di acido fresco. Ciò contrasta con il concetto di riutilizzo batchwise, ma entrambi gli approcci comportano lo stesso svantaggio di generare una quantità equivalente di acido esausto per lo smaltimento.
Molti degli impianti di produzione odierni sono unità di imballaggio basate su anni di esperienza di progettazione. Ad esempio, le unità Meissner, con capacità fino a 12 t di nitroaromatici all’ora, sono dotate di azoto per una maggiore sicurezza.
Le fasi di spurgo vengono applicate a ciascun flusso di uscita; quindi, l’acido esausto viene estratto insieme al benzene in entrata per rimuovere il nitrobenzene residuo e l’acido nitrico. Inoltre, i gas di scarico residui vengono depurati da un circuito di acido misto per soddisfare le normative ambientali.
Un altro sviluppo innovativo è il circuito di nitrazione della pompa introdotto da Nobel Chematur. Questo processo consente alla nitrazione di avvenire nella pompa stessa, portando a tempi di reazione inferiori a un secondo grazie all’intensa miscelazione e ai numerosi vantaggi associati.
Il concetto di un processo adiabatico che utilizza il calore di reazione per la concentrazione dell’acido esausto esiste dal 1941. Il processo adiabatico American Cyanamid, sviluppato congiuntamente con CLR, costituisce la base per uno dei più grandi impianti di nitrobenzene al mondo, con una capacità stimata di 159.000 t/a.
Questo processo prevede flussi equicorrenti di benzene (1,1 moli per mole di HNO3) e acido misto (6 – 8/62 – 68/24 – 32 wt %) che passano attraverso un reattore tubolare vigorosamente agitato, con ingresso a 60 – 80 °C (al di sotto del punto di ebollizione del benzene) e uscita a circa 120 °C, garantendo un tempo di residenza di circa 4 minuti.
La necessità di un acido solforico molto più debole rende il riciclaggio dell’acido molto più conveniente, soprattutto perché il calore di processo è quasi sufficiente per l’evaporazione, in particolare sotto vuoto.
Un’altra opzione per evitare la necessità di una riconcentrazione separata dell’acido solforico è quella di effettuare la nitrazione a temperature più elevate (120 – 160 °C) con acqua in eccesso distillata dal nitratore come azeotropo con benzene.
In un processo duplex, l’azeotropo benzenico risultante dalla reazione parziale del primo stadio ad alta temperatura viene utilizzato in un secondo stadio a temperatura più bassa per completare la reazione. Mentre la nitrazione azeotropica offre un notevole risparmio energetico, non è considerata competitiva quanto la nitrazione adiabatica.
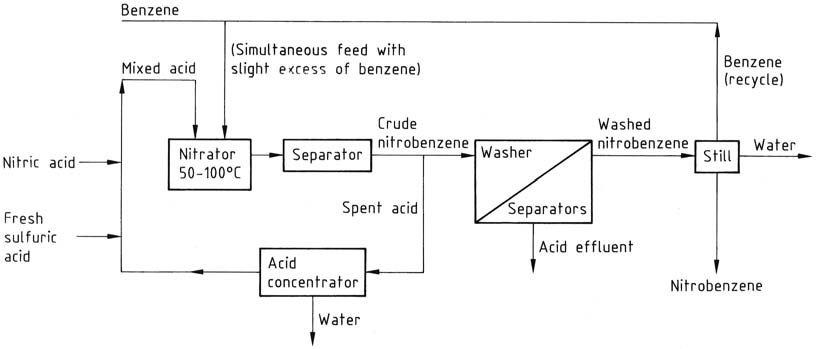
Tutti questi processi condividono flussi di lavorazione simili. La miscela di reazione si sposta dal nitratore a un separatore o centrifuga e l’acido esausto acquoso viene reimmesso nel circuito di riciclo tramite un concentratore o una fase di regolazione della forza, a seconda dei casi.
Il nitrobenzene grezzo, come strato superiore, passa attraverso una serie di separatori-lavatrici in cui l’acido residuo viene prima lavato via con alcali diluiti e poi con acqua. Il prodotto lavato viene sottoposto a un alambicco per rimuovere acqua e benzene (riciclati).
Se necessario, il prodotto viene infine distillato sotto vuoto per ottenere un prodotto puro con una resa complessiva di circa il 96%. Le fasi di lavaggio creano un problema di effluenti, rendendo necessario il trattamento delle acque reflue, principalmente per rimuovere il nitrobenzene.
Nel 1985, la capacità globale di produzione di nitrobenzene era di circa 1,7 milioni di t/a, con circa un terzo localizzato nell’Europa occidentale e un altro terzo negli Stati Uniti.
4. Utilizzi del nitrobenzene
L’utilizzo del nitrobenzene come solvente in specifiche reazioni chimiche ha un ruolo minore, ma significativo. La maggior parte (circa il 95% o più) del nitrobenzene prodotto viene convertito in anilina, che funge da precursore per numerosi prodotti a valle.
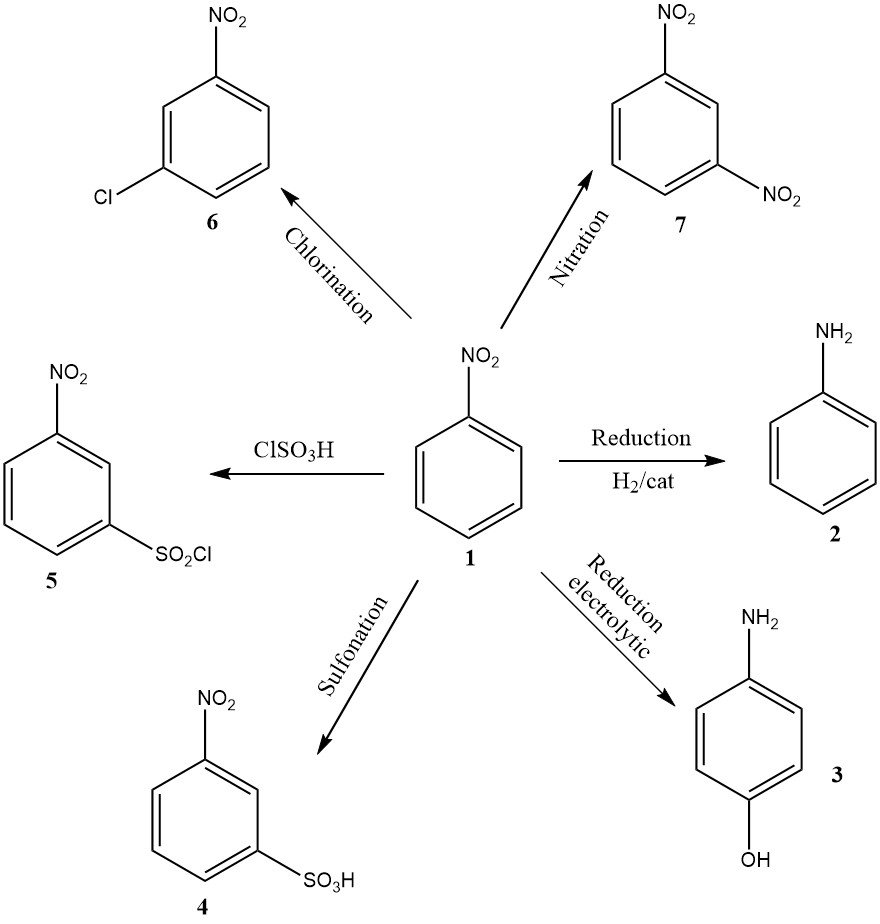
Sebbene di volume inferiore, altre applicazioni rilevanti a livello industriale includono la riduzione elettrolitica per produrre 4-amminofenolo, la nitrazione che produce 1,3-dinitrobenzene (7), la clorurazione che produce 3-cloronitrobenzene (6), la solfonazione che produce acido 3-nitrobenzenesolfonico (4) e la clorosolfonazione che produce cloruro di 3-nitrobenzenesolfonile (5).
Gli ultimi tre prodotti sono usati principalmente come precursori per i loro prodotti di riduzione: rispettivamente 3-cloroanilina, acido metanilico e 3-amminobenzenesolfonamide.
L’anilina trova applicazioni nella produzione di polimeri uretanici, prodotti chimici della gomma, pesticidi, coloranti (in particolare coloranti azoici), esplosivi e prodotti farmaceutici. È un composto versatile con un’ampia gamma di usi in diversi settori.
Oltre al suo ruolo di precursore dell’anilina, il nitrobenzene è anche utilizzato come solvente in alcuni processi di laboratorio e industriali. Può essere utilizzato per sciogliere varie sostanze, in particolare quelle non solubili in acqua.
La solubilità del nitrobenzene nei solventi organici lo rende uno strumento utile in alcune procedure sperimentali.
Inoltre, la nigrosina (C.I. Solvent Black 5) si ottiene come miscela grezza risultante dalla reazione del nitrobenzene con anilina e cloridrato di anilina a una temperatura di 200 °C in presenza di ferro o rame.
5. Tossicità del nitrobenzene
Il nitrobenzene, con un valore limite di soglia (TLV) di 5 mg/m³, è altamente tossico e può causare avvelenamento acuto a causa del suo facile assorbimento attraverso la pelle o le vie respiratorie.
Gli effetti principali dell’esposizione includono una riduzione dei livelli di emoglobina, metaemoglobinemia, cianosi e mancanza di respiro. L’esposizione prolungata può causare danni alla milza e al fegato, ittero e anemia.
È importante notare che il consumo di alcol può accelerare e intensificare questi effetti. Pertanto, devono essere stabilite e mantenute condizioni di lavoro rigorose e ben definite per garantire un controllo e una sicurezza adeguati.
Riferimento
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
