Metodi di produzione di aldeidi alifatiche
Le aldeidi sono indicate dalla formula chimica generale RCHO, dove R può rappresentare idrogeno o una vasta gamma di gruppi alifatici, aromatici o eterociclici. In conformità con la nomenclatura IUPAC, le aldeidi sono riconosciute dal suffisso “al”; tuttavia, molte aldeidi sono ancora chiamate con i loro nomi comuni.
Il metodo principale per produrre aldeidi è l’oxosintesi, ottenuta mediante blanda ossidazione (deidrogenazione) di alcoli primari e processi specializzati di ossidazione delle olefine. Negli oli essenziali di varie piante, tracce di aldeidi si trovano naturalmente. L’acetaldeide, un sottoprodotto della fermentazione dell’alcol, si forma mediante la decarbossilazione dell’acido piruvico intermedio.
Le aldeidi hanno importanti ruoli biologici, come il coinvolgimento dell’11-cis-retinale nel processo visivo e la partecipazione del piridossale alla transaminazione degli amminoacidi.
L’isolamento delle aldeidi da fonti naturali ha un significato commerciale solo in pochi casi, come la produzione di aldeidi profumate a catena più lunga.
Sommario
1. Produzione di aldeidi sature
Sebbene siano stati scoperti numerosi metodi per sintetizzare aldeidi, solo pochi selezionati vengono utilizzati su scala industriale. Ciò è spesso dovuto alla disponibilità di materie prime idonee. I seguenti processi sono i più significativi per la preparazione di aldeidi alifatiche sature:
- Idroformilazione di olefine, comunemente nota come sintesi oxo.
- Deidrogenazione o ossidazione di alcoli primari, impiegati principalmente per la produzione di formaldeide dal metanolo.
- Idratazione di acetilene, che porta alla formazione di acetaldeide (nota anche come etanale).
- Ossidazione di etilene per produrre acetaldeide.
- Ossidazione di idrocarburi saturi, in particolare idrocarburi C3 e C4, per produrre aldeidi inferiori.
Sono importanti anche le sintesi specifiche per la produzione di aldeidi utilizzate nell’industria dei profumi.
1.1. Sintesi oxo
La sintesi oxo si distingue come il metodo più significativo per produrre aldeidi che consistono di almeno tre atomi di carbonio (chiamata sintesi oxo). In questo particolare processo, le olefine subiscono una reazione con il gas di sintesi, che è una miscela di monossido di carbonio (CO) e idrogeno (H2). Come risultato di questa reazione, si formano aldeidi con un atomo di carbonio in più rispetto all’olefina di partenza.

La formazione di prodotti puri avviene solo quando si ha a che fare con molecole di olefina simmetriche o stericamente impedite. Tuttavia, in altri casi, si ottiene una miscela di composti a catena lineare e ramificati. Selezionando attentamente catalizzatori adatti e controllando le condizioni di reazione, il rapporto tra prodotti aldeidici normali (n) e iso (ramificati) può essere regolato su un’ampia gamma.
1.2. Deidrogenazione/ossidazione di alcoli primari
Le reazioni di deidrogenazione, ossidazione e deidrogenazione ossidativa sono rappresentate dalle seguenti equazioni:
- RCH2OH → RCHO + H2; ΔH = +84 kJ/mol for R = CH3 (equazione 1)
- RCH2OH + 1/2 O2 → RCHO + H2O; ΔH = -159 kJ/mol for R = H (equazione 2)
- RCH2OH → RCHO + H2; H2 + 1/2 O2 → H2O; ΔH = -159 kJ/mol for R = H (equazione 3)
Deidrogenazione: la reazione di deidrogenazione endotermica degli alcoli avviene a pressione atmosferica e temperature comprese tra 250 e 400 °C, utilizzando in genere catalizzatori Cu o Ag. Questi catalizzatori sono spesso attivati con elementi come Zr, Co o Cr.
Il processo offre il vantaggio del recupero simultaneo di idrogeno, che può essere utilizzato senza ulteriore purificazione. È una reazione di equilibrio, che richiede alte temperature e brevi tempi di residenza per l’efficienza economica.
Il processo trova uso commerciale nella preparazione di acetaldeide da etanolo. La deidrogenazione in fase gassosa con un catalizzatore di rame attivato dal cerio viene condotta a pressione atmosferica e 270-300 °C, convertendo il 25-50% di etanolo per portata, con una selettività del 90-95% per l’acetaldeide, insieme alla formazione di sottoprodotti quali acetato di etile, etilene, crotonaldeide e alcoli superiori.
Ossidazione: il processo di ossidazione descritto dall’equazione (2) viene eseguito utilizzando un eccesso di aria o ossigeno e un catalizzatore contenente il 18-19% in peso di Fe2O3 e l’81-82% in peso di MoO3 a temperature comprese tra 350 e 450 °C. Questo metodo è impiegato nella produzione di formaldeide.
Deidrogenazione ossidativa: l’equazione (3) combina la deidrogenazione endotermica dell’alcol con la combustione esotermica dell’idrogeno formato, dando luogo a una reazione esotermica complessiva.
Nel processo industriale, entrambe le reazioni avvengono simultaneamente quando vengono utilizzate quantità substechiometriche di ossigeno o aria. È fondamentale considerare gli intervalli di esplosione delle miscele alcol-aria durante l’ossidazione e la deidrogenazione ossidativa.
La deidrogenazione ossidativa è il processo più importante per produrre aldeidi dagli alcoli. Sono preferiti i catalizzatori d’argento, ma vengono utilizzati anche catalizzatori di rame. Nella produzione di formaldeide da metanolo, cristalli d’argento (granulometria 0,2-3 mm), reti d’argento o argento su Al2O3 raggiungono una conversione del 75-99% a temperature di 500-720 °C e tempi di residenza inferiori a 0,01 s.
Nel 2006, circa il 7% della produzione di acetaldeide dell’Europa occidentale proveniva da etanolo. Argento e rame erano i catalizzatori principali utilizzati, con conversioni di etanolo del 30-50% per portata e selettività dell’acetaldeide dell’85-95%. La temperatura di reazione variava tra 300 e 600 °C a seconda della quantità di aria. I sottoprodotti includevano acetato di etile, acido formico, acido acetico e anidride carbonica.
Aldeidi profumate: anche i processi di deidrogenazione e ossidazione sono preferiti per la sintesi di aldeidi profumate. Un processo specializzato consente la deidrogenazione catalitica di alcoli C5-C14 in presenza di idrogeno e aria, utilizzando catalizzatori di rame o argento, eventualmente combinati con Zn, Cr o Cr2O3.
Altri sistemi di catalizzatori descritti in letteratura includono Cu/MgO, Ag/Na2O su supporti, miscele di MnO, NiO su MgO o CuCl con un legante contenente azoto come 2,20-bipiridile.
1.3. Ossidazione di idrocarburi
Celanese ha sviluppato un processo per l’ossidazione di alcani C3 e C4, ma questo metodo produce una miscela di reazione complessa che richiede costosi passaggi di estrazione e distillazione.
In questo processo, il propano e le miscele di propano-butano vengono fatte reagire nella fase gassosa a temperature comprese tra 425 e 460 °C e pressioni comprese tra 0,7 e 0,8 MPa. Il tasso di conversione è di circa il 20%, con una carenza di ossigeno presente durante la reazione. La reazione procede attraverso un meccanismo radicalico.
La miscela di reazione ottenuta da questo processo è composta principalmente da acetaldeide (≈ 20%), formaldeide (≈ 15%), metanolo (≈ 19%) e acidi organici (≈ 11%).
Tuttavia, nonostante questi componenti, il processo è considerato tecnologicamente obsoleto. Inoltre, l’ossidazione di metano o etano utilizzando questo metodo non ha alcuna rilevanza pratica.
1.4. Ossidazione di olefine
Il metodo industriale primario e cruciale per produrre acetaldeide è l’ossidazione parziale dell’etilene nella fase acquosa, eseguita in presenza di palladio e cloruri di rame. Questo processo è noto come processo Wacker-Hoechst.
Un altro processo di ossidazione utilizzato per preparare aldeidi da olefine è la sintesi dell’acroleina, che comporta la conversione del propene.
1.5. Processi vari
Il processo che comporta l’aggiunta di acqua all’acetilene per produrre acetaldeide ha perso la sua importanza rispetto ai processi alternativi basati su etilene o etanolo. Nell’Europa occidentale, gli ultimi impianti che utilizzavano questo processo sono stati chiusi nel 1980.
La ridotta importanza del processo basato sull’acetilene è attribuita alla pronta disponibilità e al costo inferiore dell’etilene, nonché alla selettività superiore della sua conversione. Inoltre, l’uso del solfato di mercurio dannoso per l’ambiente come catalizzatore ha contribuito a rendere il processo praticamente obsoleto.
2. Produzione di aldeidi insature
Le aldeidi inferiori α,β-insature, tra cui acroleina, crotonaldeide o 2-etil-2-esenale, sono ottenute principalmente tramite processi sintetici. Tuttavia, alcuni oli essenziali possono fungere da materie prime per omologhi superiori, come citrale o citronellale.
Esistono due principali processi industriali per la produzione di aldeidi α,β-insature:
1. Ossidazione di olefine: questo processo viene utilizzato per preparare l’acroleina.
2. Disidratazione di aldoli ottenuti mediante condensazione aldolica di aldeidi sature: questo metodo viene impiegato per produrre crotonaldeide e 2-etil-2-esenale.
Oltre a questi processi, ci sono sintesi specifiche utilizzate per preparare aldeidi per l’industria dei profumi, come:
1. Deidrogenazione di alcoli insaturi: questo processo è utilizzato nella preparazione del citrale dal geraniolo.
2. Riduzione di acidi insaturi: questo metodo è utilizzato per produrre undecilenaldeide dall’acido undecilenico.
2.1. Ossidazione di olefine
L’ossidazione diretta di olefine, in particolare l’ossidazione del propene, è di grande importanza industriale per la produzione di acroleina. Questa reazione di ossidazione avviene a temperature comprese tra 300 e 480 °C e impiega catalizzatori di ossido di Bi-Mo variamente modificati. La materia prima utilizzata è una miscela gassosa contenente propene, aria e vapore acqueo in un rapporto molare di circa 1:10:2.
Durante questo processo, si possono raggiungere tassi di conversione fino al 98%, con rese di acroleina che vanno dal 78% al 92%. Tuttavia, insieme all’acroleina, si formano alcuni sottoprodotti, tra cui acetaldeide, acido acetico e acido acrilico.
L’acroleina disponibile in commercio ha in genere un livello di purezza dal 95% al 97%. Per prevenire reazioni indesiderate e mantenere la stabilità durante le fasi di lavorazione, in genere viene aggiunto uno stabilizzante. L’idrochinone è comunemente utilizzato come stabilizzante in questi processi.
2.2. Disidratazione degli aldoli
Le β-idrossialdeidi (aldoli) sono composti intermedi formati nella reazione aldolica e sono altamente instabili. Si decompongono facilmente, perdendo acqua, per formare aldeidi α,β-insature.
A seconda delle condizioni di reazione, la reazione aldolica può portare direttamente alla formazione di composti insaturi. Questo processo è comunemente utilizzato per sintetizzare la crotonaldeide dall’acetaldeide, il 2-metil-2-pentenale dalla propionaldeide e il 2-etil-2-esenale dal butanale.
La condensazione aldolica dell’acetaldeide con quantità catalitiche di idrossido di sodio diluito viene in genere condotta a 20-25 °C. La reazione viene spenta con acido acetico per interrompere ulteriori reazioni. Nella successiva fase di distillazione, l’acqua viene rimossa dall’acetaldolo, con conseguente crotonaldeide come prodotto principale. La selettività verso la crotonaldeide può raggiungere valori fino al 95%.

La reazione aldolica può coinvolgere due molecole di aldeide identiche o due specie di aldeide diverse. In quest’ultimo caso, spesso si ottiene una miscela di prodotti. Tuttavia, selezionando attentamente i reagenti e le condizioni di reazione, è possibile ottenere il composto desiderato come prodotto principale.
Ad esempio, l’acroleina è stata precedentemente preparata dalla reazione di formaldeide con acetaldeide.

Allo stesso modo, 2-metilenalcani superiori (2-alchilacroleine) possono essere ottenuti facendo reagire la formaldeide con aldeidi a catena più lunga.
2.3. Processi vari
Per la preparazione di alcune aldeidi aromatiche insature, gli alcoli corrispondenti subiscono una deidrogenazione selettiva utilizzando catalizzatori di rame, rame-zinco o metalli nobili. Questi processi sono preferibilmente condotti a pressione ridotta e sono comunemente utilizzati nella produzione di citrale, citronellale e idrossicitronellale.
Un altro metodo industriale di interesse per la sintesi di aldeidi insature è il riarrangiamento di Claissen degli allil vinil eteri. Gli allil vinil eteri sono formati come intermedi in questo processo secondo il seguente schema di reazione:

I 2-alchenali possono anche essere ottenuti facendo reagire gli alogenuri alchilici insaturi con i sali di sodio dei nitroidrocarburi secondari. Ad esempio, il citrale può essere ottenuto con una resa dell’80% da 1-alogeno-3,7-dimetilocta-2,6-diene.
Un ulteriore approccio prevede il trattamento degli acetali con eteri vinilici in presenza di trifluoruro di boro. Ciò determina la formazione dei corrispondenti β-alcossiacetali. Il successivo trattamento con acidi porta alla conversione dei β-alcossiacetali in aldeidi α,β-insature.
3. Produzione di idrossialdeidi
3.1. Condensazione aldolica
La condensazione aldolica, riportata per la prima volta nel 1872 da A. Wurtz, può essere descritta nel caso di reazioni catalizzate da basi tramite il seguente meccanismo:
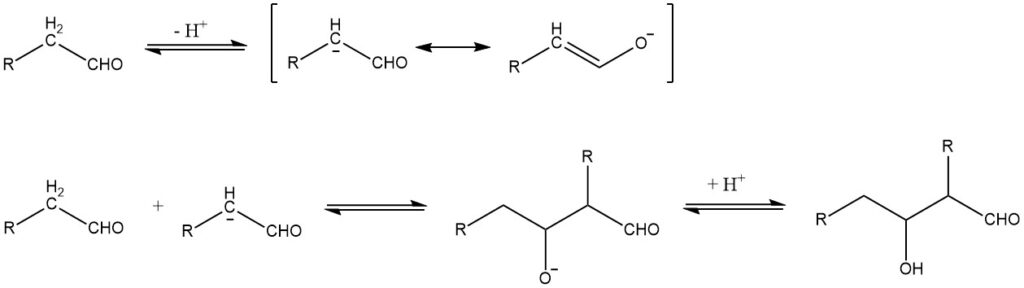
La condensazione aldolica è una reazione reversibile e può essere catalizzata non solo da basi ma anche da acidi. È possibile solo per aldeidi con almeno un atomo di idrogeno α. Gli aldoli ottenuti da aldeidi con più di un atomo di idrogeno α sono solitamente instabili e perdono acqua per formare aldeidi α,β-insature:
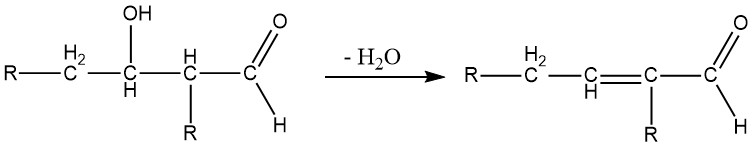
Quando due diverse aldeidi con atomi di α-idrogeno subiscono l’addizione aldolica, tutte e quattro le possibili specie aldoliche vengono generalmente formate in quantità variabili.
Per scopi industriali, le reazioni in cui solo un reagente possiede atomi di α-idrogeno sono più significative. In tali casi, il secondo reagente è spesso formaldeide. Le reazioni per preparare mono- o polimetilolalcani da formaldeide e alcani sono comuni nei processi industriali.
Queste reazioni esotermiche vengono in genere condotte in fase liquida e vengono spesso impiegati catalizzatori come soluzioni acquose di idrossido di sodio o carbonati alcalini.
Sono stati descritti anche vari altri sistemi di catalizzatori, tra cui zeoliti contenenti zinco o magnesio, idrossidi alcalini combinati con catalizzatori a trasferimento di fase, ammine terziarie e resine basiche a scambio ionico.
Tipici sottoprodotti della condensazione aldolica, oltre agli aldoli dimerici, agli aldoxani e alle aldeidi α,β-insature menzionate in precedenza, includono acetali ciclici, esteri di Tishchenko, ecc. Le reazioni con formaldeide possono portare a ulteriori complicazioni, poiché potrebbe verificarsi una riduzione dell’aldolo mediante una reazione di Cannizzaro incrociata.
G. Wittig ha scoperto una versione modificata della classica reazione aldolica che prevede il trattamento di composti carbonilici con immine metallate. In questo caso, si formano prevalentemente aldeidi α,β-insature e questo metodo ha dimostrato il suo valore, in particolare nel campo dei prodotti naturali.
3.2. Altri processi
L’aggiunta di acqua alle aldeidi α,β-insature determina la formazione di β-idrossialdeidi. Questa reazione è di importanza industriale e viene utilizzata per la sintesi di 1,3-propandiolo.
Ad esempio, il 3-idrossipropanale può essere ottenuto anche tramite idroformilazione dell’ossido di etilene, mentre il 4-idrossibutanale si ottiene tramite idroformilazione dell’alcol allilico. L’idroformilazione di alcoli insaturi per produrre idrossialdeidi è stata ampiamente esaminata.
Inoltre, quando il 2,3-diidro-1,4-pirano viene idrolizzato, produce 5-idrossipentanale, che esiste in equilibrio con la sua forma emiacetalica ciclica. Ad esempio, il 2-fenil-2,3-diidropirano, prodotto da acroleina e stirene tramite una sintesi di Diels-Alder, può essere scisso utilizzando acido solforico diluito per produrre 5-fenil-5-idrossipentanale.
4. Produzione di dialdeidi
Numerose sintesi di dialdeidi sono documentate nella letteratura brevettuale, ma solo un numero limitato di esse ha rilevanza commerciale, in gran parte a causa della loro mancanza di selettività. I processi chiave utilizzati per la produzione di dialdeidi alifatiche e cicloalifatiche sature sono i seguenti:
- Ossidazione dell’etilenglicole
- Ossidazione dell’acetaldeide
- Idroformilazione dei dieni
- Apertura dell’anello ossidativo dei cicloalcheni
- Aggiunta di metilviniletere all’acroleina (con conseguente glutaraldeide)
4.1. Idroformilazione dei dieni
L’idroformilazione dei dieni porta a prodotti diversi, influenzati sia dalla struttura del diene che dal catalizzatore impiegato. Quando si ha a che fare con dieni coniugati come 1,3-butadiene utilizzando catalizzatori di cobalto o rodio non modificati, vengono prodotti monoaldeidi o monoalcoli saturi.
Inizialmente, la singola aggiunta di CO/H2 genera la monoaldeide insatura. Successivamente, l’idroformilazione dell’aldeide insatura compete con l’idrogenazione e l’isomerizzazione del doppio legame.
D’altro canto, i dieni non coniugati in genere si isomerizzano nelle aldeidi α,β-insature termodinamicamente più stabili dopo la singola aggiunta di CO/H2. Di conseguenza, i dieni non coniugati con doppi legami ampiamente separati (> C6), preferibilmente terminali, sono particolarmente utili per la sintesi di dialdeidi tramite idroformilazione.
4.2. Apertura dell’anello ossidativo dei cicloalcheni
I cicloalcheni, quando esposti a catalizzatori come l’acido tungstico, subiscono una reazione con il perossido di idrogeno, che porta alla formazione degli epossidi corrispondenti e dà origine a α,ω-dialdeidi lineari.

In alcuni casi, l’aggiunta di composti di boro facilita la reazione.
4.3. Processi vari
Simile al processo di formazione di monoaldeidi tramite deidrogenazione, la deidrogenazione dei dioli determina la produzione di dialdeidi.
Esistono anche altri percorsi, tra cui l’ozonizzazione dei cicloalcheni e la dimerizzazione delle aldeidi insature. Inoltre, l’idroformilazione degli acetali insaturi porta alle corrispondenti dialdeidi.
5. Produzione di acetali
Il metodo principale impiegato per la preparazione degli acetali è la reazione di un’aldeide con un alcol. In genere, un emiacetale instabile si forma come prodotto intermedio a causa della natura di equilibrio della reazione.
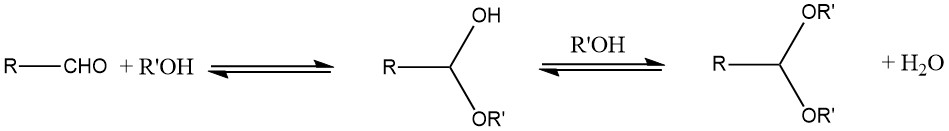
Per aumentare la resa, l’acqua prodotta durante la reazione deve essere rimossa utilizzando la distillazione azeotropica o agenti assorbenti l’acqua, come i setacci molecolari. In generale, gli acetali ciclici tendono a offrire rese migliori rispetto agli acetali a catena aperta.
L’acido solforico anidro o l’acido p-toluene sulfonico fungono da catalizzatori comuni, sebbene possano essere utilizzate anche altre opzioni come acidi inorganici, acido ossalico o adipico, resine a scambio ionico o setacci molecolari.
Durante l’acetalizzazione di aldeidi alifatiche sature contenenti un atomo di α-idrogeno, può verificarsi la formazione di 1-alchenil eteri se la temperatura di reazione è troppo elevata.
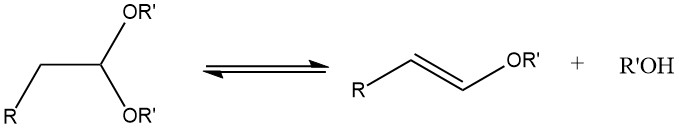
Gli acetali possono essere sintetizzati con buone rese dalla maggior parte delle aldeidi trattandole con ortoformiati, principalmente esteri metilici ed etilici, utilizzando acidi forti come catalizzatori, secondo il processo sviluppato da L. Claisen.
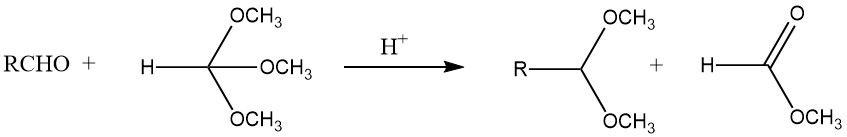
Inoltre, gli acetali possono essere ottenuti dalla reazione dell’acetilene con gli alcoli, dall’aggiunta di alcol agli eteri vinilici e dal trattamento di dialogenuri geminali con alcossidi. Aldeidi e ossirani producono 1,3-diossolani, mentre pirocatecoli e diclorometano formano 1,3-benzodiossoli.
La reazione acido-catalizzata delle olefine con la formaldeide determina la formazione di 1,3-diossani (reazione di Prins), effettuata a 55–75 °C con un eccesso di formaldeide.
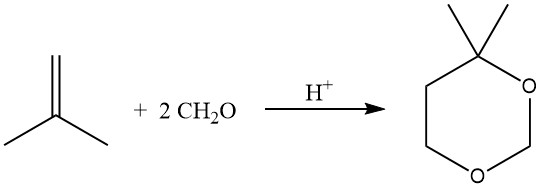
In condizioni di idroformilazione, la reazione di olefine con alcoli, spesso utilizzando catalizzatori a trasferimento di fase, può anche produrre acetali.
L’acetaldeide dimetil acetale si ottiene a 200 °C da metanolo e gas di sintesi in presenza di catalizzatore, con circa il 60% di conversione del metanolo e l’80-85% di selettività. I principali sottoprodotti includono acetaldeide ed acetato di etile.
Gli acetali si formano anche per reazione di esteri vinilici con alcoli in presenza di un catalizzatore di cloruro di palladio.
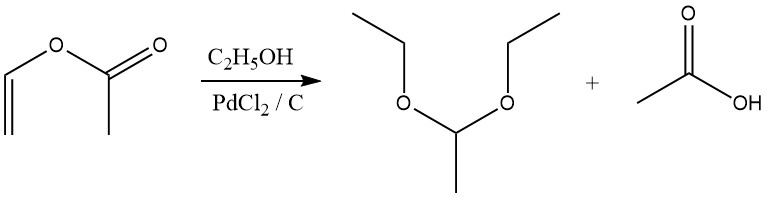
Riferimenti
- Aldehydes, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_321.pub3
- Production of aliphatic aldehydes. – https://patents.google.com/patent/US2623905A/en
