Metanolo: proprietà, produzione, reazioni e utilizzi
Cos’è il metanolo?
Il metanolo, noto anche come alcol metilico, è un composto chimico con formula CH3OH. È un liquido incolore e infiammabile con un caratteristico odore alcolico. Il metanolo è l’alcol più semplice ed è l’alcol più importante a livello industriale.
Il metanolo è una materia prima chimica fondamentale utilizzata nella produzione di un’ampia gamma di prodotti, tra cui materie plastiche, vernici e prodotti farmaceutici. Viene anche utilizzato come combustibile e fonte di energia.
Il metanolo fu isolato per la prima volta nel XVII secolo, ma solo all’inizio del XX secolo iniziò a essere prodotto su scala commerciale. Oggi, il metanolo viene prodotto utilizzando una varietà di processi, ma il metodo più comune prevede la reazione di monossido di carbonio e idrogeno in presenza di un catalizzatore di ossido di rame.
Il metanolo è una molecola altamente versatile e può essere convertita in un’ampia gamma di altre sostanze chimiche attraverso una varietà di reazioni chimiche. Ad esempio, il metanolo può essere utilizzato per produrre formaldeide, acido acetico e metilmetacrilato.
Il metanolo è anche utilizzato come combustibile e fonte di energia. Può essere miscelato con la benzina per ridurre le emissioni e può anche essere utilizzato nelle celle a combustibile per generare elettricità.
Sommario
1. Proprietà fisiche del metanolo
Il metanolo è un liquido incolore con elevata polarità e media pressione di vapore. È un solvente versatile che può sciogliere un’ampia gamma di sostanze, tra cui acqua, alcoli e altri solventi organici. È miscibile con oli e grassi in misura limitata.
Il metanolo ha le proprietà fisiche presentate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Stato fisico | Liquido |
| Colore | Incolore |
| Odore | Leggermente dolce, alcolico |
| Punto di fusione | −97,6 °C (−143,7 °F; 175,6 K) |
| Punto di ebollizione | 64,7 °C (148,5 °F; 337,8 K) |
| Densità | 0,792 g/cm³ |
| Solubilità in acqua | Miscibile |
| Pressione di vapore | 160 mmHg a 20 °C (68 °F) |
| Punto di infiammabilità | 11 °C (52 °F) |
| Limiti di infiammabilità | 6,7–36% in volume in aria |
| Temperatura di autoaccensione | 455 °C (851 °F) |
2. Reazioni chimiche del metanolo
Il metanolo è l’alcol più semplice e la sua reattività è determinata dal gruppo idrossilico. Il metanolo reagisce scindendo il legame C-O o O-H e il gruppo idrogeno o idrossilico può essere sostituito. A differenza degli alcoli superiori, il metanolo non può subire β-eliminazione per formare un legame multiplo.
Importanti reazioni industriali del metanolo includono:
- Deidrogenazione e deidrogenazione ossidativa
- Carbonilazione
- Esterificazione con acidi organici o inorganici e derivati acidi
- Eterificazione
- Aggiunta a legami insaturi
- Sostituzione di gruppi idrossilici
1. Combustione del metanolo: il metanolo può subire combustione, che è una reazione chimica che coinvolge la combinazione di metanolo con gas ossigeno per produrre anidride carbonica, acqua ed energia.
2 CH3OH + 3 O2 → 2 CO2 + 4 H2O + energia
Questa reazione è esotermica e produce molto calore, rendendo il metanolo un combustibile utile.
2. Esterificazione: il metanolo può reagire con acidi carbossilici per produrre esteri, che sono composti organici con un caratteristico odore dolce. Questa reazione è catalizzata da un catalizzatore acido, come l’acido solforico o l’acido cloridrico.
RCOOH + CH3OH → RCOOCH3 + H2O
3. Disidratazione: il metanolo può subire disidratazione, che è una reazione chimica che comporta la rimozione delle molecole d’acqua dal metanolo per produrre dimetil etere. Questa reazione è catalizzata da un catalizzatore acido, come l’allumina o la zeolite.
2 CH3OH → CH3OCH3 + H2O
4. Ossidazione: il metanolo può essere ossidato per produrre formaldeide (HCHO), un composto intermedio utile nella produzione di vari prodotti chimici.
2 CH3OH + O2 → 2 HCHO + 2 H2O
Questa reazione è solitamente catalizzata da un catalizzatore metallico, come rame o argento.
5. Metilazione: il metanolo può essere utilizzato come fonte di gruppi metilici (-CH3) in varie reazioni chimiche, come la metilazione dei fenoli per produrre metilfenoli.
C6H5OH + CH3OH → C6H4(OCH3)OH + H2O
3. Produzione di metanolo
Il metanolo è attualmente prodotto su scala industriale utilizzando una conversione catalitica a bassa pressione del gas di sintesi. Questo processo ha costi di investimento e produzione inferiori, una migliore affidabilità operativa e una maggiore flessibilità rispetto ad altri metodi.
La produzione di metanolo può essere suddivisa in tre fasi principali:
- Produzione di gas di sintesi
- Sintesi di metanolo
- Lavorazione di metanolo grezzo
3.1. Produzione di gas di sintesi
Il gas di sintesi può essere prodotto da una varietà di materiali carboniosi, tra cui carbone, coke, gas naturale, petrolio e frazioni di petrolio. Il gas naturale è la materia prima più comune per la produzione di gas di sintesi su larga scala per la sintesi del metanolo.
La composizione del gas di sintesi richiesto per la sintesi del metanolo è caratterizzata dal numero stechiometrico S, che è definito come segue:
S = (H2 – CO2)/(CO + CO2)
Il numero stechiometrico dovrebbe essere almeno 2,0 per la miscela di gas di sintesi. Valori superiori a 2,0 indicano un eccesso di idrogeno, mentre valori inferiori a 2,0 indicano una carenza di idrogeno.
Una carenza di idrogeno ridurrà la selettività al metanolo, mentre un eccesso di idrogeno aumenterà le dimensioni del ciclo di sintesi. Pertanto, una composizione di gas di sintesi con un numero stechiometrico leggermente superiore a 2,0 è ottimale per la sintesi del metanolo.
3.1.1. Gas di sintesi da gas naturale
La maggior parte del metanolo prodotto nel mondo deriva dal gas naturale, che può essere crackizzato tramite steam reforming, autothermal reforming, una combinazione di questi o tramite ossidazione parziale.
Steam Reforming
Nello steam reforming, la materia prima del gas naturale viene crackizzata cataliticamente in assenza di ossigeno con l’aggiunta di vapore ed eventualmente anidride carbonica. Ciò produce un gas di sintesi con un numero stechiometrico ben al di sopra di 2,0.
Il numero stechiometrico può essere regolato sul valore desiderato, leggermente al di sopra di 2,0, aggiungendo CO2 a monte o a valle del reformer a vapore. Il calore necessario per la reazione viene fornito esternamente.
Reforming autotermico
Nel reforming autotermico, la materia prima del gas naturale viene convertita tramite ossidazione parziale con ossigeno e reazione su un catalizzatore a base di Ni. Il calore per la reazione è fornito dalla reazione di ossidazione parziale esotermica. Il gas di sintesi ottenuto è caratterizzato da una carenza di idrogeno, quindi è necessario aggiungerlo prima di essere instradato al circuito di sintesi del metanolo.
Combinazione di reforming a vapore e autotermico
In una combinazione dei due processi, solo una parte del flusso di gas naturale viene sottoposta a reforming a vapore. Il resto viene immesso insieme al gas riformato a vapore in un reformer autotermico (ATR) riempito con catalizzatore a base di Ni.
Nell’ATR, il gas naturale viene parzialmente ossidato con ossigeno. Il numero stechiometrico del gas di sintesi può essere regolato a un valore leggermente superiore a 2,0 regolando la divisione tra vapore e reforming autotermico e selezionando i parametri di processo appropriati.
Ossidazione parziale
Nell’ossidazione parziale, la materia prima del gas naturale viene crackizzata senza catalizzatore mediante ossidazione diretta con ossigeno. Ciò genera calore per la reazione.
3.1.2. Gas di sintesi da altre materie prime
Idrocarburi
Gli idrocarburi superiori, come il gas di petrolio liquefatto, i gas di scarico delle raffinerie e la nafta, possono essere utilizzati anche come materie prime per la produzione di gas di sintesi per gli impianti di metanolo. Vengono lavorati principalmente tramite reforming a vapore.
Petrolio greggio, petrolio pesante, catrame e asfalto
I prodotti di petrolio greggio, petrolio pesante, catrame e asfalto possono anche essere convertiti in gas di sintesi, ma è più difficile rispetto al gas naturale. Il loro contenuto di zolfo è notevolmente più alto (0,7-1,5% di H2S e COS) e deve essere ridotto.
Il gas di sintesi prodotto contiene anche monossido di carbonio in eccesso e deve, pertanto, essere sottoposto a conversione di spostamento con acqua. L’eccesso di anidride carbonica risultante viene rimosso dal gas. La pulizia del gas e la rimozione dell’anidride carbonica possono essere ottenute, ad esempio, all’interno di un processo Rectisol.
Carbone
Il carbone può essere convertito in gas di sintesi con vapore e ossigeno tramite una varietà di processi a diverse pressioni (0,5-8 MPa) e temperature (400-1500 °C). Il gas di sintesi a base di carbone deve essere desolforato e sottoposto a conversione di spostamento per ottenere la stechiometria richiesta.
3.2. Sintesi del metanolo
Il metanolo viene sintetizzato dal gas di sintesi in un reattore a 200-300 °C e 5-10 MPa. La reazione è esotermica, quindi il calore deve essere rimosso per evitare che il reattore si surriscaldi.
Il gas che esce dal reattore viene raffreddato e il metanolo viene condensato. Il gas rimanente viene riciclato nel reattore, insieme al gas di sintesi fresco. Ciò è necessario perché solo il 50-80% del gas di sintesi viene convertito in metanolo in un passaggio.
Il metanolo grezzo viene quindi purificato e distillato. Il gas di spurgo dal circuito di riciclo viene utilizzato per riscaldare il reformer.
Sviluppo tecnologico
Fino al 1997, la differenza principale tra i processi industriali di metanolo a bassa pressione era la progettazione del reattore. La capacità massima degli impianti di metanolo era di 2.500-3.000 t/d.
Nel 1997, Lurgi ha introdotto il processo MegaMethanol, che combina diversi tipi di reattori con un impianto di produzione di gas di sintesi su larga scala. Ciò ha aperto la strada agli impianti di metanolo con capacità fino a 10.000 t/d per treno.
Oggi sono disponibili diverse tecnologie di sintesi del metanolo, ciascuna con i propri vantaggi e svantaggi. I principali fornitori di tecnologia sono Lurgi, JM/Davy, Topsøe, MGC, JM/Uhde, JM/Jacobs, JM/Others e JM/Toyo.
Tutte queste tecnologie si basano su concetti altamente integrati che includono tutti i passaggi dalla gassificazione e pulizia del gas alla sintesi e lavorazione. Ciò consente elevate efficienze energetiche e di carbonio fino al 67% e all’83%, rispettivamente.
3.2.1. Progettazione del reattore
Il metanolo è stato prodotto su scala industriale sin dagli anni ’60 e sono ancora in uso diversi progetti di reattori di base. La progettazione migliore per un impianto specifico dipenderà dai requisiti specifici, come la fonte di carbonio, la disponibilità di servizi e l’integrazione del calore.
Reattori adiabatici
I reattori adiabatici non rimuovono calore durante la reazione, quindi la temperatura aumenta gradualmente lungo l’asse del reattore. Ciò può essere mitigato spegnendo la reazione con gas freddo in diversi punti o utilizzando una serie di letti di reattore con refrigeratori intermedi.
Reattori quasi isotermici
I reattori quasi isotermici mantengono una temperatura relativamente costante in tutto il reattore. Ciò avviene in genere utilizzando un reattore tubolare con raffreddamento mediante acqua bollente. Esistono anche reattori raffreddati a gas, in cui il calore della reazione viene trasferito al gas di reazione.
Progetti specifici di reattori
Alcuni progetti specifici di reattori al metanolo includono:
- Reattore quasi isotermico standard: questo reattore utilizza un reattore tubolare con raffreddamento mediante acqua bollente.
- Reattore Variobar: questo reattore utilizza un reattore a fascio tubiero avvolto su più livelli, con tubi di raffreddamento incorporati nel riempimento del catalizzatore.
- Reattore raffreddato a gas: questo reattore ha un letto catalizzatore sul lato del guscio e il gas di sintesi scorre attraverso il letto catalizzatore in direzione assiale, radiale o assiale-radiale.
- Superconvertitore: questo reattore utilizza tubi a doppia parete riempiti di catalizzatore nello spazio anulare. Il gas di sintesi scorre prima attraverso il tubo interno per riscaldarlo, quindi nella direzione inversa attraverso il letto catalizzatore per rilasciare il calore di reazione.
3.2.2. Progetti di loop di sintesi del metanolo su larga scala
Il metanolo è un buon vettore energetico per le aree remote perché può essere facilmente trasportato. Tuttavia, per essere economici, gli impianti di produzione di metanolo devono essere su larga scala. Ciò significa che il tasso di conversione del gas di sintesi in metanolo deve essere elevato, in modo che la quantità di gas che scorre attraverso il circuito sia ridotta al minimo.
Un progetto per un impianto di sintesi del metanolo ad alta conversione è il Lurgi Combined Converter Methanol Synthesis (Figura 1). Questo processo utilizza due reattori in parallelo: un reattore ad acqua bollente quasi isotermico e un reattore raffreddato a gas.
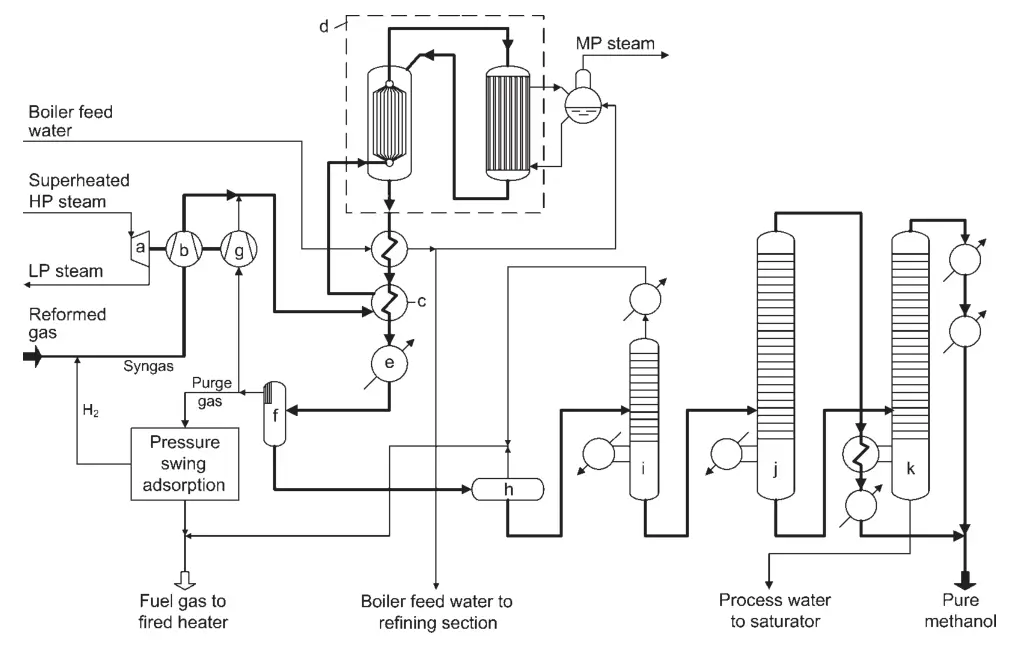
a) Turbina per gas di sintesi e compressore di riciclo; b) Compressore del gas di sintesi; c) Riscaldatore di rifinitura; d) Sistema di conversione combinato; e) Refrigeratore finale; f) Separatore di metanolo; g) Compressore del gas di riciclo; h) Vaso di espansione; i) Colonna di estremità leggere; j) Colonna di pressione del metanolo puro; k) Colonna di metanolo atmosferico
Il reattore quasi-isotermico converte la parte più reattiva del gas di sintesi, mentre il reattore raffreddato a gas converte il gas rimanente. Il calore di reazione dal reattore raffreddato a gas viene utilizzato per preriscaldare il gas di ingresso del reattore per il reattore quasi-isotermico.
Un altro progetto per un impianto di sintesi del metanolo ad alta conversione è la tecnologia a ciclo in serie di Davy Process Technology (Figura 2). Questo processo utilizza due reattori in serie, con lo stesso gas di circolazione utilizzato due volte. La forza motrice per la reazione viene mantenuta condensando il metanolo tra i due reattori.
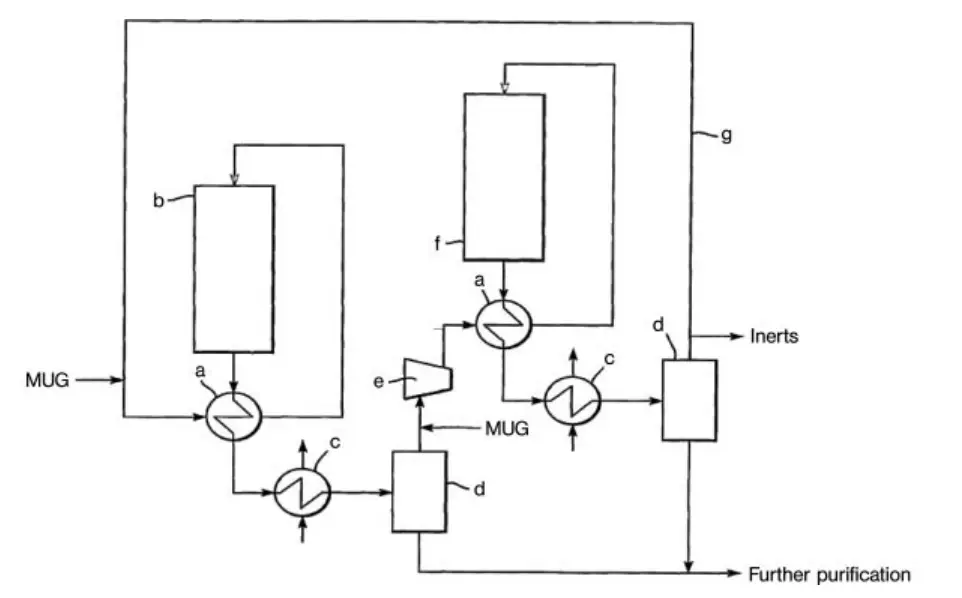
a) Interscambiatore; b) Reattore; c) Condensatore; d) Separatore gas-liquido; e) Circolatore; f) Reattore finale; g) Linea di riciclo del gas
3.3. Percorsi di sintesi alternativi del metanolo
3.3.1. CO2-in-metanolo
La valorizzazione chimica della CO2 mediante idrogenazione a metanolo è stata studiata fin dai primi anni ’90. Tuttavia, ha guadagnato interesse commerciale solo negli ultimi anni a causa della crescente consapevolezza della necessità di ridurre le emissioni di CO2 e dello sviluppo di politiche governative come le tasse sul carbonio e i programmi cap-and-trade.
Diverse aziende hanno sviluppato sistemi di catalizzazione e concetti di processo per la produzione di CO2-in-metanolo. Tuttavia, i risultati su scala pilota sono scarsi e gli unici progetti su scala dimostrativa sono di Mitsui Chemicals e Carbonrecycling, Islanda.
Le conoscenze di base sulla tecnologia di conversione da CO2 a metanolo sono già disponibili, ma le vere sfide sono la produzione di idrogeno rinnovabile e la produzione economica di CO2 pulita da flussi di gas di scarico.
I fattori politici, ecologici ed economici decideranno se e quando questa tecnologia arriverà sul mercato.
3.3.2. Sintesi di metanolo in fase liquida
Il metanolo può anche essere prodotto convertendo il monossido di carbonio (CO) con idrogeno in una fase liquida, in genere metanolo. Utilizzando condizioni di reazione idonee e sistemi di catalizzatori contenenti componenti alcalini, è possibile raggiungere produttività significative fino a 1,3 kg kgcat⁻¹ h⁻¹.
Il meccanismo di reazione nella fase liquida è diverso da quello nella fase gassosa. Comporta la carbonilazione del metanolo (o di un alcol superiore) al rispettivo estere metilico, seguita dall’idrogenolisi al rispettivo alcol e metanolo.
Alla fine degli anni ’90, un impianto dimostrativo su scala per la sintesi di metanolo in fase liquida è stato messo in funzione dal Dipartimento dell’energia degli Stati Uniti (DOE) insieme a Eastman e Air Products. Tuttavia, si è scoperto che la durata del catalizzatore è inferiore a quella dei processi convenzionali (caso migliore: 0,17%/giorno a 215 °C). Sia l’acqua che la CO2 hanno un effetto negativo sulle prestazioni del catalizzatore.
Nonostante queste sfide, la ricerca sulla sintesi del metanolo in fase liquida è in corso. Questo concetto è promettente perché ha il potenziale per essere più efficiente e meno costoso della sintesi convenzionale del metanolo in fase gassosa.
3.3.3. Ossidazione diretta del metano
L’ossidazione diretta del metano a metanolo è una reazione altamente desiderabile, ma è anche molto impegnativa. Ciò avviene perché la reazione è sfavorevole sia dal punto di vista cinetico che termodinamico.
La maggior parte dei sistemi di catalizzatori per l’ossidazione diretta del metano in metanolo produce una bassa conversione (<10%) o una bassa selettività (<80%). Tuttavia, alcune aziende affermano di aver sviluppato processi semplici ed efficienti per questa reazione, principalmente per piccole fonti di gas.
Un promettente sistema di catalizzatori è costituito dai catalizzatori Pt-CTF (struttura a base di triazina covalente) eterogenei in un mezzo di acido solforico. È stato dimostrato che questo sistema raggiunge un’elevata conversione e selettività per l’ossidazione diretta del metano in metanolo.
3.4. Distillazione del metanolo grezzo
Il metanolo grezzo che esce dal reattore contiene acqua e altre impurità, tra cui estremità leggere e pesanti. La quantità e la composizione di queste impurità dipendono dalle condizioni di reazione, dal gas di alimentazione e dal catalizzatore.
Per purificare il metanolo grezzo, viene prima reso leggermente alcalino aggiungendo piccole quantità di soda caustica acquosa per neutralizzare gli acidi carbossilici inferiori e idrolizzare parzialmente gli esteri. Quindi, le estremità leggere vengono rimosse in una colonna di estremità leggere. Infine, il metanolo puro viene distillato in testa in una o più colonne di distillazione.
Se le colonne di distillazione funzionano a pressioni diverse, il calore di condensazione dei vapori della colonna che funziona a pressione più alta può essere utilizzato per riscaldare la colonna a pressione più bassa.
Nel caso in cui l’acqua di processo contenga lievi impurità, è necessario un prelievo laterale o una colonna aggiuntiva per la purificazione.
Alcuni componenti formano miscele azeotropiche con il metanolo, come acetone, formiato di etile, acetato di metile, acetato di etile e propionato di metile.
4. Utilizzi del metanolo
Il metanolo ha una varietà di utilizzi in vari settori. Per informazioni dettagliate, vedere questo articolo: Utilizzi del metanolo →
5. Tossicologia del metanolo
Il metanolo è un alcol velenoso che può essere assorbito attraverso la bocca, la pelle e i polmoni. Viene metabolizzato in acido formico, che può causare acidosi e altri problemi di salute.
I sintomi dell’avvelenamento da metanolo includono dolore addominale, nausea, mal di testa, vomito, stanchezza, visione offuscata, oftalmologia, fotofobia e xantopsia. Nei casi gravi, l’avvelenamento da metanolo può portare al coma e alla morte.
La dose letale di metanolo è compresa tra 30 e 100 mL/kg di peso corporeo. La sensibilità al metanolo varia ampiamente.
Il trattamento per l’avvelenamento da metanolo include:
- Somministrazione di etanolo per inibire l’ossidazione del metanolo in acido formico
- Lavanda gastrica
- Emodialisi
- Trattamento con alcali per controllare l’iperacidità del sangue
- Somministrazione di stimolanti del SNC
- Bere grandi volumi di liquidi
- Benda per proteggere gli occhi dalla luce
- Mantenere il paziente al caldo
Il metanolo può anche causare avvelenamento cronico, caratterizzato da danni al sistema visivo e nervoso centrale.
Riferimento
- Metanolo; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_465.pub3
