Indolo: proprietà, reazioni, produzione e usi

Cos’è l’indolo?
L’indolo, noto anche come 1-benzo[b]pirrolo, è un composto organico eterociclico aromatico a struttura biciclica (un benzene fuso con un pirrolo) con formula chimica C8H7N. È un solido incolore con un odore di muffa molto persistente.
L’indolo fu scoperto per la prima volta da A. V. Baeyer e C. A. Knop nel 1866 a seguito di ricerche sulla riduzione dell’isatina, derivata dal colorante naturale indaco. L’indolo fu sintetizzato riscaldando l’ossindolo con polvere di zinco. Nel 1910, R. Weissgerber isolò l’indolo dal catrame di carbone.
L’indolo è stato trovato nella Robinia pseudacacia, nei gelsomini e in alcune piante di agrumi; nel profumo di Hevea bruziLiensis, nei fiori d’arancio e nel legno di Celtis reticulosa. Costituisce il 2,5% dell’olio di gelsomino e lo 0,1% dell’olio di fiori d’arancio. Se utilizzato nelle fragranze a concentrazioni più elevate, emana un intenso odore fecale.
L’indolo è planare con 10 elettroni π in un sistema completamente coniugato. L’anello è classificato come composto eteroaromatico π-eccessivo a causa del carattere donatore di elettroni dell’atomo di azoto di tipo pirrolico. Il sistema π è relativamente ricco di elettroni, in particolare al carbonio C-3.
Sommario
1. Proprietà fisiche dell’indolo
L’indolo è un solido cristallino incolore, facilmente solubile in alcol, benzene, etere e nella maggior parte dei solventi organici, ma scarsamente solubile in acqua. È volatile con il vapore acqueo.
L’indolo è un composto neutro (composto azotato non basico), ma può essere protonato o deprotonato rispettivamente da acidi o basi molto forti. Il pKa dell’acido coniugato è circa -2,4; quello del composto neutro è circa 16,7.
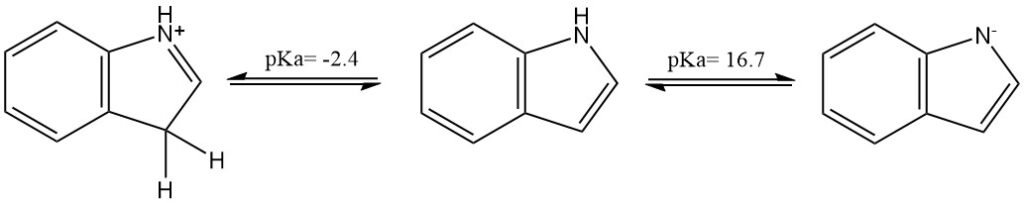
Le proprietà fisiche dell’indolo sono riassunte nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Numero CAS | [120-72-9] |
| Formula chimica | C8H7N |
| Peso molecolare | 117,15 g/mol |
| Punto di fusione | 52–54 °C |
| Punto di ebollizione | 254 °C |
| Densità | 1,22 g/cm3 |
| pKa | 16,7 |
| Calore di combustione | 3,650 kJ/kg (a 25 °C) |
| Entalpia di vaporizzazione (10,3–27,4 °C) | 597,5 kJ/kg |
| Momento di dipolo | 2,11 D (benzene) |
2. Reazioni chimiche dell’indolo
L’indolo, in quanto composto eterociclico, mostra la reattività caratteristica sia del pirrolo che del benzene. L’atomo di idrogeno legato all’azoto può essere sostituito da metalli alcalini. L’ossidazione dell’indolo produce indaco, mentre una lieve idrogenazione produce 2,3-diidroindolo (indolina). Le reazioni con acidi portano alla formazione di diindolo, triindolo e prodotti polimerici.
2.1. Sostituzione elettrofila aromatica dell’indolo
L’indolo può subire una sostituzione elettrofila aromatica grazie alla natura elettron-ricca della frazione pirrolica. Il carbonio in posizione 3 è il più reattivo sia per la distribuzione della densità elettronica che per la stabilità delle strutture intermedie.
Studi computazionali che utilizzano metodi di orbitali molecolari hanno rivelato che la densità elettronica in posizione 3 è maggiore rispetto a quella in posizione 2. Inoltre, le energie relative delle strutture intermedie formate durante la sostituzione elettrofila suggeriscono che la posizione 3 sia più favorevole all’attacco.
Questa preferenza è probabilmente dovuta al mantenimento del carattere benzenoide dell’anello carbociclico nell’intermedio formato in posizione 3.
Nel caso di indoli sostituiti in posizione 3, l’attacco elettrofilo può comunque verificarsi in posizione 3, anche se questa è già sostituita. Ciò può portare a un complesso schema di sostituzione, poiché sia il nuovo sostituente che quello originale possono migrare in posizione 2.
Molte comuni reazioni di sostituzione elettrofila aromatica possono essere eseguite sull’indolo. Tuttavia, spesso sorgono complicazioni dovute all’eccessiva reattività dell’indolo o alla relativa instabilità dei prodotti di sostituzione. Un esempio di questo tipo è l’alogenazione.
2.1.1. Alogenazione
L’alogenazione dell’indolo può essere ottenuta utilizzando vari reagenti, come lo ione ipoclorito, il cloruro di solforile, il tribromuro di piridinio e lo iodio. Il prodotto primario dell’alogenazione è tipicamente il derivato 3-aloindolo.
L’indolo può essere clorurato utilizzando ione ipoclorito o cloruro di solforile per produrre 3-cloroindolo. Tuttavia, il 3-cloroindolo è relativamente instabile in soluzioni acquose acide e può subire idrolisi a ossindolo.
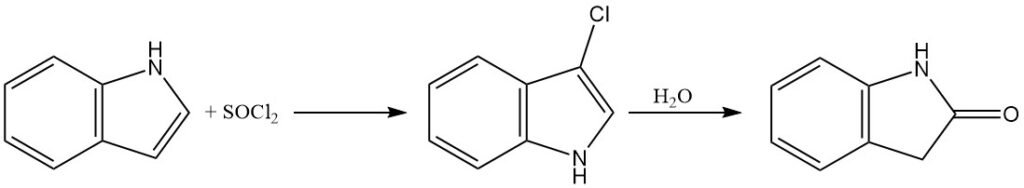
Il 3-bromoindolo può essere preparato utilizzando il tribromuro di piridinio come fonte di bromo elettrofilo. L’indolo reagisce con lo iodio per dare 3-iodoindolo.
Sia il 3-bromoindolo che il 3-iodoindolo sono suscettibili all’idrolisi in condizioni acide, ma sono relativamente stabili in ambienti basici.
2.1.2. Nitrazione
La nitrazione dell’indolo può essere una reazione complessa a causa della formazione di ossidi di azoto, che possono partecipare alle trasformazioni ossidative. In ambienti fortemente acidi, la nitrazione degli indoli 2-sostituiti avviene principalmente in posizione 5.
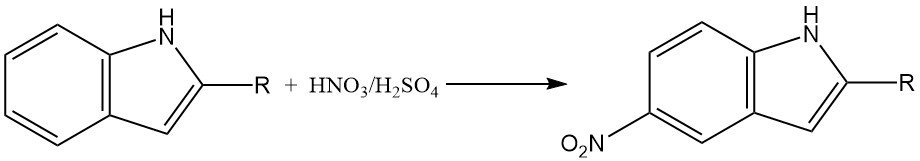
Ciò è probabilmente dovuto alla formazione di un intermedio acido coniugato, che ha un carattere aromatico ridotto ed è più suscettibile alla nitrazione in posizione 5.
2.1.3. Alchilazione
La alchilazione dell’indolo può essere ottenuta facendo reagire l’indolo con agenti alchilanti in condizioni appropriate. La regioselettività della alchilazione può essere influenzata dalle condizioni di reazione e dalla natura dell’agente alchilante.
Le condizioni che promuovono la formazione dell’intermedio di sostituzione aromatica elettrofila, come l’uso di basi forti o una forte coordinazione metallica all’azoto o agenti alchilanti altamente reattivi come composti allilici e benzilici, favoriscono l’alchilazione al C-3.
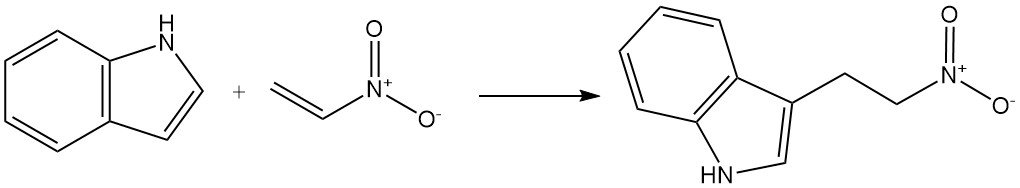
Anche i reagenti insaturi attivati da gruppi elettron-attrattori possono reagire con l’indolo per subire l’alchilazione al C-3. Un esempio è la reazione dell’indolo con nitroetilene per formare 3-(2-nitroetil)indolo.
La gramina, un intermedio formato dalla reazione dell’indolo con lo ione N,N-dimetilformalminio, può essere utilizzata per introdurre una varietà di sostituenti in posizione 3. Il gruppo dimetilamminico nella gramina può essere spostato dai nucleofili, oppure la gramina può essere convertita nel suo sale quaternario prima della sostituzione.
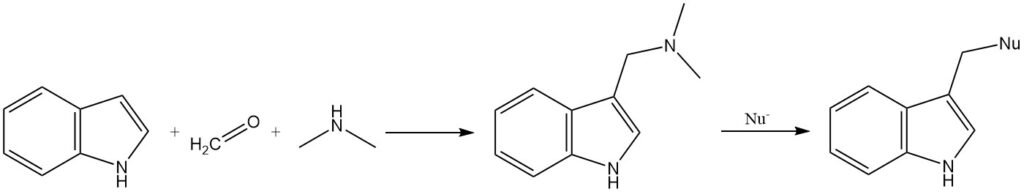
2.1.4. Acilazione
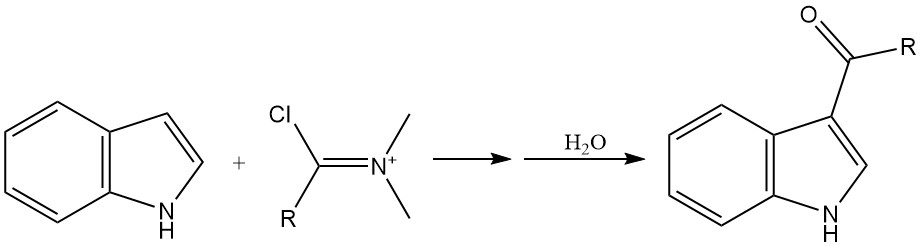
L’acilazione è un altro metodo importante per introdurre sostituenti sull’anello indolico, in particolare in posizione 3. L’acilazione può essere ottenuta utilizzando vari reagenti, come gli alogenuri acilici e i reagenti di Vilsmeier-Haack.
Gli alogenuri acilici altamente reattivi, come il cloruro di ossalile, possono acilare direttamente l’indolo senza la necessità di un catalizzatore. I normali cloruri acidi possono reagire con i sali di magnesio o zinco dell’indolo per produrre prodotti di acilazione.
La reazione di Vilsmeier-Haack, che coinvolge un’ammide e un ossicloruro di fosforo, è un metodo comune per l’acilazione dell’indolo.
2.2. N-alchilazione dell’indolo
Per facilitare la N-alchilazione, l’anello indolico deve essere deprotonato per generare l’anione indolo, che è un nucleofilo più forte della molecola di indolo neutra.
Questa deprotonazione può essere ottenuta utilizzando diverse basi forti, come l’ammide di sodio in ammoniaca liquida, l’idruro di sodio o l’idruro di potassio in solventi aprotici (N,N-dimetilformammide e dimetilsolfossido), oppure mediante catalisi a trasferimento di fase.
L’anione indolo generato viene alchilato per reazione con un alogenuro alchilico o un altro agente alchilante. La scelta dell’agente alchilante e le condizioni di reazione possono influenzare la regioselettività della N-alchilazione.
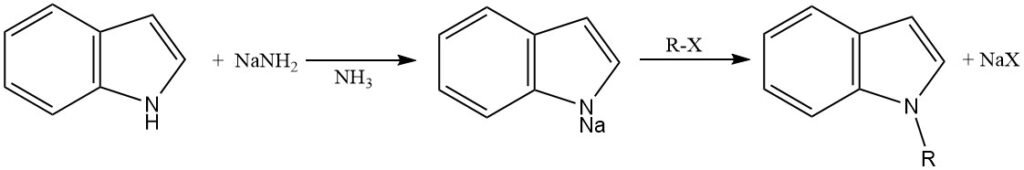
Per la N-alchilazione dell’indolo si possono utilizzare alogenuri alchilici primari, secondari e terziari. Tuttavia, gli alogenuri alchilici primari sono generalmente più reattivi degli alogenuri alchilici secondari o terziari. Possono essere utilizzati anche altri agenti alchilanti, come dialchilsolfati, alchiltosilati e alchiltriflati.
2.3. Arilazione dell’indolo
L’arilazione dell’indolo consiste nell’introduzione di un gruppo arilico sull’anello indolico. Questa reazione si realizza tipicamente attraverso intermedi sostituiti piuttosto che direttamente sull’indolo. Le reazioni di cross-coupling catalizzate dal palladio sono diventate il metodo preferito per l’arilazione degli indoli e di altri anelli eteroaromatici.
Le reazioni di cross-coupling catalizzate dal palladio comportano l’accoppiamento di un alogenuro arilico o di un ariltriflato con l’indolo in presenza di un catalizzatore al palladio. Il nucleofilo arilico può essere un acido indolo-stagno, indolo-zinco o indolo-boronico.
Le reazioni di cross-coupling catalizzate dal palladio sono altamente selettive, possono essere utilizzate per introdurre una varietà di gruppi arilici sull’anello indolico e vengono condotte in condizioni blande.
2.4. Litiazione e trasformazioni successive
La litiazione dell’indolo consiste nell’introduzione di un atomo di litio sull’anello indolico in posizione 2. Tre intermedi sono stati frequentemente utilizzati, come l’1-fenilsolfonilindolo (1), l’1-t-butossicarbonilindolo (2) o l’indolo-1-carbossilato di litio (3), ottenendo una buona resa.
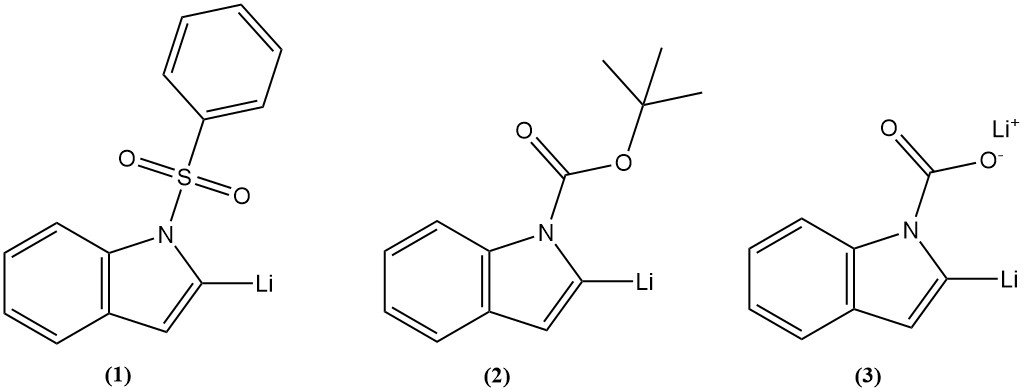
La litiazione dell’indolo in posizione 2 può essere seguita da una reazione con vari elettrofili per introdurre un’ampia varietà di sostituenti. La litiazione in altre posizioni dell’anello indolico può essere ottenuta mediante scambio alogeno-metallo.
2.5. Ossidazione dell’indolo
L’indolo è suscettibile all’ossidazione a causa della sua natura ricca di elettroni. L’ossidazione dell’indolo può portare alla formazione di vari intermedi e prodotti, a seconda dell’ossidante utilizzato.
L’ossidazione dell’indolo con l’ossigeno porta spesso alla formazione di intermedi 3-idroperossi-3H-indolo. Questi intermedi possono subire ulteriori trasformazioni, come decomposizione o riarrangiamento, per formare vari prodotti di ossidazione.
Anche gli acidi perossicarbossilici possono ossidare l’indolo per produrre prodotti simili a quelli ottenuti con l’ossigeno. Altri ossidanti chimici, come il dimetilsolfossido in acido acquoso o MoO5·HMPA, producono rispettivamente ossindoli e 3-idrossi-2-metossiindoline.
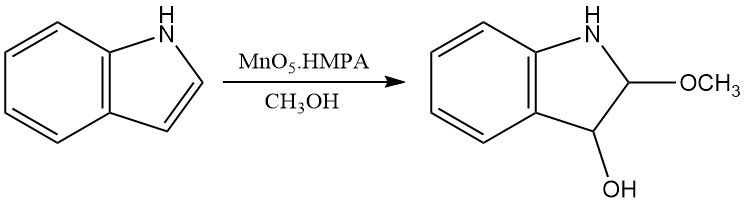
3. Produzione di indolo
L’indolo si ottiene principalmente da due fonti: catrame di carbone e sintesi chimica. Sebbene siano stati descritti metodi di sintesi per la produzione di indolo, l’estrazione dalla frazione distillata del catrame di carbone è l’unica fonte commerciale.
Il catrame di carbone ad alta temperatura contiene circa lo 0,2% di indolo. Durante la distillazione del catrame di carbone, l’indolo si concentra in una frazione bifenil-indolo che bolle in un intervallo di temperatura ristretto, compreso tra 245 e 255 °C.
Dopo aver rimosso fenoli e basi, l’indolo viene separato dal bifenile mediante:
- Reazione con idrossido di potassio per formare il suo sale di potassio, che può essere separato dal bifenile.
- Distillazione azeotropica con dietilenglicole.
- Estrazione dalla miscela bifenile-indolo utilizzando solventi selettivi come glicoli, dimetilsolfossido acquoso o monoetanolammina.
L’indolo grezzo ottenuto da questi processi può essere ulteriormente purificato mediante cristallizzazione da solventi idrocarburici alifatici.
Diversi metodi chimici sono stati sviluppati per la sintesi dell’indolo su scala tecnica, tra cui:
- La sintesi di Madelung prevede la formilazione dell’o-toluidina utilizzando acido formico, seguita da ciclizzazione per formare indolo.
- Deidrogenazione e ciclizzazione della 2-etilanilina per formare indolo.
- Ciclocondensazione di anilina ed etilenglicole in fase liquida o gassosa per produrre indolo.
- Ciclizzazione del 2-(2-nitrofenil)etanolo.
3.1. Produzione di indolo mediante sintesi di Madelung
La sintesi di Madelung è un metodo classico per la preparazione di indoli. Questa reazione consiste in una condensazione intramolecolare di un’o-alchilanilide. L’O-toluidina reagisce con l’acido formico per produrre N-formil-o-toluidina, che viene trattata con ammide sodica per formare indolo.
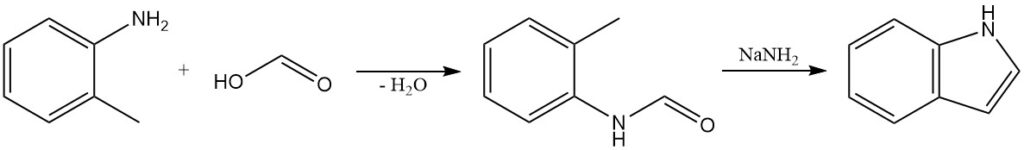
La sintesi di Madelung è stata utilizzata per preparare una varietà di indoli sostituiti, inclusi quelli con gruppi funzionali come alogeni, gruppi alchilici e gruppi arilici.
La sintesi di Madelung originale utilizzava alte temperature e basi forti come l’ammide di sodio. Ad esempio, l’o-metilacetanilide può essere convertita in 2-metilindolo riscaldandola con ammide di sodio a temperature elevate.
Negli ultimi anni, i ricercatori hanno sviluppato condizioni più miti per la sintesi di Madelung, che possono essere vantaggiose per substrati sensibili o quando è importante evitare reazioni collaterali.
Un metodo prevede l’utilizzo di basi forti e non nucleofile come l’n-butillitio o la litio diisopropilammide per formare un derivato dilitio dell’anilide, che può quindi subire ciclizzazione in condizioni più miti.
3.2. Altri metodi di sintesi
L’indolo può essere sintetizzato attraverso diverse vie, tra cui la reazione dell’anilina con bromuro di etilene, il riscaldamento dell’o-ammino-ω-clorostirene con etossido di sodio e il riscaldamento della dianilide dell’acido tartarico con cloruro di zinco.
L’acido indolo-2-carbossilico, che produce indolo per decarabossilazione, può essere formato riscaldando l’o-formilfenilglicina con anidride acetica e acetato di sodio.
Altri metodi per la sintesi dell’indolo includono la distillazione dell’acido ossal-o-toluico con polvere di zinco o il suo sale di bario, la pirolisi della N-etilanilina, la deidrogenazione catalitica della o-etilanilina e il riscaldamento a pressione ridotta dell’o,o’-diamminostilbene cloridrato.
L’indolo può anche essere ottenuto attraverso la riduzione di o-nitrofenilacetonitrile, acido o-nitrocinnamico o o-nitrofenilacetaldeide.
Infine, l’indolo può essere preparato trattando l’acido acetil-o-amminocinnamico con acido cloridrico ad alte temperature o riducendo l’o-ω-dinitrostirene. Anche il riscaldamento dell’acido indolo-2-carbossilico e dell’acido chinolin-2,3-dicarbossilico con carbonato di calcio produce indolo.
3.3. La sintesi di Fischer dell’indolo
La reazione di Fischer si è dimostrata la più versatile per la sintesi di derivati dell’indolo, sebbene la reazione non possa produrre indolo da sola. Da un punto di vista teorico, l’acetaldeide fenilidrazone produrrebbe indolo attraverso la sintesi di Fischer, ma in realtà non si ottiene nulla.
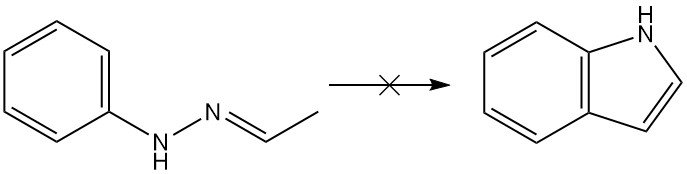
La sintesi di Fischer dell’indolo è un metodo classico per la preparazione di indoli che prevede la ciclizzazione di un N-arilidrazone in condizioni acide per formare un indolo.
Il passaggio chiave nella sintesi di Fischer dell’indolo è un riarrangiamento sigmatropico [3,3] del tautomero eneidrazone dell’idrazone. Affinché la ciclizzazione avvenga, è necessario che vi sia almeno un atomo di idrogeno α sul legame C-N. La regioselettività della reazione è influenzata dai sostituenti sul carbonio dell’idrazone.
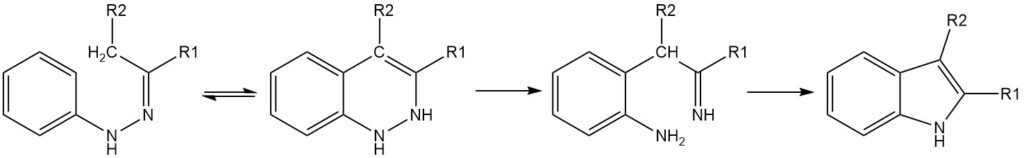
Se è presente un solo atomo di idrogeno α sul legame C-N, il prodotto sarà un 3H-indolo 3,3-disostituito. Se entrambi i sostituenti sul carbonio dell’idrazone presentano uno o più atomi di idrogeno α, si possono formare miscele di prodotti.
Generalmente, il sostituente più ramificato ha maggiori probabilità di subire ciclizzazione. Ad esempio, i fenilidrazoni derivati da metil alchil chetoni producono tipicamente 2-metilindoli. Tuttavia, la selettività può essere invertita in determinate condizioni di reazione.
La presenza di sostituenti sull’anello fenilico dell’idrazone può anche influenzare la regioselettività della sintesi di Fischer dell’indolo. I meta-sostituenti possono portare alla formazione di indoli isomerici, mentre i orto-sostituenti rendono la reazione più complicata.
3.4. Biosintesi dell’indolo dal triptofano
Una delle principali fonti di indolo nei sistemi biologici è l’amminoacido triptofano. La conversione del triptofano in indolo avviene attraverso una serie di reazioni enzimatiche note come via di degradazione del triptofano. Questa via è presente principalmente in batteri e funghi, ma può essere attiva anche in alcuni tessuti dei mammiferi, come il fegato e l’intestino.
Il primo passaggio di questa via è la scissione del triptofano da parte dell’enzima triptofanasi. Questa reazione produce indolo, piruvato e ammoniaca.
Oltre alla via della triptofanasi, il triptofano può essere degradato anche attraverso la via della chinurenina, che è coinvolta principalmente nella produzione di niacina (vitamina B3), ma produce anche derivati indolici.
4. Usi dell’indolo
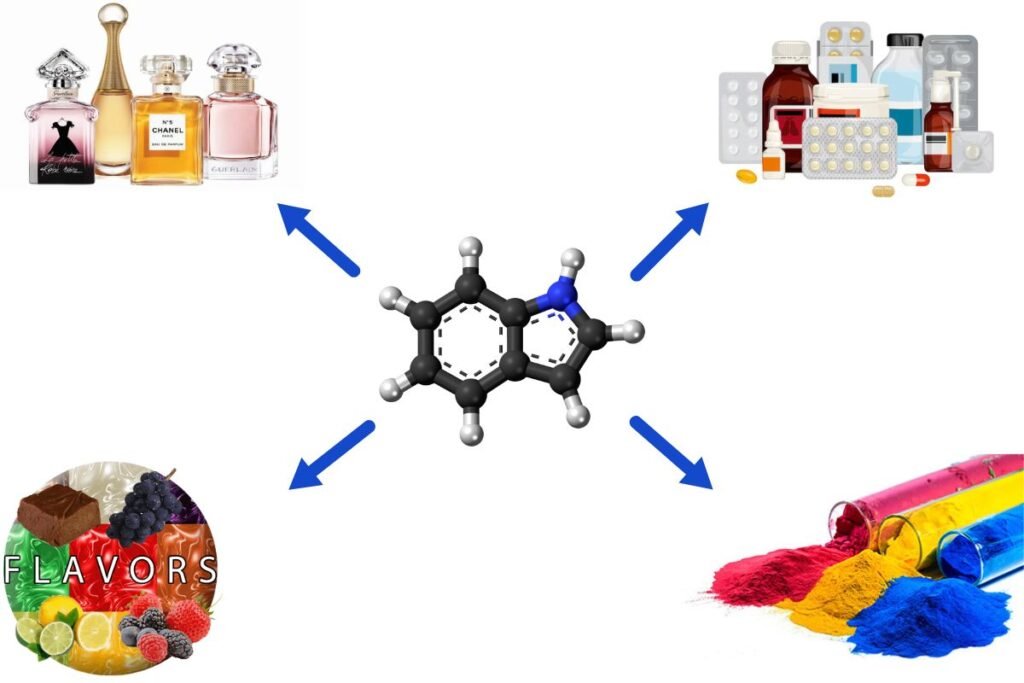
L’indolo è utilizzato in vari settori, tra cui quello farmaceutico, della profumeria e degli aromi. È anche un componente naturale di diverse sostanze, come il fumo di tabacco, l’olio di gelsomino e l’olio di fiori d’arancio. È un prodotto della degradazione batterica del triptofano nell’intestino.
Grazie al suo aroma gradevole, l’indolo è stato utilizzato per molti anni come fissativo di fragranze. Viene anche utilizzato come agente aromatizzante sintetico.
L’indolo può agire come cairomone, una sostanza chimica volatile rilasciata dalle piante per attirare gli insetti fitofagi.
L’indolo è un precursore per la sintesi dell’amminoacido essenziale triptofano. Per produrre triptofano dall’indolo, si possono utilizzare metodi sia chimici che biotecnologici.
L’indolo viene utilizzato per sintetizzare regolatori della crescita delle piante come l’acido indolo-3-acetico e l’acido indolo-3-butanoico. L’indolina, un derivato dell’indolo, viene utilizzata nella sintesi di fitoprotettori fungicidi e battericidi.
I derivati indolici hanno una vasta gamma di applicazioni farmaceutiche, tra cui:
- L’indometacina e altri derivati indolici sono utilizzati come analgesici blandi.
- L’indolina e i suoi derivati sono utilizzati nella sintesi di farmaci antipertensivi.
- La triptamina, un derivato dell’indolo, è utilizzata nella sintesi del vasodilatatore vincamina.
- I piridilachilindoli, derivati dall’indolo, sono utilizzati come antidepressivi, antistaminici e antipertensivi.
- I 3-peridinilindoli, ottenuti dall’indolo, sono utilizzati per prevenire l’anossia.
- Il 5-cloroindolo, un derivato dell’indolo, è utilizzato nella produzione di tranquillanti, antipertensivi e antiemetici, nonché nel trattamento del morbo di Parkinson.
Indolo e I suoi derivati sono utilizzati come intermedi nella sintesi di vari coloranti, tra cui diazocoloranti cationici, coloranti cianinici, coloranti a base di indolilmetano e coloranti a base di carbazolo-ftaleina.
5. Tossicologia dell’indolo
La popolazione generale può essere esposta all’indolo attraverso l’inalazione di aria ambiente o fumo di tabacco, l’ingestione di alimenti contaminati e il contatto cutaneo con vapori, alimenti, profumi o altri prodotti contenenti indolo. L’esposizione professionale può verificarsi nei luoghi di lavoro in cui l’indolo viene prodotto o utilizzato.
L’indolo può essere assorbito attraverso varie vie, tra cui inalazione, ingestione e contatto cutaneo.
L’indolo assorbito dal tratto gastrointestinale viene metabolizzato nel fegato per formare indossile, che viene poi coniugato con solfato per produrre indicano. Questi metaboliti vengono escreti principalmente attraverso le urine.
L’indolo viene facilmente assorbito dal tratto gastrointestinale e subisce un rapido metabolismo nel fegato. I principali metaboliti dell’indolo includono indicano e ossindolo, che vengono escreti principalmente attraverso le urine.
La DL50 orale acuta dell’indolo nei ratti e nei topi è rispettivamente di circa 1000-1100 mg/kg e 500 mg/kg. Studi autoptici successivi all’esposizione acuta hanno rivelato emorragie e iperemia negli organi e nei tessuti interni. L’indolo ha un odore sgradevole e può causare nausea a basse concentrazioni.
L’indolo può causare una leggera irritazione temporanea alla pelle e agli occhi se applicato localmente. A differenza del suo derivato metilato, lo scatolo, l’indolo non induce lesioni polmonari nei bovini dopo ripetute applicazioni orali.
Alte dosi croniche di indolo (20-200 mg/kg/die per più di tre mesi) in topi, ratti, conigli e cani sono state associate a effetti ematologici, tra cui anemia, leucocitosi e leucopenia. Nei bovini, emolisi e nefrosi emoglobinurica sono state osservate a seguito di dosi orali ripetute.
Sebbene non vi siano prove sperimentali definitive sulla cancerogenicità dell’indolo, esso può influenzare la formazione di tumori causati da altri agenti. È stato dimostrato che dosi elevate di indolo (800 mg/kg/giorno) accelerano lo sviluppo di tumori cutanei e carcinomi della vescica in modelli animali.
Per quanto riguarda la genotossicità, è stato riscontrato che l’indolo potenzia gli effetti mutageni di altri agenti nel test di Ames. Tuttavia, l’indolo di per sé non è risultato mutageno nel test di Ames né in un test di trasformazione cellulare. In un test di riparazione del DNA, l’indolo ha causato danni al DNA riparabili in Bacillus subtilis.
L’indolo ha ottenuto lo status GRAS (generalmente riconosciuto come sicuro) dalla Flavor and Extract Manufacturer’s Association (FEMA) ed è approvato per l’uso come aromatizzante negli alimenti. Tuttavia, non esistono limiti specifici di esposizione professionale all’indolo stabiliti dalle agenzie di regolamentazione.
Riferimenti bibliografici
- Indole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_167
- Indole; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0914041519211404.a01
- Indole; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543008605
- Indole; Chemistry of Heterocyclic Compounds, Volume 8. – https://onlinelibrary.wiley.com/doi/10.1002/9780470186572.ch1
- https://www.sciencedirect.com/science/article/abs/pii/S092809871630207X
- https://www.sciencedirect.com/science/article/abs/pii/S0040403921007413
