Dimetilammina: proprietà, reazioni, produzione e usi
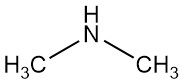
La dimetilammina è un composto organico con formula (CH3)2NH. È un gas incolore e infiammabile con un odore simile all’ammoniaca, anche se a basse concentrazioni può avere un odore di pesce, e il suo odore è più potente della metilammina e meno della trimetilammina. La dimetilammina è comunemente presente in commercio come soluzione in acqua a concentrazioni fino a circa il 40%.
Sommario
1. Proprietà fisiche della dimetilammina
La dimetilammina è un gas o liquido compresso nocivo e incolore, altamente infiammabile, con odori molto forti di pesce o di ammoniaca. È solubile in acqua e viene venduta come soluzioni acquose o in forma pura.
Raffreddando le soluzioni acquose di dimetilammina, si forma l’idrato cristallino (CH3)2NH·7 H2O. La dimetilammina è solubile in vari solventi organici.
Le soluzioni acquose di dimetilammina sono buoni solventi per molti composti inorganici e organici; tuttavia, è necessario considerare la potenziale reattività del soluto con la dimetilammina.
La Tabella 1 elenca le proprietà fisiche della dimetilammina.
| Proprietà | Valore |
|---|---|
| Peso molecolare, g/mol | 45,08 |
| Punto di ebollizione (101,33 kPa), °C | 6,8 |
| Punto di fusione, °C | -92,2 |
| Densità a 25 °C (liquido), g/cm3 | 0,6556 |
| pKa (a 25 °C) | 10,77 |
| Indice di rifrazione a 17 °C | 1,350 |
| Tensione superficiale (25 °C), 10-3 N/m | 16,33 |
| Calore di vaporizzazione a 25 °C, kJ/mol | 23,663 |
| Calore di fusione, kJ/mol | 5,945 |
| Calore di formazione standard, kJ/mol a 25 °C (liquido) | -43,96 |
| Calore di formazione standard, kJ/mol a 25 °C (gas) | -18,46 |
| Calore di combustione, stato standard a 25 °C, liquido, kJ/mol | -1744,63 |
| Capacità termica, gas ideale (25 °C), J K-1 mol-1 | 70,7 |
| Temperatura critica, °C | 164,5 |
| Pressione critica, MPa | 5,31 |
| Costante dielettrica (25°C), liquido | 5,26 |
| Momento di dipolo nel benzene (25°C), D | 1,18 |
| Punto di infiammabilità (vaso chiuso), °C | -57 |
| Temperatura di accensione in aria, °C | 400 |
| Limite inferiore di esplosione in aria, vol % | 2,8 |
| Limite superiore di esplosione in aria, vol % | 14,4 |
2. Reazioni chimiche della dimetilammina
La dimetilammina è basica e, di conseguenza, reagisce con acqua e acidi per formare composti di dimetilammonio. A causa della presenza di gruppi metilici donatori di elettroni, la dimetilammina possiede una basicità maggiore dell’ammoniaca.
Questi gruppi metilici stabilizzano la carica positiva formata durante la protonazione. Tuttavia, la sua basicità rimane più debole rispetto agli ioni idrossido e alcolato.
La dimetilammina si comporta come un nucleofilo a causa della presenza di una coppia di elettroni non condivisi sull’atomo di azoto. La dimetilammina reagisce facilmente con una varietà di substrati, tra cui acidi carbossilici, alogenuri acilici, anidridi, esteri, lattoni, isocianati, nitrili ed esteri α,β-insaturi, epossidi, alogenuri alchilici, anidride carbonica e disolfuro di carbonio.
La reazione della dimetilammina con un acido organico o l’estere di un acido organico porta alla formazione di un’ammide dimetil-sostituita.
La dimetilammina e il fosgene reagiscono per produrre tetrametilurea. La reazione con l’urea porta alla prevista N,N-dimetilurea.
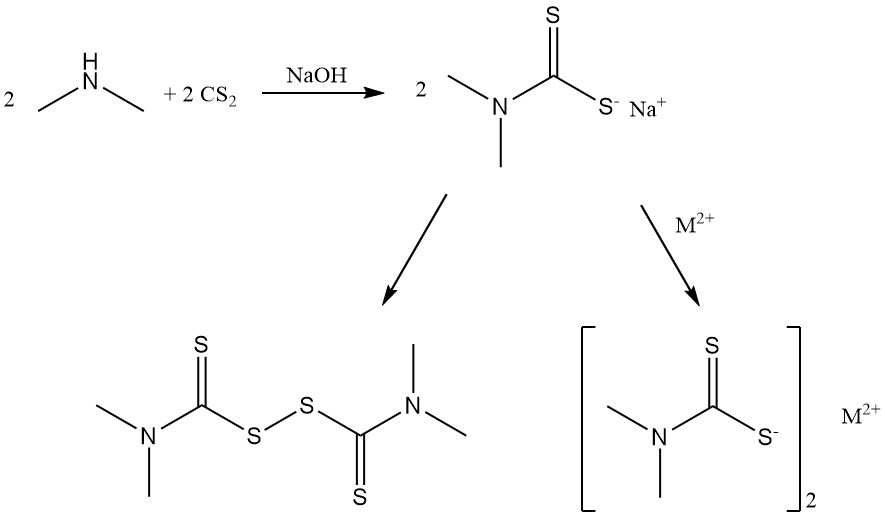
La reazione della dimetilammina con disolfuro di carbonio produce sali di dimetilditiocarbammato e disolfuro di bis(dimetilditiocarbamoile) utilizzato come acceleratori di gomma.
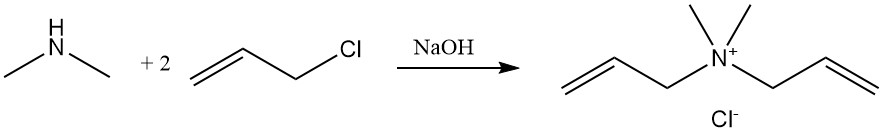
La reazione della dimetilammina con il cloruro di allile produce cloruro di diallildimetilammonio, un monomero che viene polimerizzato e utilizzato come flocculante nelle applicazioni di trattamento delle acque.
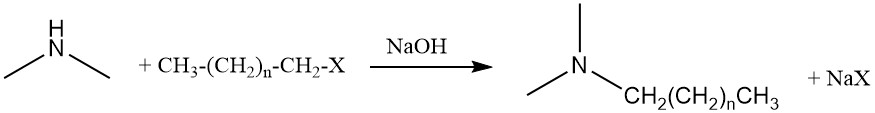
La dimetilammina può anche subire un’ulteriore reazione di amminazione con alcoli grassi o alogenuri grassi per produrre alchildimetilammine, che sono precursori dei tensioattivi di ossido di ammina.
Sia l’acido nitroso che il cloruro di nitrosile convertono la dimetilammina nella corrispondente nitrosammina.
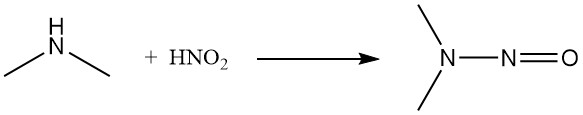
L’ossido di etilene reagisce con la dimetilammina per dare dimetiletanolammina.

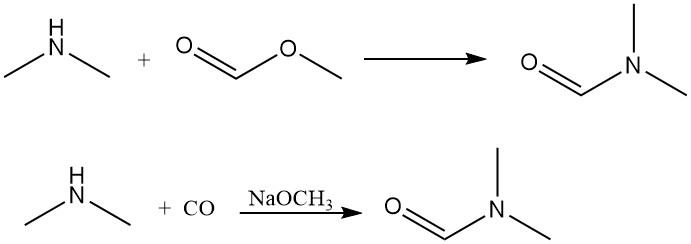
La dimetilammina reagisce con il formiato di metile per generare dimetilformammide, un solvente aprotico dipolare. Questa reazione può anche essere ottenuta in modo efficiente tramite aggiunta diretta di monossido di carbonio con una base come catalizzatore.
La dimetilammina reagisce con l’anidride carbonica per formare carbammati di dimetilammina in condizioni anidre e carbonati di dimetilammina in presenza di acqua.
La dimetilammina è corrosiva per alluminio, rame, leghe di rame, metallo zincato, magnesio, zinco e leghe di zinco. La dimetilammina anidra e le sue soluzioni acquose possono essere gestite utilizzando materiali realizzati in acciaio.
3. Produzione di dimetilammina
Commercialmente, la dimetilammina è prodotta dall’amminazione del metanolo con ammoniaca. Questo processo avviene in fase di vapore (300-500 °C e 790-3550 kPa) su reattori a letto fisso, producendo una miscela di mono-, di- e trimetilammina.

Metodo 1: amminazione di metanolo catalizzata da acido (processo Leonard)
Questo metodo tradizionale utilizza un catalizzatore acido solido, in genere silice-allumina amorfa, per promuovere la conversione ad alta temperatura del metanolo. La reazione raggiunge l’equilibrio, favorendo la formazione di trimetilammina a rapporti ammoniaca-metanolo inferiori. Tuttavia, le richieste del mercato danno priorità alla dimetilammina, seguita da metilammina e trimetilammina.
Metodo 2: amminazione di metanolo catalizzata da acido selettiva per forma
Questo metodo affronta le sfide di selettività del Metodo 1 impiegando catalizzatori zeolitici selettivi per forma (ad esempio, mordeniti modificate, RHO e chabasite). Questi catalizzatori limitano la formazione di molecole di trimetilammina ingombranti all’interno dei loro pori, portando a una miscela di prodotti arricchita in dimetilammina.
L’aminazione del metanolo comporta reazioni di sostituzione sequenziale, trasformando il metanolo in ammine primarie, secondarie e terziarie. Inoltre, si verificano reazioni di disproporzione, che stabiliscono un equilibrio tra i diversi prodotti di metilammina.
Il metodo 1 in genere funziona con un’elevata conversione del metanolo e si basa su rapide reazioni di disproporzione. Ciò si traduce in una miscela di equilibrio regolata dal rapporto ammoniaca-metanolo. Per ottenere la distribuzione del prodotto desiderata, la metilammina e la trimetilammina in eccesso non reagite vengono spesso riciclate, il che è ad alta intensità energetica.
L’avvento dei catalizzatori zeolitici selettivi in base alla forma ha offerto una soluzione per ottimizzare la selettività del prodotto. A causa delle limitazioni delle dimensioni dei pori, questi catalizzatori limitano la formazione e la diffusione delle molecole di trimetilammina, favorendo la produzione di dimetilammina.
Esempi di processi commerciali includono quanto segue:
- Processo Mitsubishi Rayon: questa configurazione a due reattori utilizza un catalizzatore non selettivo per la disproporzione iniziale della trimetilammina, seguito da un letto di catalizzatore zeolitico selettivo in base alla forma per un’ulteriore regolazione del prodotto.
- Processo chimico Mitsui: questo processo ricicla continuamente la trimetilammina come miscela azeotropica con ammoniaca, promuovendone la disproporzione e la successiva conversione in dimetilammina desiderata utilizzando un catalizzatore mordenite sililato selettivo per forma.
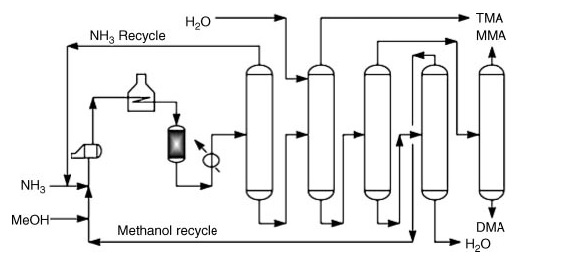
*MMA: metilammina; DMA: dimetilammina e TMA: trimetilammina
Dopo le fasi di reazione, il recupero del prodotto puro comporta una serie di fasi di distillazione:
- Separazione e riciclaggio dell’ammoniaca.
- Recupero della trimetilammina utilizzando acqua per una maggiore volatilità.
- Separazione di metilammina e dimetilammina da acqua e metanolo non reagito.
- Recupero individuale di metilammina e dimetilammina purificate.
- Separazione di metanolo non reagito da acqua.
4. Utilizzi della dimetilammina
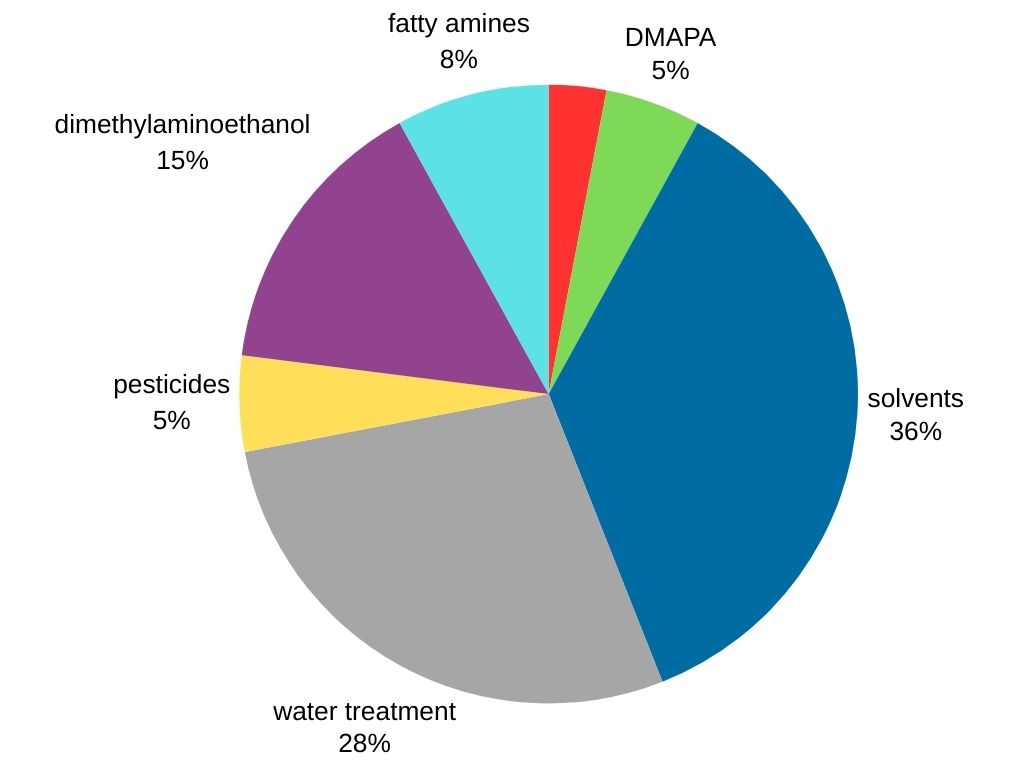
La dimetilammina si distingue come la metilammina più richiesta nel mercato globale. È utilizzata in vari settori, tra cui:
- Produzione di solventi: la dimetilammina funge da precursore cruciale per la sintesi di solventi popolari come la dimetilformammide e la dimetilacetammide.
- Trattamento delle acque
- Tensioattivi: la dimetilammina è utilizzata nella produzione di 3-dimetilamminopropilammina (DMAPA), che è un intermedio tensioattivo.
- Lavorazione della gomma: la dimetilammina reagisce con il disolfuro di carbonio per produrre dimetil ditiocarbammato, un componente cruciale nella vulcanizzazione della gomma, che rafforza e migliora le proprietà della gomma.
- Prodotti agrochimici (pesticidi)
- Altri prodotti chimici (dimetilamminoetanolo e ammine grasse).
5. Tossicologia della dimetilammina
La dimetilammina è un liquido o gas infiammabile che presenta un rischio di incendio significativo.
Effetti di esposizione acuta
- Irritanti e corrosivi per la pelle e gli occhi: il contatto può causare gravi ustioni e irritazioni.
- Irritante per inalazione: la respirazione irrita naso, gola e polmoni. Alte concentrazioni possono causare accumulo di liquidi nei polmoni (edema polmonare), un’emergenza medica.
Effetti di esposizione cronica
- Può danneggiare il fegato in caso di esposizione ripetuta.
- Potenziale rischio riproduttivo (effetti sui testicoli maschili).
- Può irritare i polmoni, causando bronchite con tosse, catarro e mancanza di respiro.
Secondo i dati attuali, la dimetilammina non è classificata come cancerogena.
Limiti di esposizione sul posto di lavoro
- OSHA PEL (limite di esposizione consentito): 10 ppm in media su una giornata lavorativa di 8 ore.
- NIOSH REL (limite di esposizione raccomandato): 10 ppm in media su una giornata lavorativa di 10 ore.
- ACGIH TLV (valore limite di soglia): 5 ppm in media su una giornata lavorativa di 8 ore, limite di esposizione a breve termine (STEL) di 15 ppm.
Misure precauzionali
- Controlli tecnici: dare priorità alle operazioni di chiusura e all’utilizzo di ventilazione di scarico locale per ridurre al minimo l’esposizione aerea.
- Pratiche di lavoro: mantenere buone pratiche igieniche, evitare il contatto con la pelle e gli occhi e non mangiare, bere o fumare in aree contaminate.
- Dispositivi di protezione individuale: quando i controlli tecnici sono insufficienti, indossare guanti, indumenti, occhiali o maschere di sicurezza resistenti alle sostanze chimiche e respiratori seguendo i protocolli stabiliti.
Conservazione e Manipolazione
- Conservare in contenitori ermeticamente chiusi in un’area fresca e ben ventilata, lontano da fonti di calore e sostanze chimiche incompatibili (ad esempio, agenti ossidanti, acidi forti e mercurio).
- Mettere a terra e legare i contenitori metallici durante le operazioni di trasferimento.
- Utilizzare utensili e attrezzature antiscintilla, in particolare quando si maneggiano i contenitori.
Riferimenti
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/0737.pdf
