Cloruro di ammonio: proprietà, produzione e usi

Cos’è il cloruro di ammonio?
Il cloruro di ammonio è un composto chimico con formula NH4Cl. Esiste come un solido cristallino bianco con un caratteristico sapore salato ed è comunemente noto come sale ammoniacale.
Il cloruro di ammonio si trova naturalmente nel materiale vulcanico, ma la sua estrazione da fonti naturali ha un’importanza minima. La produzione industriale di NH4Cl è strettamente legata al progresso dell’industria della soda e alla sintesi su larga scala di NH3 sintetico.
Inizialmente destinato all’uso come fertilizzante, il cloruro di ammonio trova ora applicazioni in diversi campi. I suoi processi di produzione sono di particolare interesse per l’ingegneria chimica a causa del loro significato storico come un primo esempio di elaborazione chimica che include tutte e tre le fasi: solido, liquido e gas.
Sommario
1. Proprietà del cloruro di ammonio
La massa molare del cloruro di ammonio è 53,49 g/mol ed è un solido con una densità specifica di 1,530 a 20 °C. Il suo calore specifico medio, cp, tra 298 K e 372 K, è misurato a 1,63 kJ/kg. Il cloruro di ammonio ha due forme cristalline reversibili, con la trasformazione tra di esse che avviene a 457,6 K (184,5 °C).
La forma stabile a temperatura ambiente è la forma α, mentre il β-NH4Cl (cubico; tipo NaCl) fonde a 793,2 K a 3,45 MPa e sublima a pressione atmosferica. A temperature più basse, NH4Cl è relativamente volatile e si dissocia in NH3 e HCl.
La solubilità di NH4Cl in acqua aumenta con l’aumento della temperatura. Il calore integrale della soluzione a saturazione è +15,7 kJ/mol e il calore differenziale della soluzione a saturazione è +15,2 kJ/mol.
L’aggiunta di ammoniaca può aumentare la solubilità in acqua, mentre la presenza di NaCl tende a precipitare NH4Cl da soluzioni ammoniacali. NH4Cl mostra anche deboli proprietà igroscopiche.
L’umidità può causare l’agglomerazione del prodotto ed è incerto se i soli contenuti di umidità inferiori allo 0,1% in peso siano responsabili dell’agglomerazione del cloruro di ammonio. La sublimazione potrebbe essere un’altra possibile spiegazione di questo fenomeno.
Il cloruro di ammonio è altamente solubile in NH3 liquido ma praticamente insolubile in acetone e piridina. A 292,7 K, presenta una solubilità del 3,24% in peso in metanolo e dello 0,64% in peso in etanolo.
La forma cristallina ottenuta da soluzioni acquose di NH4Cl può essere influenzata da altre sostanze, che sono state sfruttate per produrre grandi cristalli e aiutano a identificare le impurità durante la produzione di NH4Cl.
2. Produzione di cloruro di ammonio
La produzione commerciale di cloruro di ammonio comporta due processi principali:
1. Processo Solvay modificato (processo ammoniaca – carbonato di sodio o ASAP): questo è uno dei metodi più utilizzati per la produzione commerciale di NH4Cl. Comporta la reazione tra ammoniaca e carbonato di sodio (carbonato di sodio) per produrre bicarbonato di ammonio, che viene poi convertito in cloruro di ammonio mediante riscaldamento.
2. Reazione diretta tra HCl e NH3: in questo processo, il cloruro di ammonio viene formato direttamente dalla reazione tra acido cloridrico e ammoniaca.
Inoltre, esiste un terzo processo noto come reazione di coppie reciproche di sali, che è ancora di interesse dal punto di vista scientifico, ma non è stato ancora applicato commercialmente per la produzione di cloruro di ammonio.
2.1. Produzione di cloruro di ammonio mediante processo Solvay modificato (ammoniaca – carbonato di sodio)
Nel processo Solvay, la produzione di cloruro di ammonio e carbonato di sodio viene ottenuta tramite una serie di reazioni. L’ammoniaca e l’anidride carbonica vengono disciolte in una soluzione acquosa di cloruro di sodio, con conseguente formazione di bicarbonato di sodio scarsamente solubile.
Questo bicarbonato di sodio viene quindi riscaldato (calcinato) per produrre carbonato di sodio. L’ammoniaca viene recuperata dal liquido rimanente (liquore madre) facendola reagire con la calce, che genera anche cloruro di calcio.
Le fonti primarie di calce e anidride carbonica sono il calcare. La reazione complessiva comporta la conversione di salgemma e calcare in carbonato di sodio e cloruro di calcio come sottoprodotti.
Per compensare le perdite dell’impianto, vengono aggiunte solo le quantità necessarie di acqua, anidride carbonica e ammoniaca. La scelta della materia prima e dei prodotti risultanti determinano la posizione di un impianto Solvay, rendendo questi impianti unità ampiamente indipendenti.
Il processo Solvay modificato, noto come processo cloruro di ammonio – carbonato di sodio, è un primo esempio di produzione industriale integrata che coinvolge due sostanze. In questo processo modificato, il cloruro di ammonio viene ulteriormente precipitato dal liquore madre. La reazione complessiva per questo processo è:
2 NH3 + CO2 + H2O + 2 NaCl → 2 NH4Cl + Na2CO3
Le quantità di cloruro di ammonio e carbonato di sodio prodotte sono quasi uguali: vengono generate due moli (107 g) di NH4Cl per ogni mole (106 g) di Na2CO3. Il processo modificato necessita di NH3 e CO2 esterne e deve essere integrato in un sistema di impianti interconnessi.
Inoltre, il trattamento dei gas di scarico contenenti ammoniaca viene effettuato per scopi ambientali, piuttosto che semplicemente per ridurre le perdite di NH3 e CO2. Il bilancio energetico nel processo modificato differisce significativamente da quello del processo Solvay tradizionale a causa delle diverse materie prime e dei prodotti coinvolti.
2.1.1. Descrizione del processo
Nel processo di produzione di NH4Cl e Na2CO3, viene utilizzato un processo di riciclo a funzionamento continuo, con le concentrazioni regolate in base al fatto che il prodotto primario sia cloruro di ammonio o carbonato di sodio. Inizialmente sviluppato da BASF, questo processo si concentra su NH4Cl come prodotto primario (Figura 1).
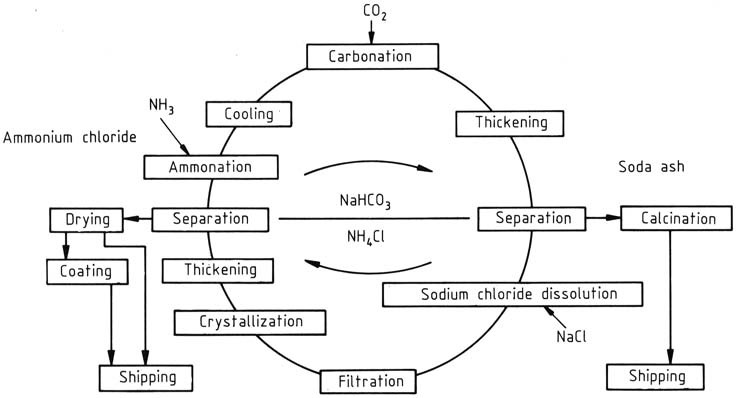
Il ciclo inizia con l’aggiunta di ammoniaca e anidride carbonica a una soluzione di riciclo acquosa. Il bicarbonato di ammonio formato reagisce ulteriormente con il cloruro di sodio nella soluzione, portando alla generazione di cloruro di ammonio e bicarbonato di sodio scarsamente solubile. Quest’ultimo viene separato e lavato utilizzando una centrifuga e successivamente calcinato per produrre carbonato di sodio.
Riscaldando il bicarbonato di sodio rimanente nel liquido madre a 337,2 K lo si decompone. Il carbonato di sodio altamente solubile non interferisce con la cristallizzazione del cloruro di ammonio.
L’alta temperatura della soluzione viene utilizzata per sciogliere rapidamente la materia prima di salgemma, introdotta tramite vasche di miscelazione, con la quantità regolata in base al bilancio dei materiali durante l’intero ciclo.
Le impurità insolubili, come solfati, ferro, calcio e sali di magnesio, vengono filtrate. Lo smaltimento dei residui, una preoccupazione crescente, viene affrontato utilizzando sale più puro come materia prima al posto del salgemma.
Il cloruro di ammonio viene recuperato mediante cristallizzazione in due fasi utilizzando raffreddamento indiretto. La sospensione risultante dal cristallizzatore viene addensata in idrocicloni e il solido viene separato e lavato in una centrifuga.
Il solido con circa il 5-7% in peso di contenuto d’acqua viene quindi essiccato in un essiccatore a corrente per ridurre il contenuto di umidità a meno dello 0,1%. Il prodotto finale può ricevere un rivestimento con agente antiagglomerante. Dopo la rimozione del cloruro di ammonio, il ciclo è completato e il liquido madre può essere riutilizzato.
Asahi Glass ha sviluppato un processo alternativo che produce carbonato di sodio come prodotto primario. In questo processo, l’ammoniaca viene aggiunta al liquido madre prima della cristallizzazione del cloruro di ammonio. Il sale grezzo frantumato può essere aggiunto con o senza lavaggio e viene disciolto nella soluzione.
Il raffreddamento della soluzione al di sotto dei 20 °C provoca la cristallizzazione del cloruro di ammonio. I cristalli vengono separati utilizzando un separatore centrifugo e il liquido madre viene riciclato nella sezione di carbonatazione. I cristalli di cloruro di ammonio vengono essiccati per ridurre il contenuto di umidità a meno dello 0,3% in un essiccatore a letto rotativo o fluido. La dimensione dei cristalli può essere controllata per varie applicazioni.
Nella sezione di carbonatazione, la soluzione viene fatta passare in una torre di carbonatazione, dove il bicarbonato di sodio precipita per reazione con l’anidride carbonica a 30-40 °C.
La sospensione risultante viene separata in cristalli di bicarbonato di sodio e liquore madre. Il liquore madre viene indirizzato alla sezione di assorbimento dell’ammoniaca. I cristalli separati vengono calcinati e trasformati in soda densa.
Il processo Asahi Glass include tutti i passaggi del processo BASF mostrati nella Figura 1 con una sequenza diversa. L’ammoniaca viene aggiunta dopo la separazione del bicarbonato di sodio. Il calore rilasciato durante l’aggiunta di ammoniaca fornisce l’energia necessaria per decomporre il bicarbonato di sodio rimanente.
Mentre si osservano risparmi energetici grazie a questo approccio, la maggiore richiesta di energia nella fase di cristallizzazione compensa alcuni dei vantaggi, poiché il cloruro di ammonio è più solubile in soluzioni ricche di ammoniaca.
Il processo può includere una fase di lavaggio per l’alimentazione di salgemma prima della soluzione per eliminare la necessità di filtrazione prima della cristallizzazione. Con o senza lavaggio, questo processo massimizza l’utilizzo del sale grezzo, un aspetto importante in Giappone, dove il sale deve essere importato.
2.1.2. Problemi di inquinamento
I problemi di inquinamento correlati al funzionamento degli impianti non sono gravi e possono essere gestiti efficacemente con un’attenta gestione. Con misure appropriate, la produzione di flussi di acque reflue può essere notevolmente ridotta, se non completamente eliminata. Tuttavia, qualsiasi acqua reflua prodotta a causa del suo elevato contenuto di ammoniaca richiederà un trattamento appropriato.
Per affrontare le emissioni gassose, una soluzione pratica prevede lo scrubbing dei gas di scarico con acido cloridrico, con conseguente produzione di ulteriore cloruro di ammonio.
In genere, si ottengono elevate conversioni di ammoniaca di circa il 98% e conversioni di salgemma di circa il 95%, sebbene i valori esatti possano variare a seconda del tipo di processo specifico e delle misure ambientali implementate. Questo approccio aiuta a ridurre al minimo le emissioni gassose e contribuisce alla sostenibilità ambientale complessiva del processo di produzione.
2.1.3. Gradi e capacità
A partire dal 1997, dopo la chiusura di diversi impianti di produzione a causa della ridotta domanda di mercato, la capacità stimata per la produzione di NH4Cl mediante il processo Solvay modificato nell’emisfero occidentale e in Giappone era di circa 100.000 tonnellate all’anno.
In Asia, la produzione di un prodotto granulare con oltre il 97% di contenuto di NH4Cl è comune. Questo NH4Cl di grado fertilizzante contiene in genere più del 25% in peso di azoto ammoniacale. Questi impianti si concentrano principalmente sulla produzione di carbonato di sodio, con NH4Cl come sottoprodotto.
Tuttavia, se l’interesse primario è nella produzione di NH4Cl, il processo può essere personalizzato per ottenere purezze più elevate. È possibile ottenere livelli di purezza superiori al 99,7% in peso di NH4Cl, con meno dello 0,25% in peso di NaCl e meno di 3 ppm di Fe, il che è adatto per la maggior parte degli scopi industriali.
Per applicazioni speciali che richiedono NH4Cl di grado reagente, è possibile una produzione su larga scala utilizzando tecniche operative specifiche senza la necessità di ulteriori fasi di lavorazione.
È possibile ottenere cloruro di ammonio di grado reagente con meno dello 0,01% in peso di NaCl e conforme alle specifiche ACS (American Chemical Society). Questo NH4Cl di purezza più elevata è adatto per applicazioni che richiedono qualità e precisione eccezionali nei processi chimici.
2.2. Produzione di cloruro di ammonio mediante reazione diretta tra HCl e NH3
La sintesi di NH4Cl da HCl e NH3 può essere economicamente vantaggiosa, in particolare quando l’HCl è disponibile come materia prima a basso costo o a costo zero.
Il processo Engeclor, sviluppato dalla società brasiliana Engeclor, esegue la reazione in una soluzione acquosa. L’ammoniaca viene introdotta nella sezione conica di un saturatore, mentre l’HCl, diluito con aria, viene fatto passare nella sospensione di NH4Cl.
La reazione avviene a 353 K a pressione ridotta, con un eccesso di NH3 per mantenere un pH di 8. La sospensione risultante viene estratta dalla base del saturatore, addensata utilizzando idrocicloni e NH4Cl viene separato dalla miscela in una centrifuga e quindi essiccato.
Il liquore madre viene riciclato al saturatore. Per controllare le emissioni, i gas di scarico del saturatore vengono lavati con acqua.
Sono stati proposti schemi alternativi in cui le materie prime gassose vengono introdotte in solventi non acquosi. In questi casi, il calore di reazione (-176 kJ/mol) viene rimosso evaporando i solventi, che vengono poi condensati.
Sono stati descritti anche alcuni processi a letto fluidizzato per questo scopo. Per prevenire la formazione di aerosol, si suggerisce l’anidride carbonica come gas vettore nei letti fluidizzati.
La produzione annuale globale stimata di NH4Cl mediante il processo HCl-NH3 era di 50.000 tonnellate nel 1997. Il cloruro di ammonio prodotto utilizzando questo metodo contiene meno dello 0,1% in peso di NaCl.
Il contenuto di metallo, in particolare il contenuto di metalli pesanti, può variare a seconda dell’impianto specifico. In genere, i livelli di metallo in NH4Cl prodotti da questo processo sono più alti di quelli nel processo Solvay modificato.
2.3. Reazione di coppie reciproche di sali
La reazione di coppie reciproche di sali rimane un metodo di interesse. Alcune coppie di sali adatte includono (NH4)2SO4 – KCl, che porta alla formazione di NH4Cl – K2SO4 e (NH4)2SO4 – NaCl, che porta alla produzione di NH4Cl – Na2SO4.
La sfida con queste coppie di sali è la minore purezza di NH4Cl dovuta al contenuto relativamente elevato di solfati. NH4Cl e KNO3 possono essere ottenuti dalla reazione di NH4NO3 e KCl. KNO3 ad alta purezza può essere utilizzato nella produzione di esplosivi, mentre NH4Cl con una purezza minima del 96% è adatto come fertilizzante.
Inoltre, la preparazione di NaNO3 e NH4Cl da NaCl e NH4NO3 è stata oggetto di indagine. Questo processo esplora la possibilità di ottenere questi due sali dai rispettivi sali precursori.
3. Usi del cloruro di ammonio
Il cloruro di ammonio trova ampie applicazioni agricole e industriali:
3.1. Uso agricolo
In Giappone, Cina e nel sud-est asiatico, il cloruro di ammonio è ampiamente utilizzato come fertilizzante azotato altamente efficace per riso e riso di pianura, grano e varie altre colture.
In Giappone, una parte significativa della produzione annuale di NH4Cl viene utilizzata per fertilizzanti composti di alta qualità, come cloro-ammonio fosfato, cloro-potassio-ammonio fosfato, magnesia-cloro-potassio-ammonio fosfato e miscele di azoto-potassio. Tuttavia, il suo utilizzo come fertilizzante è limitato a causa della sua acidità e dell’elevato contenuto di cloro.
3.2. Uso industriale
Il cloruro di ammonio di grado tecnico è impiegato in varie applicazioni industriali:
- Elettroliti solidi: è un componente essenziale nelle batterie a secco.
- Esplosivi per cave: una forma fine di cloruro di ammonio è utilizzata come componente negli esplosivi per scopi di cava.
- Indurenti per adesivi: agisce come agente indurente negli adesivi a base di formaldeide.
- Soluzioni di incisione: il cloruro di ammonio, insieme ad altre sostanze chimiche, è utilizzato nella produzione di circuiti stampati.
- Flussi nella placcatura: è un componente, insieme al cloruro di zinco, nei flussi utilizzati per la placcatura di stagno e zinco.
- Fotografia: funge da additivo di fissaggio rapido nella fotografia.
- Additivi per la pulizia: il cloruro di ammonio è utilizzato come additivo nei prodotti per la pulizia.
- Nutriente nelle colture di lievito: viene utilizzato come nutriente nelle colture di lievito per varie applicazioni.
- Concia: nell’industria conciaria, il cloruro di ammonio trova applicazioni.
- Raffinazione di metalli preziosi: viene utilizzato nel processo di raffinazione di metalli preziosi.
- Stampa e tintura tessile: il cloruro di ammonio viene utilizzato nella stampa e tintura tessile.
- Industria della gomma: trova applicazioni nell’industria della gomma.
- Piastrelle e mattoni: il cloruro di ammonio può essere aggiunto a piastrelle e mattoni prima della cottura per controllare la porosità e accelerare il processo di cottura.
3.3. Applicazioni ad alta purezza
Il cloruro di ammonio ad alta purezza viene impiegato nell’industria alimentare e farmaceutica, nonché in specifiche sintesi chimiche.
Vale la pena notare che l’uso di NH4Cl come indurente per adesivi a base di formaldeide è diminuito in modo significativo a causa della sua sostituzione con prodotti privi di cloruro.
Riferimenti
- Composti di ammonio; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Processo di produzione di cloruro di ammonio. – https://patents.google.com/patent/US2133513A/en
