Cicloesanolo: proprietà, reazioni, produzione e usi
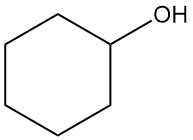
Cos’è il cicloesanolo?
Il cicloesanolo è un composto organico con formula chimica C6H12O. È un liquido incolore e viscoso o un solido cristallino con un odore simile alla canfora, molto solubile nella maggior parte dei solventi organici.
Il cicloesanolo è un importante prodotto chimico prodotto su larga scala commerciale.
Sommario
1. Proprietà fisiche del cicloesanolo
Il cicloesanolo è una sostanza incolore che forma aghi cristallini igroscopici con un odore simile alla canfora. Allo stato puro, fonde a temperatura ambiente a 25,15 °C.
Il cicloesanolo è molto solubile nella maggior parte dei solventi organici, come alcoli, chetoni, eteri e idrocarburi aliciclici e aromatici. Scioglie molti oli, cere, gomme e resine e forma azeotropi con acqua e fenolo.
Le proprietà fisiche più importanti del cicloesanolo sono riportate nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero CAS | [108-93-0] |
| Formula chimica | C6H11OH |
| Massa molecolare | 100,16 g/mol |
| Punto di fusione | 25,15 °C |
| Punto di ebollizione | 161,1 °C |
| Pressione di vapore | 0,15 kPa a 20 °C 0,48 kPa a 35 °C |
| Densità | 0,9493 g/cm3 |
| Indice di rifrazione | 1,4656 |
| Coefficiente di dilatazione | 8,25 × 10-4 |
| Viscosità dinamica | 41,07 mPa · s a 30 °C 17,20 mPa · s a 45 °C |
| Calore specifico | 1,747 J/g |
| Tensione superficiale a 30 °C | 33,47 mN/m |
| Calore di fusione | 1,791 kJ/mol |
| Calore di combustione | -3,722 MJ/mol |
| Calore di vaporizzazione | 45,51 kJ/mol |
| Calore di formazione | -352 kJ/mol |
| Punto di infiammabilità | 68 °C |
| Temperatura di autoaccensione | 300 °C |
| Solubilità in acqua a 20 °C | 3,6 g/100 g di acqua |
2. Reazioni chimiche del cicloesanolo
Il cicloesanolo subisce la maggior parte delle reazioni tipiche degli alcoli secondari. Forma esteri con acidi organici e alogenuri cicloesilici con acidi alogenidrici. Gli esteri commerciali più importanti del cicloesanolo sono il dicicloesilftalato, l’adipato di dicicloesile e l’acrilato di cicloesile.
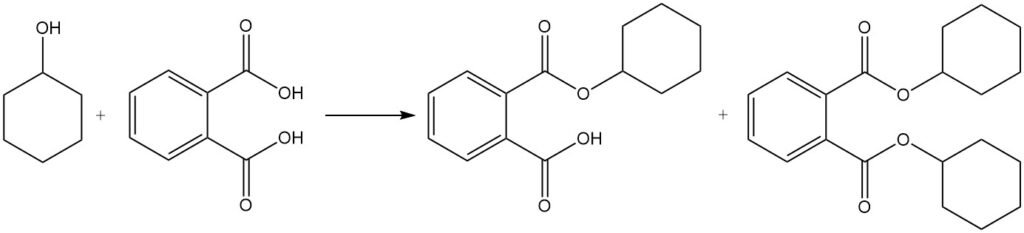
La reazione del cicloesanolo con l’acido ftalico produce ftalati di cicloesile e dicicloesile, utilizzati come plastificanti.
La disidratazione del cicloesanolo con acido solforico o il trattamento in fase vapore con allumina a 300–400 °C produce cicloesene.
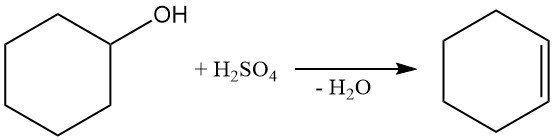
Il cicloesanolo reagisce con bromuro di sodio e acido solforico per produrre bromocicloesano con una resa > 50%.
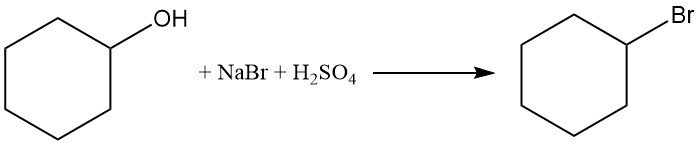
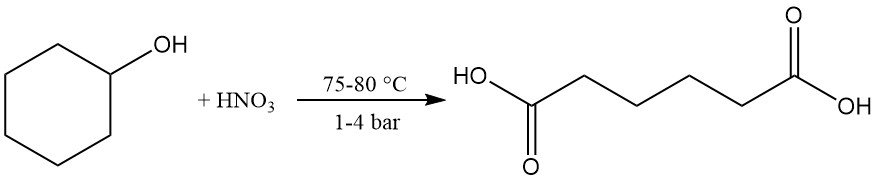
L’ossidazione lieve o la deidrogenazione catalitica produce cicloesanone, che può essere ulteriormente ossidato ad acido adipico utilizzando acido nitrico a 75–80 °C e 1–4 bar. Questa reazione è importante a livello industriale.
La reazione del cicloesanolo con l’ammoniaca produce cicloesilammina.
3. Produzione industriale del cicloesanolo
Il cicloesanolo veniva prodotto industrialmente per idrogenazione del fenolo, che forma anche cicloesanone. Negli anni ’40, fu sviluppata l’ossidazione in fase liquida del cicloesano con aria catalizzata da metalli di transizione per sintetizzare una miscela cicloesanolo-cicloesanone. La scelta del catalizzatore influenzava il rapporto di produzione.
Negli anni ’50, la Scientific Design produsse il cicloesanolo in modo selettivo mediante ossidazione in fase liquida modificata con acido borico del cicloesano, passando per un intermedio cicloesilidroperossido. Intorno al 1990, la Asahi produsse il cicloesanolo dal cicloesene, ottenuto dall’idrogenazione parziale del benzene.
3.1. Produzione di cicloesanolo mediante idrogenazione del fenolo
La scelta dei catalizzatori metallici nell’idrogenazione del fenolo determina la distribuzione del prodotto, cicloesanolo, cicloesanone o una loro miscela.
Il cicloesanolo può essere prodotto con rese elevate mediante idrogenazione del fenolo sia in fase vapore che in fase liquida.
Il cicloesanolo viene prodotto con una resa del 98% mediante idrogenazione del fenolo in fase vapore utilizzando catalizzatori a base di nichel, spesso supportati su allumina o silice.
Un diagramma di flusso dell’idrogenazione del fenolo in fase vapore è mostrato in Figura 1.
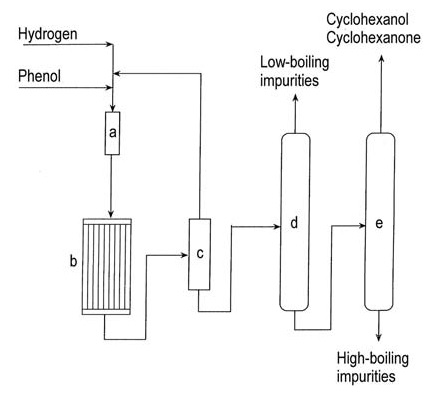
a) Evaporatore del fenolo; b) Reattore di idrogenazione; c) Condensatore; d) Colonna di rimozione a bassa temperatura; e) Colonna di recupero cicloesanolo/cicloesanone
L’idrogenazione commerciale in fase liquida del fenolo in condizioni blande con un catalizzatore al nichel Raney raggiunge una selettività del 99,9% per il cicloesanolo.
3.2. Produzione di cicloesanolo mediante ossidazione in fase liquida del cicloesano
L’ossidazione in fase liquida del cicloesano con aria a cicloesanolo e cicloesanone è emersa negli anni ’40. Questo processo viene condotto in reattori agitati a 140-180 °C e 0,8-2 MPa e utilizza catalisi al cobalto o condizioni non catalizzate.
Il cicloesilidroperossido è un intermedio che si forma durante la reazione e viene successivamente convertito in cicloesanolo e cicloesanone.
La scelta del catalizzatore influenza il rapporto cicloesanolo/cicloesanone, con catalizzatori al cobalto che producono un rapporto cicloesanolo/cicloesanone pari a 3,5. Vari composti ossigenati vengono prodotti come sottoprodotti.
La resa in cicloesanolo può essere migliorata mantenendo elevati livelli di idroperossido nell’effluente dell’ossidante.
I metodi e le condizioni utilizzati per decomporre gli intermedi idroperossidici influenzano il rapporto cicloesanolo/cicloesanone ottenuto (vedi Tabella 2).
| Soluzione/Modifica | Catalizzatore | Temperatura (°C) | Rapporto (Cicloesanolo: Cicloesanone) |
|---|---|---|---|
| A | nessuno | 155 | 0,8 |
| A | Cr | 155 | 0,4 |
| A | Ni | 155 | 1,4 |
| A | V | 155 | 1,4 |
| A | Co | 155 | 3,0 |
| A | Mn | 155 | 3,3 |
| B | Co | 160 | 2,5 |
| A - idrogenazione del cicloesilidroperossido | Pd | 150 | 5 - 10 |
| A - fase acquosa caustica separata | Co | 120 | 0,2 |
* A = cicloesilidroperossido in cicloesano; B = cicloesilidroperossido nelle code dell'ossidante ad aria.
3.3. Produzione di cicloesanolo mediante ossidazione del cicloesano modificata con acido borico
Negli anni ’50, Scientific Design modificò il processo di ossidazione del cicloesano in aria aggiungendo acido metaborico anidro al primo reattore di ossidazione (Figura 2). Il cicloesilidroperossido viene intrappolato come estere di perborato di cicloesile e quindi reagisce con il cicloesano per formare estere borato e cicloesanolo.
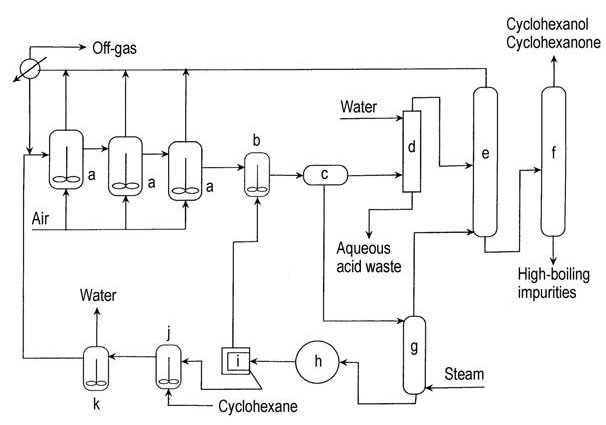
a) Ossidatori ad aria; b) Recipiente di idrolisi dell'estere; c) Decanter; d) Colonna di estrazione; e) Colonna di recupero del cicloesano; f) Colonna di raffinazione; g) Colonna di stripping; h) Cristallizzatore sotto vuoto; i) Centrifuga per acido borico; j) Serbatoio di sospensione per acido borico; k) Essiccatore
Questo estere stabile resiste alla sovraossidazione e viene successivamente idrolizzato a cicloesanolo e acido borico. L’acido borico viene disidratato ad acido metaborico, che viene riciclato nell’ossidatore dell’aria.
La chimica del processo è simile all’ossidazione catalizzata da metallo del cicloesano, ma l’anello cicloesilico è protetto dall’ossidazione.
Nonostante i maggiori costi di investimento e operativi rispetto ad altri metodi, il processo con acido borico consente rese più elevate di cicloesanolo e cicloesanone, fino all’88%, con un’elevata selettività del cicloesanolo del 91%. L’Institut Français du Petrole ha ulteriormente sviluppato questa tecnologia.
I principali produttori che attualmente utilizzano questo processo sono Solutia, DuPont (Regno Unito), Bayer e Mitsubishi. L’impianto originale di Rhône-Poulenc basato su questa tecnologia è ora chiuso.
3.4. Produzione di cicloesanolo mediante idratazione del cicloesene
Nel 1972, l’idrogenazione selettiva del benzene a cicloesene fu brevettata per la prima volta. Successivamente, seguirono brevetti per l’idratazione del cicloesene a cicloesanolo utilizzando diversi catalizzatori.
Asahi commercializzò questo processo nel 1990 con un impianto da 100 t/a. Il processo comprende tre fasi: idrogenazione selettiva del benzene, separazione del cicloesene dal benzene non convertito e dal cicloesano, e idratazione del cicloesene (Figura 3).
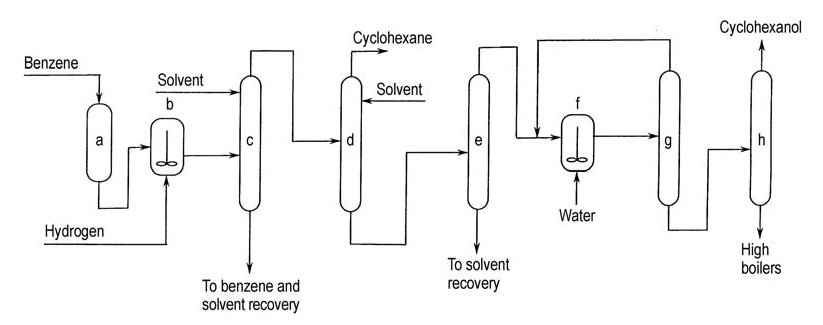
a) Purificazione del benzene; b) Idrogenazione parziale; c) Separazione del benzene non convertito da cicloesene e cicloesano; d) Separazione del cicloesene da cicloesano; e) Separazione del cicloesene dal solvente estrattivo; f) Idratazione del cicloesene; g) Riciclo del cicloesene non convertito; h) Purificazione del cicloesanolo
L’idrogenazione del benzene utilizza un catalizzatore eterogeneo specializzato al nichel e opera a circa il 50% di conversione, producendo una miscela composta per circa il 35% da cicloesene, il 15% da cicloesano e il 50% da benzene non convertito.
Impurità come zolfo e ferro influiscono significativamente sulla selettività, motivo per cui è necessario utilizzare benzene purificato e rivestire il recipiente di idrogenazione con un materiale inerte.
La miscela cicloesano-cicloesene-benzene subisce due successive distillazioni estrattive. Il cicloesano recuperato può essere riconvertito in benzene o venduto ad altri produttori di caprolattame e acido adipico.
Anche l’idratazione del cicloesene a cicloesanolo impiega un catalizzatore eterogeneo in un reattore a sospensione. L’equilibrio limita la conversione a circa il 14%.
La resa da benzene a cicloesanolo è eccezionalmente elevata, probabilmente superiore al 95%. Sebbene i sottoprodotti siano minimi, l’investimento richiesto è superiore a quello degli impianti di ossidazione del cicloesano convenzionali.
4. Usi del cicloesanolo
Il cicloesanolo è utilizzato industrialmente nella produzione principalmente di acido adipico, utilizzato nella produzione di nylon-6,6 e cicloesanone, un precursore del caprolattame.
Nel 1992, il mercato statunitense del cicloesanolo (esclusi gli intermedi del nylon) ha raggiunto le 10.000 tonnellate.
Le principali applicazioni del cicloesanolo sono:
- Come solvente per lacche, vernici, oli, resine alchidiche, gomme, gommalacca, etilcellulosa, coloranti acidi e resine naturali.
- Nella preparazione di esteri per plastificanti, ad esempio il dicicloesilftalato.
- Nell’industria del bucato e in saponi e detergenti sintetici, come omogeneizzante e stabilizzante.
- Nei prodotti per la rimozione di vernici e vernici.
- Nella produzione di cicloesilammina, un inibitore di corrosione.
- Nell’industria degli insetticidi, dei profumi, dei lucidanti e del mastice.
- Nell’industria tessile come solvente per tinture e coadiuvante nell’ebollizione in autoclave.
5. Tossicologia del cicloesanolo
Il cicloesanolo presenta una bassa tossicità orale e una lieve irritazione cutanea. L’esposizione oculare induce grave irritazione e danni corneali transitori. L’inalazione di elevate concentrazioni di vapore (circa 1000 ppm) nei conigli provoca irritazione congiuntivale e respiratoria, letargia, incoordinazione, narcosi e lievi convulsioni.
Studi sulla tossicità riproduttiva nei topi indicano un aumento della mortalità della prole a seguito del consumo materno di cicloesanolo durante la gestazione. Atrofia testicolare con perdita di cellule spermatogeniche è stata segnalata in ratti e gerbilli dopo ripetute somministrazioni sottocutanee.
Effetti simili si sono verificati nei conigli a seguito di esposizione orale. Tuttavia, uno studio non è riuscito a dimostrare atrofia testicolare nei ratti nonostante la somministrazione orale di dosi elevate.
L’ACGIH ha stabilito un TLV-TWA di 50 ppm (circa 200 mg/m³) con una notazione cutanea.
La corretta manipolazione del cicloesanolo richiede un’adeguata ventilazione, evitare l’esposizione prolungata, prevenire l’ingestione e proteggere gli occhi.
Riferimenti
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://www.sciencedirect.com/science/article/abs/pii/B9780323851596501093
- https://onlinelibrary.wiley.com/doi/abs/10.1002/recl.19630820107
- https://onlinelibrary.wiley.com/doi/10.1002/0471740039.vec0746
- https://www.sciencedirect.com/science/article/abs/pii/S1460156705800200
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanol
