Butirrolattone: proprietà, produzione e usi
Cos’è il γ-butirrolattone?
Il γ-butirrolattone (CAS 96-48-0), noto anche come lattone dell’acido γ-idrossibutirrico, è un composto organico semplice con formula C4H6O2. È un liquido igroscopico e incolore con un leggero odore, che a prima vista potrebbe sembrare insignificante.
La sua produzione industriale è iniziata negli anni ’40 come risultato del lavoro di Reppe e colleghi della BASF. Il processo Reppe rimane il metodo dominante per la sintesi su larga scala del γ-butirrolattone.
Sommario
1. Proprietà fisiche del butirrolattone
Il γ-butirrolattone esiste come un liquido incolore, leggermente igroscopico, con un leggero odore. È miscibile con acqua, alcoli, esteri, eteri, chetoni e idrocarburi aromatici. Sebbene abbia una miscibilità limitata con idrocarburi alifatici lineari e ciclici, è utilizzato come solvente per numerosi polimeri e idrocarburi inferiori.
Alcune proprietà fisiche del γ-butirrolattone sono elencate nella tabella seguente:
| Proprietà | Valore |
|---|---|
| Massa molare | 86,09 g/mol |
| Punto di fusione | -43,5 °C |
| Punto di ebollizione | 204-206 °C (a 101,3 kPa) |
| Densità (0 °C) | 1,15 g/cm³ |
| Densità (20 °C) | 1,13 g/cm³ |
| Densità (40 °C) | 1,11 g/cm³ |
| Temperatura critica | 436,5 °C |
| Pressione critica | 3,35 MPa |
| Pressione di vapore (20 °C) | 0,04 kPa |
| Pressione di vapore (50 °C) | 0,3 kPa |
| Pressione di vapore (100 °C) | 3,6 kPa |
| Pressione di vapore (150 °C) | 22,5 kPa |
| Pressione di vapore (205 °C) | 101,3 kPa |
| Calore di vaporizzazione (206 °C) | 535 kJ/kg |
| Calore di soluzione in acqua | 2500 J/mol |
| Capacità termica specifica (cp) - Liquido (25 °C) | 1680 J kg⁻¹ K⁻¹ |
| Capacità termica specifica (cp) - Liquido (100 °C) | 1850 J kg⁻¹ K⁻¹ |
| Capacità termica specifica (cp) - Liquido (200 °C) | 2200 J kg⁻¹ K⁻¹ |
| Capacità termica specifica (cp) - Gas (100 °C) | 1275 J kg⁻¹ K⁻¹ |
| Capacità termica specifica (cp) - Gas (200 °C) | 1575 J kg⁻¹ K⁻¹ |
| Capacità termica specifica (cp) - Gas (300 °C) | 1820 J kg⁻¹ K⁻¹ |
| Punto di infiammabilità | 100-101 °C |
| Temperatura di accensione | 455 °C |
| Calore di combustione | 234 kJ/g |
| Limiti di esplosione - Inferiori | 2,7 vol% |
| Limiti di esplosione - superiori | 15,6 vol% |
| Indice di rifrazione (20 °C) | 1,4352 |
| Viscosità (20 °C) | 1,90 mPa s |
| Viscosità (50 °C) | 1,25 mPa s |
| Viscosità (80 °C) | 0,86 mPa s |
| Viscosità (110 °C) | 0,63 mPa s |
| Viscosità (140°C) | 0,49 mPa s |
| Viscosità (170 °C) | 0,40 mPa s |
| Tensione superficiale (20 °C) | 44,6 x 10-5 N/cm |
| Costante dielettrica (20 °C) | 39,1 |
| Conduttività termica (25-65 °C) | 0,276 J m⁻¹ s⁻¹ K⁻¹ |
| Conduttività | 0,7 μS/cm |
2. Proprietà chimiche del butirrolattone
In una soluzione acquosa, l’isomerizzazione tra la forma lattone e la forma libera di acido idrossibutirrico è un equilibrio dipendente dalla temperatura. A 0 °C, la forma lattone predomina completamente, mentre a 100 °C, circa l’80% esiste come lattone.
Condizioni fortemente alcaline (un equivalente molare di alcali) spostano l’equilibrio interamente verso la forma di acido idrossibutirrico. Questa proprietà consente la determinazione titrimetrica del butirrolattone. A un pH neutro (7), il butirrolattone è molto stabile.
Il butirrolattone subisce reazioni di scissione dell’anello con vari reagenti, producendo derivati dell’acido γ-idrossibutirrico. Esempi includono reazioni con basi, alogenuri di idrogeno e alcoli (in condizioni acide).
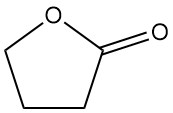
Subisce anche reazioni in posizione α senza scissione dell’anello. Tra queste rientrano reazioni con ammoniaca, ammine, composti carbonilici e alogenazione. Ad esempio, la sua condensazione con acetato di etile forma α-acetobutyrolactone, un importante intermedio nella sintesi della vitamina B1.
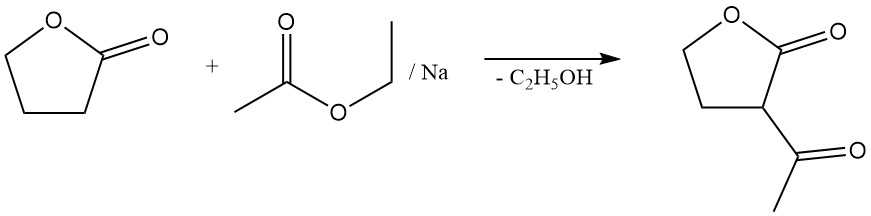
La reazione di scissione dell’anello lattonico consente la preparazione di preziosi derivati dell’acido butirrico γ-sostituiti. Ad esempio, la reazione con solfuro di sodio produce l’additivo per gomma acido tiodibutirrico,
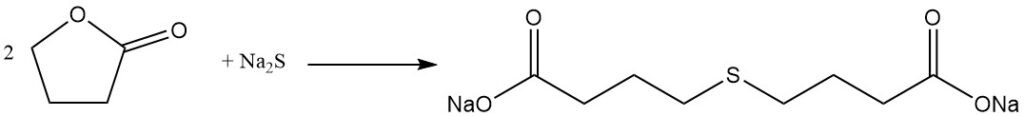
mentre la reazione con il fenolo produce acido fenossibutirrico.
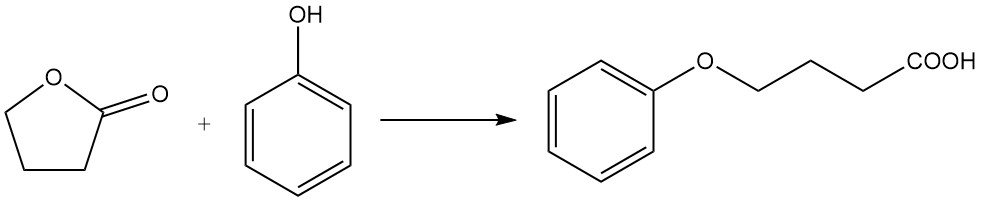
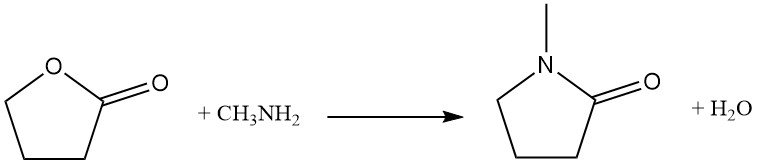
La sostituzione dell’atomo di ossigeno dell’anello con azoto è una reazione industriale utilizzata per la sintesi di derivati pirrolidonici. Ad esempio, il butirrolattone reagisce con la metilammina per produrre N-metilpirrolidone (NMP), un solvente industriale chiave.
L’omopolimerizzazione diretta del butirrolattone richiede un’elevata pressione (2000 MPa), ma percorsi alternativi, come la fermentazione degli zuccheri, possono dare un prodotto simile.
3. Produzione del butirrolattone
3.1. Produzione del butirrolattone mediante deidrogenazione del 1,4-butandiolo
Il processo Reppe è il percorso industriale predominante per la sintesi del butirrolattone, ottenuto mediante la deidrogenazione endotermica in fase gassosa del 1,4-butandiolo. Questa reazione multi-step procede tramite intermedi γ-idrossibutirraldeide e 2-idrossitetraidrofurano.

I principali produttori che impiegano questo processo includono BASF, Ashland e Lyondell.
Il vapore di 1,4-butandiolo preriscaldato viene combinato con un flusso di idrogeno caldo in circolazione e fatto passare su un letto di catalizzatore di rame a pressione atmosferica e temperature che vanno da 180 a 300 °C (Figura 1). Questa reazione fornisce un’elevata resa di circa il 95% di butirrolattone.
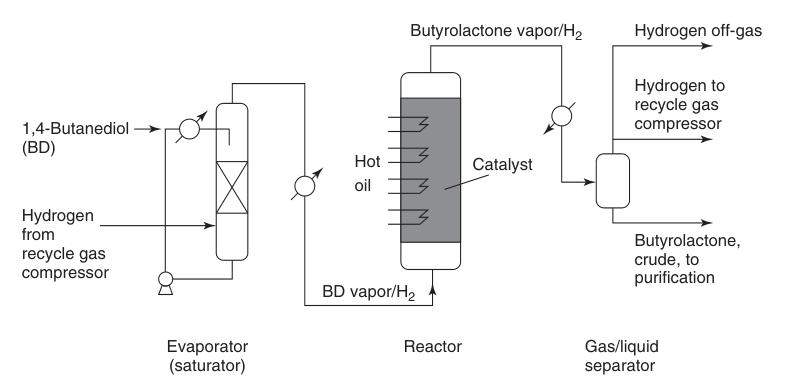
Il sottoprodotto di idrogeno generato richiede una purificazione minima per un potenziale riutilizzo, che in genere comporta la metanizzazione catalitica per rimuovere le impurità di monossido di carbonio.
Il butirrolattone grezzo che viene separato dal flusso di gas riciclato contiene piccole impurità come 1,4-butandiolo non reagito, acido butirrico e composti altobollenti. Questi vengono rimossi tramite distillazione per ottenere butirrolattone puro.
Il butirrolattone stesso non è corrosivo e compatibile con le apparecchiature in acciaio al carbonio. Tuttavia, i componenti esposti al prodotto grezzo caldo contenente acido butirrico, come parti dei recipienti di sintesi o distillazione e delle tubazioni, necessitano dell’uso di acciaio inossidabile per una maggiore durata.
3.2. Produzione di butirrolattone mediante idrogenazione di anidride maleica
Un percorso alternativo al butirrolattone prevede l’idrogenazione catalitica di anidride maleica. In questo processo, l’anidride maleica fusa preriscaldata viene introdotta in un flusso circolante di idrogeno sotto pressione (6-12 MPa) e temperatura (160-280 °C). Un catalizzatore a base di nichel promuove la reazione, che procede in modo esotermico con un ΔH di -211 kJ/mol:
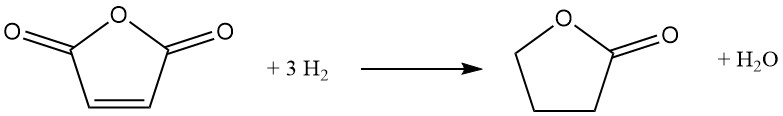
Il percorso di reazione coinvolge anidride succinica intermedia e, a seconda delle condizioni scelte, può essere ulteriormente indirizzato verso la produzione di tetraidrofurano. L’idrogenazione completa dell’anidride succinica, tuttavia, porta inevitabilmente alla co-formazione di tetraidrofurano.
L’idrogeno in eccesso viene riciclato dopo il lavaggio con acqua per rimuovere le impurità. I sottoprodotti formati durante la sintesi del butirrolattone, tra cui propanolo, butanolo, acido propionico e acido butirrico, vengono separati dal flusso di gas circolante. La distillazione successiva purifica il flusso di butirrolattone.
A causa della presenza di sottoprodotti acidi, sia l’attrezzatura di sintesi che quella di distillazione richiedono una struttura in acciaio inossidabile. Mitsubishi Chemical Corporation è un produttore che impiega questo metodo.
3.3. Produzione di butirrolattone mediante idrogenazione di esteri maleici
Emersi negli anni ’80, diversi processi che utilizzano il dimetil maleato come intermedio offrono percorsi alternativi al 1,4-butandiolo e al tetraidrofurano (THF). Questi metodi offrono anche l’opportunità di isolare il butirrolattone, un intermedio nella sequenza di reazione.
Un processo degno di nota, sviluppato da Kvaerner Process Technology (ora Johnson Matthey Davy Technologies), utilizza il dimetil maleato come prodotto iniziale ottenuto da anidride maleica e metanolo utilizzando un catalizzatore a scambio ionico fortemente acido.
La successiva idrogenazione in fase gassosa su un sistema catalizzatore a base di rame, a pressioni di 2-8 MPa e temperature di 150-250 °C, produce una miscela dei prodotti desiderati: 1,4-butandiolo, THF, butirrolattone, tracce di succinato di dimetile (intermedio) e n-butanolo come principale sottoprodotto.
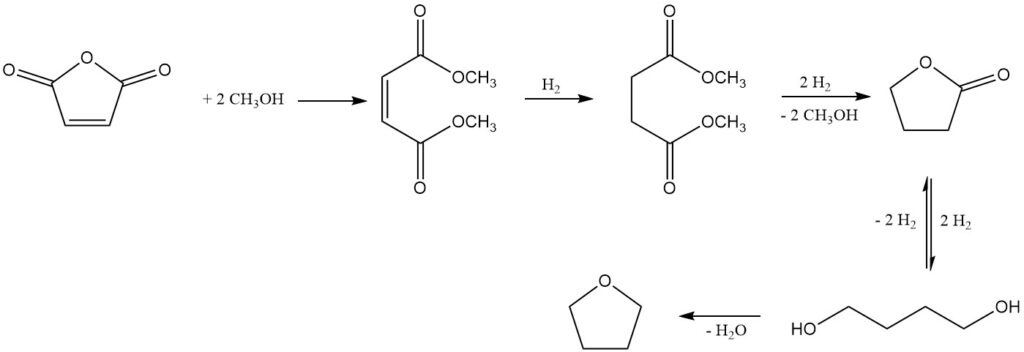
Butirrolattone e dimetil succinato formano una miscela azeotropica, che consente il loro recupero e riciclo nella fase di idrogenazione. Questa strategia di riciclo promuove la conversione completa verso 1,4-butandiolo e THF. In alternativa, l’azeotropo può essere raffinato tramite distillazione per isolare butirrolattone puro.
La resa di butirrolattone è direttamente influenzata dalla pressione e dalla temperatura di esercizio durante l’idrogenazione, che determinano l’equilibrio tra 1,4-butandiolo e butirrolattone. Nelle condizioni riportate, le rese possono variare dal 5% al 50%.
Questo processo innovativo ha riscosso un notevole interesse commerciale, con KPT e JM Davy che si sono assicurati le licenze per la costruzione di più impianti butandiolo-butandiolo-THF in Arabia Saudita, Malesia, Corea e Cina.
3.4. Produzione di butirrolattone mediante processo basato su biotecnologie
Metabolix (ora Yield10 Bioscience, Inc.) ha sviluppato un processo di fermentazione per produrre poli(4-idrossibutirrato) (polibutirrato) dagli zuccheri. Questo polimero può essere depolimerizzato in butirrolattone a temperature superiori a 200 °C, con idrossido di calcio che ottiene risultati ottimali. La biomassa rimanente viene convertita in combustibile solido. A partire dal 2019, non esiste alcun impianto commerciale che utilizzi questo metodo.
BioAmber ha proposto un percorso basato su biotecnologie in cui gli zuccheri vengono fermentati in sale di diammonio dell’acido succinico. La successiva rimozione dell’ammoniaca produce acido succinico, che può essere idrogenato in presenza di un catalizzatore di metallo prezioso per produrre butirrolattone, insieme a 1,4-butandiolo e tetraidrofurano. Questo processo non ha ancora raggiunto un’applicazione commerciale.
Sebbene non siano commercialmente significative, la ricerca ha esplorato vari percorsi alternativi per la sintesi del butirrolattone da tetraidrofurano, diidrofurano, acetilene, butynediolo, olefine, butadiene o mediante carbonilazione.
4. Utilizzi del butirrolattone
La versatilità del butirrolattone si estende ben oltre il suo ruolo di semplice intermedio chimico. Le sue applicazioni spaziano in diversi campi, dalle formulazioni farmaceutiche alla scienza dei polimeri e persino alle tecnologie emergenti nell’elettronica.
Il butirrolattone funge da elemento fondamentale per vari prodotti chimici, tra cui N-metilpirrolidone (NMP) e pirrolidone, entrambi con i loro usi significativi. Viene anche utilizzato nella sintesi di erbicidi fenossi come MCPB (acido γ-2-metil-4-clorofenossibutirrico) e regolatori della crescita.
È un intermedio nella produzione di α-acetobutirratolattone, un passaggio fondamentale nella sintesi della vitamina B1. Il butirrolattone viene anche utilizzato per la produzione di acido tiodibutirrico, un prezioso additivo nella produzione di gomma.
È un solvente che può dissolvere vari polimeri, facilitandone la lavorazione e la manipolazione. Inoltre, è un prezioso catalizzatore per specifiche reazioni di polimerizzazione.
Il butirrolattone contribuisce alla formulazione di composizioni per l’ondulazione dei capelli, lozioni solari, altri prodotti per la cura della persona e nei prodotti farmaceutici.
Altre applicazioni del butirrolattone includono: come solvente nell’inchiostro per stampa a getto d’inchiostro, come agente di estrazione nell’industria petrolifera, come stabilizzante per pesticidi a base di cloroidrocarburi e fosforo e come nematocida.
Le sue proprietà uniche lo rendono un promettente co-solvente per elettroliti di condensatori nell’industria elettronica e ha un potenziale utilizzo nei fotoresist.
5. Tossicologia e salute sul lavoro
Assorbimento e metabolismo:
- Il butirrolattone viene facilmente assorbito attraverso l’intestino e la pelle. La sua emivita orale nei ratti è di circa 20 minuti.
- Il metabolismo e l’escrezione sono rapidi, producendo principalmente acido γ-idrossibutirrico come metabolita principale.
- Negli esseri umani, gli studi segnalano (S)-3,4-diidrossibutirrato, acido glicolico e altri metaboliti nelle urine dopo l’ingestione.
Tossicità acuta:
- Il butirrolattone presenta una bassa tossicità acuta, con valori di LD50 compresi tra 800 e 1800 mg/kg nei roditori e 500-1700 mg/kg nelle cavie.
- La LD50 cutanea nelle cavie è di 5600 mg/kg.
- La LC50 inalatoria (ratto, 4 ore) supera la più alta concentrazione non letale testata (>5,1 mg/L).
- L’inalazione a saturazione a temperatura ambiente non mostra effetti avversi nei ratti [BASF, (1960) non pubblicato results].
Effetti neurologici:
- La depressione del sistema nervoso centrale (SNC) del butirrolattone avviene attraverso il suo metabolita, l’acido γ-idrossibutirrico, con ulteriori effetti anestetici sul sistema nervoso periferico.
- Dosi di 2500 mg in esseri umani adulti hanno indotto un sonno temporaneo.
- Dosi di 66 mg/kg in bambini per l’anestesia hanno provocato un sonno profondo con occasionale depressione respiratoria.
- Maggiore dosi orali negli adulti e nei neonati hanno causato perdita di coscienza indotta da depressione del sistema nervoso centrale, occasionalmente coma, bradicardia e depressione respiratoria. I pazienti si sono ripresi completamente entro 24 ore con cure di supporto.
Effetti locali e cutanei:
- Il butirrolattone non è irritante per la pelle ma moderatamente irritante per gli occhi nei conigli [BASF, (1960) risultati non pubblicati].
- Nessuna sensibilizzazione cutanea osservata nelle cavie.
- I patch test su 200 volontari non hanno rilevato reazioni cutanee.
- Lozioni contenenti il butirrolattone è ben tollerato per applicazione topica.
- È stato un analgesico topico efficace per dolori muscoloscheletrici, mal di testa ed emicranie.
Studi sulla cronicità e sulla cancerogenicità:
- La somministrazione orale prolungata di 3 g/kg al giorno per quattro settimane ha portato a depressione del SNC nei ratti ma non ad altri effetti significativi.
- Gli studi a dosi ripetute hanno mostrato una tossicità leggermente superiore rispetto alla somministrazione per via orale con possibili effetti di bolo.
- Numerosi studi sulla mutagenicità e genotossicità non indicano alcun potenziale genotossico.
- Gli studi sulla cancerogenicità a lungo termine nei ratti e nei topi ad alte dosi non hanno trovato prove di potenziale tumorigenico.
- Nemmeno i primi studi cutanei e orali hanno mostrato effetti cancerogeni.
- Nel complesso, le prove suggeriscono che non vi è alcun rischio cancerogeno significativo associato al butirrolattone.
Effetti sullo sviluppo e sulla riproduzione:
L’esposizione prenatale nei ratti e nei conigli per via orale e inalatoria non ha mostrato effetti sullo sviluppo correlati alla sostanza (BASF AG, (1993) risultati non pubblicati).
Esposizione professionale:
I limiti specifici di esposizione professionale al butirrolattone non sono stabiliti in Europa o negli Stati Uniti.
Impatto ambientale:
I dati sulla tossicità acuta e la rapida biodegradabilità suggeriscono un rischio ambientale minimo.
Riferimento
- Butyrolactone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_495.pub2
