Anidride maleica: proprietà, reazioni, produzione e usi
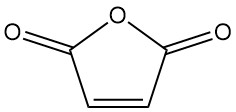
Cos’è l’anidride maleica?
L’anidride maleica, nota anche come 2,5-furandione, è un composto organico con formula C4H2O3. È un solido incolore o bianco dall’odore forte e irritante, che ha un’importanza industriale maggiore rispetto all’acido maleico.
Sommario
1. Proprietà fisiche dell’anidride maleica
L’anidride maleica forma cristalli aghiformi ortorombici. È solubile in acqua, acetone, etanolo, xilene, acetato di etile, cloroformio, benzene, toluene, tetraclorometano e molti altri solventi organici.
L’anidride maleica è igroscopica e infiammabile e può formare miscele esplosive con l’aria. Può sublimare. Il pH delle soluzioni acquose di anidride maleica è 2,42 a 1×10-2 M, 2,62 a 5×10-3 M e 3,10 a 1×10-4 M.
Le proprietà fisiche più importanti dell’anidride maleica sono riassunte nella tabella seguente.
| Proprietà | Valore |
|---|---|
| Numero CAS | 108-31-6 |
| Formula chimica | C4H2O3 |
| Massa molecolare | 98,06 g/mol |
| Punto di fusione | 52,85 °C |
| Punto di ebollizione (101,3 kPa) | 202,0 °C |
| Densità | 1,48 g/cm3 |
| Densità di vapore | 3,40 |
| Calore di combustione | -1391,2 kJ/mol |
| Calore specifico (liquido) | -1,67 kJ mol-1 K-1 |
| Calore di evaporazione | 54,8 kJ/mol |
| Calore di fusione | 13,66 kJ/mol |
| Punto di infiammabilità | 102 °C (vaso chiuso) 110 °C (vaso aperto) |
| Temperatura di autoaccensione | 477 °C |
2. Reazioni dell’anidride maleica
L’anidride maleica mostra un’elevata reattività dovuta alla presenza di un doppio legame e del suo gruppo anidride.
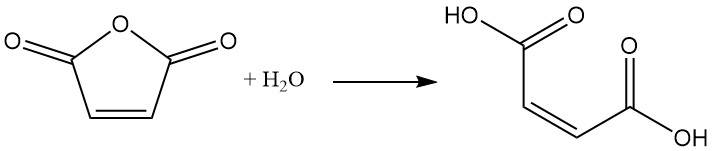
L’anidride maleica subisce facilmente idrolisi con acqua per formare acido maleico. Questa reazione è esotermica.
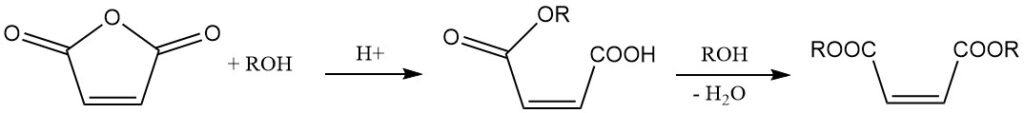
La reazione con alcoli in presenza di un catalizzatore porta alla formazione di esteri dell’acido maleico. La scelta del catalizzatore e la temperatura di reazione determinano il prodotto. A temperature più basse si formano semiesteri, mentre temperature più elevate favoriscono la formazione di diesteri con eliminazione dell’acqua.
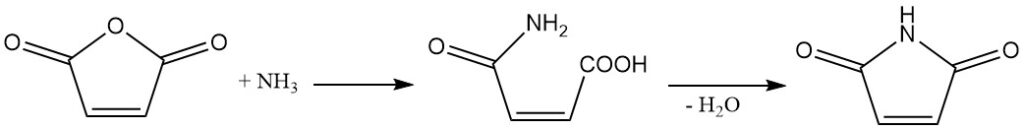
L’anidride maleica reagisce con ammoniaca o ammine per produrre le corrispondenti semiammidi. Un’ulteriore disidratazione porta alla formazione di immidi cicliche.
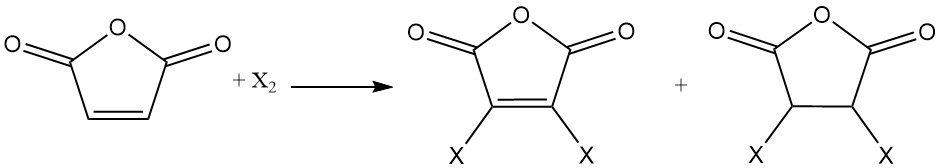
Il doppio legame dell’anidride maleica subisce reazioni di addizione con alogeni. A seconda delle condizioni di reazione, si possono formare anidridi maleiche mono- o dialogogenate o anidridi succiniche dialogogenate.
L’idrogenazione dell’anidride maleica produce vari prodotti, a seconda delle condizioni di reazione. Questi prodotti includono anidride succinica, 1,4-butandiolo, tetraidrofurano o butirrolattone.

L’aggiunta di olefine porta alla formazione di anidridi alchenilsucciniche.
L’anidride maleica partecipa alle reazioni di Diels-Alder con dieni coniugati.
L’anidride maleica può subire reazioni di omopolimerizzazione e copolimerizzazione.
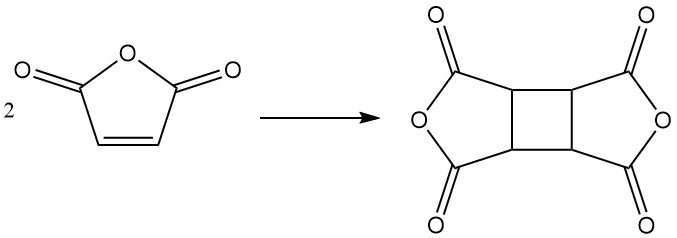
In condizioni specifiche, l’anidride maleica può dimerizzare per formare dianidride ciclobutantetracarbossilica (CBTA), utilizzata nella produzione di poliimmidi.
3. Produzione di anidride maleica
L’anidride maleica viene prodotta mediante l’ossidazione catalitica di idrocarburi idonei in fase gassosa. Tradizionalmente, il benzene era la materia prima principale. Tuttavia, gli idrocarburi C4 (come il butano) hanno acquisito sempre maggiore importanza negli ultimi anni.
3.1. Produzione di anidride maleica mediante ossidazione del benzene
Per produrre anidride maleica (Figura 1), il benzoene viene preriscaldato e miscelato con un flusso d’aria per formare una miscela omogenea. Vengono utilizzati reattori tubolari con tubi verticali riempiti con un catalizzatore come ossidi di vanadio e molibdeno su un supporto inerte.
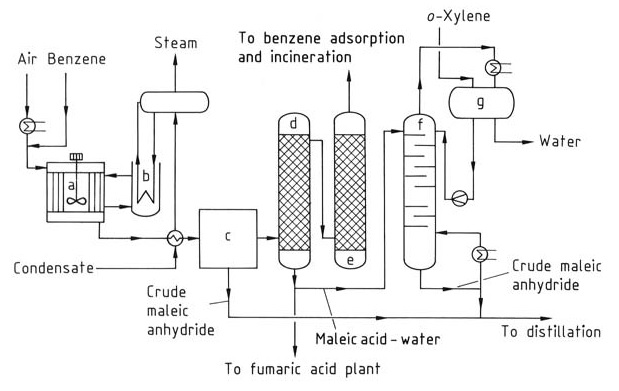
a) Reattore; b) Raffreddatore a bagno di sale; c) Condensatore parziale; d) Depuratore acido; e) Depuratore alcalino; f) Colonna di disidratazione; g) Separatore di fase
La reazione è esotermica e richiede il controllo della temperatura di esercizio e di una pressione compresa tra 0,15 e 0,25 MPa per ottimizzare la resa di anidride maleica e minimizzare la combustione a CO2 e CO. Il calore generato durante la reazione (circa 27 MJ per tonnellata di benzene) viene rimosso utilizzando sali fusi circolanti, che vengono successivamente raffreddati con acqua.
La seguente reazione rappresenta la produzione di anidride maleica:
C6H6 + 4.5 O2 → C4H2O3 + 2 CO2 + 2 H2O (ΔH = -1875 kJ/mol)
Tuttavia, si verificano anche alcuni fenomeni di combustione indesiderati. Il benzene non reagito può essere recuperato utilizzando tecniche come l’adsorbimento e riutilizzato nel processo. Sebbene esistano brevetti per processi che riciclano una porzione maggiore del gas di reazione dopo la separazione dell’anidride maleica, questi non sono ancora stati ampiamente adottati a livello commerciale.
Separazione dell’anidride maleica grezza
L’effluente del reattore viene inizialmente raffreddato per impedire la condensazione di anidride maleica e acqua. Per l’ulteriore lavorazione si possono quindi utilizzare due metodi:
- Condensazione parziale: la miscela di gas viene raffreddata a circa 55 °C, consentendo all’anidride maleica di condensare e separarsi in forma liquida. Tuttavia, il contatto prolungato con il gas contenente acqua può portare alla formazione di acido maleico. Questo approccio recupera in genere il 40-60% dell’anidride maleica.
- Depurazione con acqua: questo metodo cattura tutta l’anidride maleica presente nel gas di reazione sotto forma di soluzione di acido maleico. Tuttavia, la successiva fase di disidratazione per recuperare l’anidride maleica è ad alto consumo energetico ed è preferita solo per gas di reazione ad alto contenuto d’acqua (come quelli derivanti dall’ossidazione C4).
3.2. Produzione di anidride maleica mediante disidratazione di soluzioni acquose di acido maleico
L’anidride maleica può essere ricavata dalle soluzioni di acido maleico ottenute lavando il gas di reazione con acqua.
A temperature superiori a 150 °C, anche tracce di alcali nella soluzione di lavaggio possono causare la decarbossilazione dell’anidride maleica. Pertanto, è necessaria acqua di lavaggio priva di alcali.
La disidratazione dell’acido maleico richiede temperature superiori a 100 °C (ΔH = +34,88 kJ/mol). Tuttavia, per raggiungere una velocità di reazione rilevante a livello industriale, sono necessarie temperature superiori a 130 °C. Questo sistema a temperature più elevate favorisce anche l’isomerizzazione indesiderata dell’acido maleico in acido fumarico.
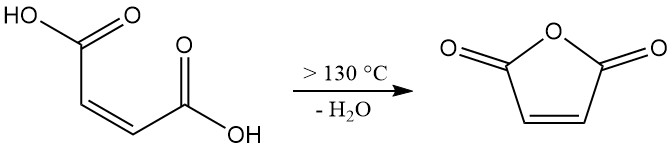
Sebbene l’acido fumarico di per sé non si decomponga in modo significativo formando anidride maleica al di sotto dei 230 °C, la sua presenza riduce la resa complessiva del prodotto desiderato. Per ridurre al minimo l’isomerizzazione, un breve tempo di residenza a temperature elevate è fondamentale durante il processo di disidratazione.
Per la disidratazione di soluzioni acquose di acido maleico vengono utilizzati due processi principali: il metodo con agente di trascinamento e il processo termico senza agente di trascinamento.
3.2.1. Metodo con agente di trascinamento
In questo processo, la soluzione acquosa di acido maleico viene immessa nella sezione superiore di una colonna di distillazione, dove si mescola con una miscela bollente di anidride maleica e un agente di trascinamento come lo xilene.
L’agente di trascinamento (xilene) forma una miscela azeotropica con l’acqua, consentendo la rimozione di entrambi dalla colonna di testa sotto forma di flusso di vapore. Questo flusso di vapore viene quindi separato in un decanter in fasi organica e acquosa.
La fase organica contenente lo xilene viene riciclata nella sezione superiore della colonna di distillazione, mentre la fase acquosa viene restituita allo scrubber dei gas di reazione dell’impianto di ossidazione.
Il flusso di prodotto di fondo della colonna di distillazione, contenente anidride maleica (10-40%), xilene (1-5%), acido maleico (1-3%) e acido fumarico (1-3%), subisce un’ulteriore distillazione per isolare l’anidride maleica pura. Questo processo può essere eseguito in continuo o a lotti.
3.2.2. Processo termico senza agente di trascinamento
Questo metodo utilizza la tecnologia dell’evaporazione a strato sottile per ottenere la disidratazione termica della soluzione acquosa di acido maleico. La tecnica consente un’efficiente rimozione dell’acqua sotto forma di vapore, riducendo al minimo il tempo di residenza dell’acido maleico ad alte temperature (150-200 °C). Questo breve tempo di esposizione contribuisce a sopprimere l’isomerizzazione ad acido fumarico (solo l’1-3%).
Più unità di evaporazione a strato sottile sono spesso disposte in serie. L’anidride maleica liquida ottenuta dal condensatore parziale può anche essere immessa nel secondo stadio di questo sistema per disidratare l’acido maleico rimanente (1-5%).
Questo processo continuo produce anidride maleica ad elevata purezza (99%) dopo una fase finale di distillazione. Il prodotto di fondo dell’ultimo evaporatore contiene acido fumarico e residui altobollenti, che vengono scartati.
Questi impianti a funzionamento continuo richiedono fermate periodiche per la pulizia.
3.3. Produzione di anidride maleica mediante ossidazione di idrocarburi C4
Negli ultimi anni, l’ossidazione di idrocarburi C4, principalmente utilizzando n-butano o miscele di n-butano-n-butene ricche di paraffine, si è affermata come un’alternativa significativa alla tradizionale ossidazione del benzene per la produzione di anidride maleica.
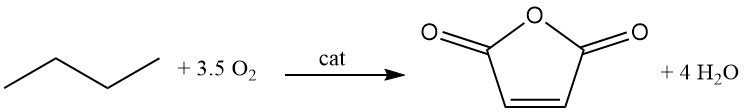
Sono stati sviluppati diversi tipi di processi, come i processi a letto fisso, a letto fluido e a letto di trasporto.
3.3.1. Processo a letto fisso
Il processo a letto fisso è un metodo commercialmente consolidato che utilizza catalizzatori a base di ossido di vanadio e fosforo (V-P-O) confezionati in reattori tubolari, in modo simile all’ossidazione del benzene. La reazione è altamente esotermica.
C4H10 + 3.5 O2 → C4H2O3 + 4 H2O (ΔH = -1260 kJ/mol)
Tuttavia, rispetto all’ossidazione del benzene, si osservano tassi di conversione inferiori, pari all’80%, e selettività inferiori (70%). Il recupero degli idrocarburi C4 non reagiti è più impegnativo rispetto al benzene.
3.3.2. Processo a letto fluido
Il processo a letto fluido offre un controllo della temperatura più uniforme all’interno del reattore, riducendo al minimo i “punti caldi” e migliorando potenzialmente la selettività della reazione. Tuttavia, il processo di fluidizzazione comporta anche un’intensa rimescolamento del prodotto, che può vanificare i vantaggi.
Un’altra sfida è lo stress meccanico sul catalizzatore V-P-O dovuto ad abrasione ed erosione. Nonostante questi inconvenienti, i letti fluidizzati possono funzionare a concentrazioni di C4 più elevate (entro il range di esplosione) grazie alla loro efficacia come barriere antifiamma.
Il processo ALMA (Alusuisse, Lummus) è un esempio di reattore a letto fluido accoppiato a un’unità di processo non acquosa.
3.3.3. Processo a letto di trasporto
Questo processo è stato sviluppato da Monsanto e DuPont e utilizza due reattori. Il catalizzatore V-P-O consumato nell’ossidazione C4 viene rigenerato con ossigeno nel primo reattore. Il catalizzatore rigenerato reagisce quindi con n-butano nel secondo reattore in condizioni quasi stechiometriche con un livello minimo di ossigeno atmosferico.
Questo processo raggiunge un’elevata selettività nella formazione di anidride maleica (75% molare) riducendo al minimo il rimescolamento del gas prodotto, tuttavia è ancora in fase di sviluppo.
A causa della maggiore formazione di acqua rispetto all’ossidazione del benzene, la liquefazione diretta dell’anidride maleica dal gas di reazione C4 tramite condensazione parziale è limitata. Una porzione maggiore (65-70%) deve essere recuperata come acido maleico mediante lavaggio con acqua, seguito da disidratazione.
Un metodo di purificazione alternativo utilizza l’assorbimento dell’anidride maleica dal gas di reazione tramite solvente organico, che consente la separazione senza una significativa formazione di acido maleico. La miscela solvente-anidride maleica viene quindi sottoposta a distillazione frazionata per isolare l’anidride maleica pura.
3.4. Purificazione dell’anidride maleica grezza
Esistono due metodi principali per purificare l’anidride maleica grezza: la distillazione a lotti e la distillazione continua.
3.4.1. Distillazione a lotti
La distillazione a lotti viene utilizzata per trattare l’anidride maleica separata direttamente o le miscele ottenute dalla disidratazione dell’agente di trascinamento. L’anidride maleica grezza viene caricata in una colonna di distillazione a lotti e inizialmente riscaldata in condizioni di riflusso totale. In questo modo si ottiene una completa disidratazione dell’acido maleico rimanente.
La piccola quantità d’acqua eliminata durante la disidratazione condensa e viene separata dall’agente di trascinamento ricircolato (solitamente xilene). Lo xilene viene quindi rimosso per distillazione. Infine, l’anidride maleica purificata viene recuperata per distillazione sotto vuoto.
Per questo processo vengono comunemente utilizzati alambicchi discontinui con capacità che vanno da 50 a 150 metri cubi e colonne di distillazione con 10-20 piatti.
3.4.2. Distillazione continua
La distillazione continua è più economica per gli impianti di produzione di anidride maleica su larga scala.
In questo processo (Figura 2), un flusso continuo della miscela grezza di anidride maleica viene immesso nel sistema di distillazione. Lo xilene residuo viene prima rimosso in una colonna dedicata (f). Infine, l’anidride maleica pura viene isolata dalla parte superiore di una seconda colonna (g) tramite distillazione.
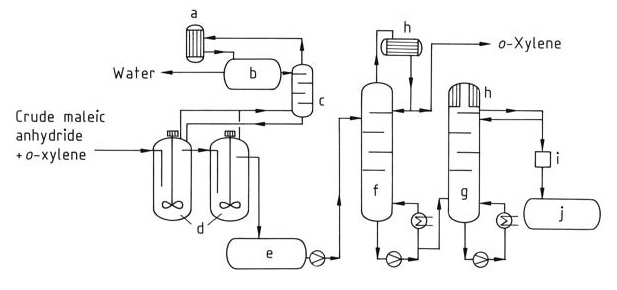
a) Condensatore; b) Recipiente di separazione; c) Colonna; d) Post-disidratazione; e) Serbatoio intermedio; f) Colonna di o-xilene; g) Colonna di anidride maleica pura; h) Refrigeratore; i) Colorimetro; j) Recipiente di anidride maleica pura
4. Usi dell’anidride maleica
Le proprietà uniche dell’anidride maleica, in quanto anidride dicarbossilica con doppio legame, la rendono un elemento versatile per diverse applicazioni industriali.
L’anidride maleica è utilizzata principalmente per la produzione di poliesteri e resine alchidiche, che vengono utilizzate nella produzione di materie plastiche rinforzate con fibra di vetro per l’edilizia, applicazioni elettriche, condotte e costruzioni navali. Viene anche utilizzata nella formulazione di lubrificanti e plastificanti.
L’anidride maleica partecipa facilmente alle reazioni di copolimerizzazione. Alcuni esempi di importanza industriale includono i copolimeri anidride maleica-stirene utilizzati per le materie plastiche ingegneristiche e i copolimeri anidride maleica-acido acrilico utilizzati nell’industria dei detergenti.
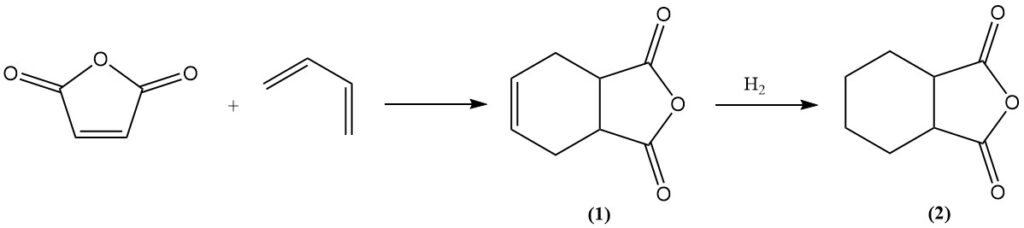
L’anidride maleica subisce reazioni di Diels-Alder con dieni come il butadiene per formare anidride tetraidroftalica (1). Un’ulteriore idrogenazione produce anidride esaidroftalica (2), un prezioso agente indurente per resine epossidiche. Un processo simile che utilizza l’isoprene produce anidride metilesaidroftalica per la stessa applicazione.
Quantità minori di anidride maleica vengono utilizzate nella produzione di pesticidi come il captano e il malathion, nonché di inibitori della crescita come l’idrazide dell’acido maleico.
Gli esteri dell’acido maleico possono essere trasformati in tensioattivi mediante reazioni con l’idrogenosolfito di sodio.
L’anidride maleica può essere utilizzata come accelerante di essiccazione se aggiunta agli oli siccativi, migliorando la qualità delle lacche.
5. Tossicologia dell’anidride maleica
L’anidride maleica può idrolizzarsi ad acido maleico in acqua, quindi le sue proprietà tossicologiche sono influenzate dalla presenza di acido maleico.
L’anidride maleica mostra una moderata tossicità acuta in base ai valori di LD50 (481 mg (ratto, orale), 465 mg (topo, orale), 2620 mg (coniglio, percutaneo) e 390 mg (cavia, orale) per chilogrammo di peso corporeo).
Il principale effetto tossico acuto è l’irritazione e la corrosione locale su pelle, mucose e occhi. L’esposizione può causare irritazione a concentrazioni pari a 1,5-2 ppm, con irritazione grave superiore a 2,5 ppm.
L’inalazione di anidride maleica a concentrazioni superiori a 1,2 ppm per periodi prolungati può scatenare sintomi asmatici.
L’anidride maleica è un forte sensibilizzante, il che significa che l’esposizione ripetuta può portare a reazioni allergiche sia nell’uomo che negli animali.
Studi su animali non hanno mostrato prove di cancerogenicità, teratogenicità (difetti congeniti) o tossicità riproduttiva derivanti dall’esposizione ad anidride maleica. Tuttavia, non sono stati osservati effetti sistemici fino a un livello di esposizione di 2,4 ppm, quindi non si possono escludere completamente effetti a concentrazioni più elevate.
I limiti di esposizione professionale sono stati stabiliti in base alle proprietà irritanti e sensibilizzanti:
- MAK (Commissione tedesca per l’indagine sui rischi per la salute dei materiali di lavoro): 0,2 ppm
- TLV-TWA (Valore limite di soglia dell’American Conference of Governmental Industrial Hygienists – Media ponderata nel tempo): 0,25 ppm
Riferimenti
- Maleic and Fumaric Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Maleic-Anhydride
- Method for producing cyclobutane tetracarboxylic acid derivative. – https://patents.google.com/patent/WO2015108168A1/en
Sono un chimico organico appassionato e continuo ad apprendere su vari processi di chimica industriale e prodotti chimici. Garantisco che tutte le informazioni su questo sito web siano accurate e meticolosamente referenziate ad articoli scientifici.
