Acido etilendiamminotetraacetico (EDTA): proprietà, produzione e usi
Cos’è l’acido etilendiamminotetraacetico?
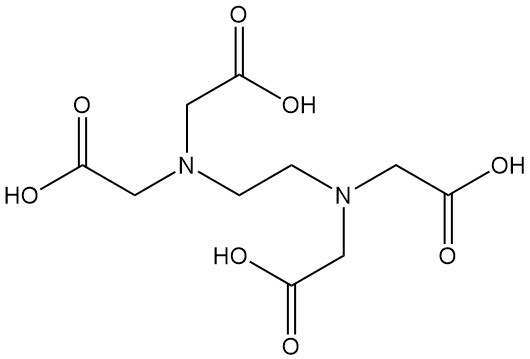
L’acido etilendiamminotetraacetico, meglio noto come EDTA, è un acido amminopolicarbossilico con formula C10H16N2O8. È un solido bianco insolubile in acqua ed è uno degli agenti chelanti più comunemente utilizzati in diversi settori industriali.
L’acido etilendiamminotetraacetico (EDTA), l’acido nitrilotriacetico (NTA) e i rispettivi sali furono sintetizzati per la prima volta negli anni ’30 da Ferdinand Munz nei laboratori della I.G. Farbenindustrie. Da allora, hanno acquisito una notevole importanza come agenti chelanti industriali.
Gli acidi amminopolicarbossilici (come l’EDTA), simili agli amminoacidi, possono formare sali con acidi e basi forti. Inoltre, possiedono la capacità di formare complessi forti e idrosolubili con cationi bivalenti e trivalenti. Questi complessi alterano significativamente la reattività dello ione metallico, rendendoli composti preziosi in vari processi industriali.
La principale applicazione industriale dell’EDTA è la prevenzione o la rimozione di incrostazioni e depositi insolubili contenenti calcio, bario, ferro e altri cationi.
Sommario
1. Proprietà fisiche dell’acido etilendiamminotetraacetico (EDTA)
L’acido etilendiamminotetraacetico è un solido cristallino incolore, leggermente solubile in acqua. Le principali proprietà fisiche dell’EDTA sono elencate nella tabella seguente.
| Proprietà | Valore |
|---|---|
| Numero CAS | [60-00-4] |
| Formula chimica | C10H16N2O8 |
| Peso molecolare | 292,24 g/mol |
| Punto di fusione | 245 °C (decomposizione) |
| Densità relativa | 0,86 g/cm3 |
| Solubilità in acqua a 20 °C | 0,1 g/L |
| pKa1 | 2 |
| pKa2 | 2,7 |
| pKa3 | 6,16 |
| pKa4 | 10,26 |
| Punto di infiammabilità | > 100 °C |
2. Proprietà chimiche dell’acido etilendiamminotetraacetico
L’EDTA forma complessi idrosolubili con cationi metallici bivalenti e trivalenti. Questi complessi presentano una struttura ad anello chiamata chelato (dal greco “chele”, che significa artiglio), in cui lo ione metallico è saldamente legato dal legante dissociato EDTA4-.
La forza di questo complesso è quantificata dalla costante di stabilità, che riflette le concentrazioni di equilibrio dello ione metallico (M) e dell’agente chelante (EDTA4-).
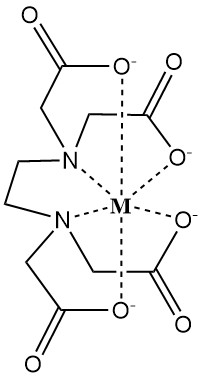
I fattori che influenzano la forza chelante sono il pH, gli anioni concorrenti e gli anioni precipitanti.
Un pH più elevato favorisce la chelazione poiché aumenta la concentrazione di anioni chelati completamente dissociati (ad esempio, EDTA4-), migliorandone la capacità di legame. Tuttavia, questo effetto può essere contrastato dagli ioni idrossile (OH–) a pH elevato, che possono disgregare i chelati metallici se il metallo forma idrossidi insolubili (ad esempio, precipitazione di Fe3+ a pH superiore a 5,5).
Anioni come carbonato, fosfato e ossalato possono competere con l’agente chelante, riducendo la forza effettiva del complesso metallo-agente chelante.
Generalmente, gli agenti chelanti come l’EDTA formano complessi 1:1 con gli ioni metallici. Tuttavia, aumentare la concentrazione dell’agente chelante oltre 1:1 può migliorare ulteriormente la stabilità.
La conversione dei cationi metallici in complessi metallici anionici altera la loro interazione con altre specie. Ad esempio, il complesso [Fe(III)(EDTA)]–, caricato negativamente, può muoversi più facilmente nel suolo rispetto al catione Fe3+ assorbito.
La chelazione riduce la concentrazione di ioni metallici liberi (M) mediante la formazione di complessi, aumentando di fatto il potenziale di ossidazione effettivo. Questo principio è alla base di diversi importanti processi industriali.
3. Produzione di acido etilendiamminotetraacetico (EDTA)
L’acido etilendiamminotetraacetico (EDTA) è stato prodotto commercialmente mediante la reazione di etilendiammina, acido cloroacetico e idrossido di sodio. Questo processo ha prodotto un prodotto contaminato da cloruro di sodio ed è stato abbandonato a causa di difficoltà di purificazione.
Altri metodi, come l’ossidazione catalitica di specifici materiali di partenza, sono stati esplorati, ma mai adottati commercialmente.
Oggi, due processi principali dominano la produzione di EDTA e dei relativi agenti chelanti, entrambi basati sulla cianometilazione della poliammina madre.
3.1. La cianometilazione alcalina dell’etilendiammina
La cianometilazione alcalina dell’etilendiammina è il processo più utilizzato per la sintesi dell’acido etilendiamminotetraacetico.
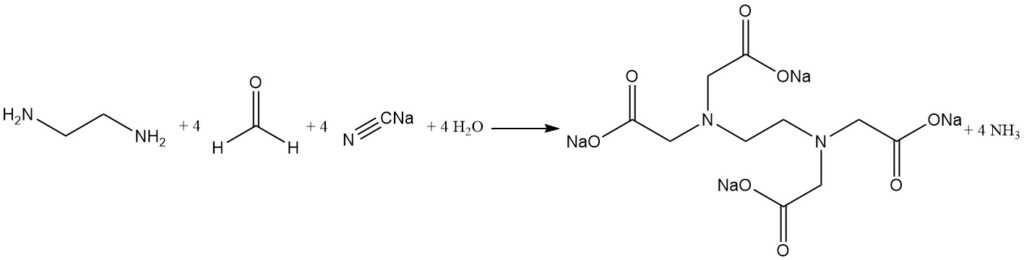
Il cianuro di sodio e la formaldeide reagiscono con l’etilendiammina per produrre EDTA ad alte rese (oltre il 90%). L’ammoniaca è il sottoprodotto principale e viene continuamente rimossa durante la reazione. Tuttavia, piccole quantità di ammoniaca reagiscono formando sali di sottoprodotti indesiderati come l’acido nitrilotriacetico e la glicina.
Sali di acido glicolico possono anche essere formati dalla reazione tra i materiali di partenza. Queste impurità hanno un impatto minimo sulla maggior parte delle applicazioni degli agenti chelanti.
3.2. La sintesi di Singer in due fasi
La sintesi di Singer in due fasi separa la fase di cianometilazione dalla reazione di idrolisi. In questo caso, il cianuro di idrogeno e la formaldeide reagiscono con l’etilendiammina per formare un prodotto intermedio ad alta resa (oltre il 96%), l'(etiledinitrilo)tetraacetonitrile.
Questo intermedio insolubile viene isolato, lavato e quindi idrolizzato con idrossido di sodio per produrre EDTA tetrasodio puro con ammoniaca come sottoprodotto. Separando la reazione in due fasi si riduce al minimo la formazione di impurità e si produce un agente chelante altamente purificato.
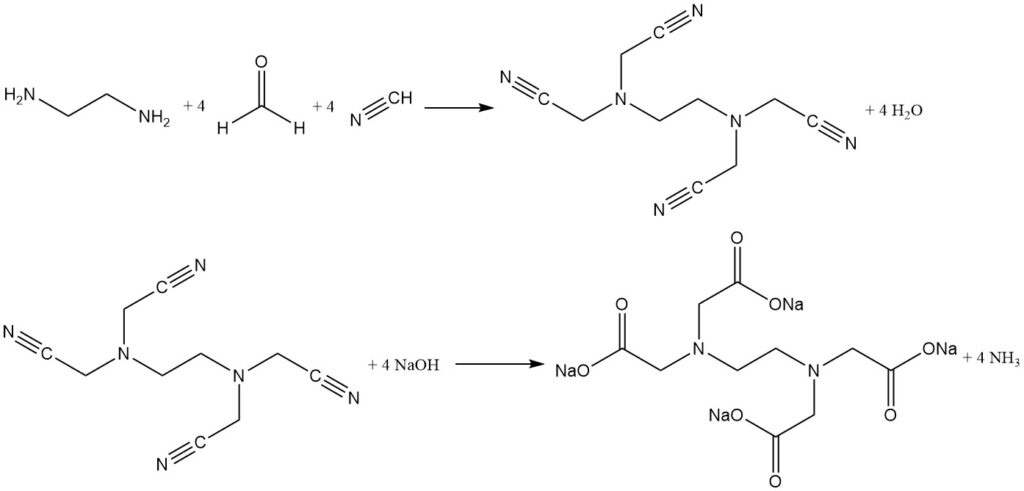
Questo approccio in due fasi viene utilizzato anche per la produzione efficiente di acido nitrilotriacetico puro utilizzando ammoniaca.
4. Usi dell’acido etilendiamminotetraacetico (EDTA)
Gli agenti chelanti come l’EDTA, con la loro capacità unica di legare e inattivare gli ioni metallici, trovano applicazione in diversi settori.
Gli agenti chelanti di tipo EDTA prevengono variazioni di colore indesiderate nei coloranti complessando i contaminanti metallici in tracce provenienti da fibre, sostanze chimiche e acqua.
L’EDTA migliora la brillantezza della pasta di carta sbiancata con perossido di idrogeno o ditionito. Agisce come stabilizzante e agente di controllo degli ioni metallici durante le fasi di spappolamento e sbiancamento.
L’EDTA viene utilizzato per pulire i depositi di calcare dalle caldaie e prevenire la formazione di incrostazioni di calcio e magnesio complessando questi ioni metallici. Tuttavia, un corretto controllo del dosaggio è importante per evitare un eccesso di agenti chelanti che causa corrosione.
I polimeri vengono talvolta utilizzati in combinazione con gli agenti chelanti per minimizzarne il potenziale corrosivo.
L’EDTA può essere impiegato per pulire le superfici metalliche sciogliendo le pellicole di ossido aderenti, consentendo un risciacquo accurato. Le soluzioni di placcatura dei metalli spesso aggiungono agenti chelanti come l’EDTA per formare ioni metallici complessi, con conseguente rivestimento metallico più liscio e uniforme.
Detersivi per bucato, detergenti per superfici dure e detergenti per il bagno aggiungono EDTA, che ne aumenta il potere pulente.
L’EDTA distrugge la parete cellulare esterna di alcuni batteri, in particolare dei batteri Gram-negativi, aumentando l’efficacia degli agenti igienizzanti. Agisce anche come conservante in cosmetici, shampoo e prodotti oftalmici, aumentandone l’attività battericida.
L’acido etilendiamminotetraacetico previene l’irrancidimento ossidativo in emulsioni grasse come maionese e condimenti per insalata complessando gli ioni metallici che possono accelerarne il deterioramento. Inoltre, previene lo scolorimento causato dal ferro presente in alimenti come le patate.
La chelazione con EDTA è utilizzata commercialmente nella polimerizzazione in emulsione della gomma stirene-butadiene e nello sbiancamento delle pellicole fotografiche. I chelati di ferro sono impiegati per controllare le emissioni industriali di idrogeno solforato e come assorbenti reversibili per gli ossidi di azoto.
Gli ioni metallici in tracce possono interferire con i processi chimici. Agenti chelanti come l’EDTA rimuovono questi metalli indesiderati per garantire l’efficienza del processo e soddisfare le specifiche del prodotto.
Micronutrienti come ferro, zinco, manganese e rame vengono aggiunti ai fertilizzanti in forma chelata. Questo impedisce loro di interagire con i fosfati e altri componenti del suolo che possono causare precipitazioni e ridurne l’assorbimento da parte delle piante.
La chelazione consente a questi micronutrienti di muoversi più facilmente attraverso il terreno verso la zona radicale per l’assorbimento da parte delle piante.
L’EDTA è ampiamente utilizzato nei metodi titrimetrici grazie alla rapida variazione della concentrazione di ioni metallici liberi al punto di equivalenza. Viene anche utilizzato come agente mascherante in alcuni metodi spettrofotometrici per eliminare l’interferenza degli ioni metallici.
L’EDTA è l’agente chelante dominante, rappresentando quasi la metà del consumo totale nell’Europa occidentale (78.000 tonnellate nel 2004). Tra i principali produttori figurano Dow Chemical, BASF e AkZO.
5. Tossicologia dell’EDTA
L’EDTA e i suoi sali vantano una lunga storia di utilizzo sicuro in varie applicazioni, tra cui additivi alimentari, prodotti farmaceutici e cosmetici. I primi studi tossicologici suggeriscono una tossicità relativamente bassa.
Studi sui ratti indicano un’elevata dose letale (LD50) per l’EDTA disodico (sale disodico), compresa tra 2,0 e 2,2 grammi per chilogrammo di peso corporeo.
Studi che hanno utilizzato l’EDTA disodico allo 0,5%-5,0% nella dieta non hanno mostrato effetti avversi significativi, ad eccezione di diarrea e riduzione dell’assunzione di cibo al dosaggio più elevato. L’EDTA trisodico non sembra essere un sensibilizzante cutaneo.
Sebbene l’EDTA possa interagire con il materiale genetico, la sua rilevanza per la genotossicità umana (causando danni genetici) sembra minima. Studi sull’Na3EDTA (sale trisodico) non hanno mostrato alcuna cancerogenicità correlata al composto.
Riferimento
- Ethylenediaminetetraacetic Acid and Related Chelating Agents; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a10_095.pub2
Sono un chimico organico appassionato e continuo ad apprendere su vari processi di chimica industriale e prodotti chimici. Garantisco che tutte le informazioni su questo sito web siano accurate e meticolosamente referenziate ad articoli scientifici.
