Acido cloridrico: proprietà, produzione e usi
Cos’è l’acido cloridrico?
L’acido cloridrico, noto con il suo nome alternativo acido muriatico, è una soluzione di acido inorganico forte con formula chimica HCl. È un liquido incolore dall’odore pungente, molto corrosivo per la pelle, gli occhi e i metalli.
Nel XV secolo, un alchimista tedesco di nome VALENTIN applicò calore a una sostanza chiamata vetriolo verde (FeSO4·7 H2O) insieme a sale comune. Di conseguenza, ottenne una sostanza chiamata spirito di sale.
Nel XVII secolo, GLAUBER sintetizzò l’acido cloridrico combinando sale comune con acido solforico. Fu nel 1790 che DAVY stabilì la composizione dell’acido cloridrico attraverso la sintesi di idrogeno e cloro.
Nello stesso anno, LEBLANC scoprì un processo, che prese il suo nome, per la produzione di soda. Questo processo prevedeva la reazione del sale comune con l’acido solforico, con conseguente rilascio di acido cloridrico. Inizialmente considerato un sottoprodotto indesiderato, veniva rilasciato nell’atmosfera in quantità significative.
Tuttavia, nel 1863, l’Alkali Act obbligò i produttori di soda inglesi a sciogliere l’acido cloridrico in acqua, portando all’uso industriale diffuso dell’acido prodotto. Qualsiasi eccesso di acido cloridrico che non potesse essere utilizzato come acido cloridrico veniva ossidato a cloro.
La sintesi industriale dell’acido cloridrico emerse parallelamente allo sviluppo del processo elettrolitico cloro-alcali all’inizio del XX secolo. Questo metodo, oltre a quello basato sulla reazione tra cloruri e acido solforico o idrogenosolfato di sodio, produceva un prodotto più puro.
Questi processi stanno gradualmente perdendo importanza a causa delle notevoli quantità di acido cloridrico generate come sottoprodotti nei processi di clorurazione come la produzione di cloruro di vinile dall’etilene. Inoltre, l’acido cloridrico può essere recuperato dai gas prodotti durante l’incenerimento dei rifiuti contenenti cloro, il che è in linea con la crescente attenzione alla tutela ambientale.
Table of Contents
1. Proprietà fisiche dell’acido cloridrico
L’acido cloridrico (HCl) esiste in condizioni standard come un gas trasparente caratterizzato dal suo forte odore e dall’impatto altamente corrosivo sulle mucose dell’apparato respiratorio.
Alcune proprietà fisiche dell’acido cloridrico sono presentate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Massa molare | 36,461 g/mol |
| Punto di fusione | -114,22 °C |
| Punto di ebollizione | -85,05 °C |
| Densità del vapore | 1,639 g/L |
| Densità del liquido | 1,18 g/mL |
| Critico Temperatura | 51 °C |
| Pressione critica | 81,6 bar |
2. Proprietà chimiche dell’acido cloridrico
L’acido cloridrico mostra stabilità termica fino a circa 1500 °C, oltre la quale subisce una significativa dissociazione. Nella sua forma completamente secca, l’acido cloridrico dimostra una reattività limitata, mostrando un attacco trascurabile all’acciaio dolce.
Inoltre, le reazioni che coinvolgono acido cloridrico anidro in genere richiedono la presenza di catalizzatori. Al contrario, quando l’acido cloridrico viene disciolto in un solvente polare, come l’acqua, si trasforma in un acido potente e di conseguenza diventa un reagente altamente reattivo.
La solubilità dell’acido cloridrico in acqua è sostanziale, accompagnata dal rilascio di una notevole quantità di calore. Ciò si traduce nella formazione di acido cloridrico, che possiede una natura formidabile ed estremamente aggressiva.
Presenta la capacità di corrodere la maggior parte dei metalli e delle leghe disponibili in commercio a vari livelli. Di conseguenza, i metalli necessitano di protezione tramite l’utilizzo di rivestimenti non metallici adatti o materiali da costruzione non metallici.
In condizioni definite con precisione, possono essere impiegati il tantalio o le leghe di nichel altamente resistenti come Hastelloy B. Tuttavia, i metalli meno nobili si dissolvono, portando alla liberazione di gas idrogeno.
3. Produzione di acido cloridrico (HCl)
La presenza di cloruro di idrogeno libero in natura è limitata, e si verifica solo in basse concentrazioni. È stato rilevato nella stratosfera a livelli di circa il 10-11 percento in volume.
D’altro canto, i cloruri inorganici hanno un’ampia distribuzione, con il cloro classificato come undicesimo elemento chimico più abbondante. I cloruri di metalli alcalini e alcalino-terrosi, in particolare il salgemma, servono come materie prime primarie per vari metodi di produzione di cloruro di idrogeno o acido cloridrico.
Questi metodi includono processi che coinvolgono sostanze intermedie come cloro o composti organici clorurati.
In natura, il cloruro di idrogeno viene rilasciato durante le eruzioni vulcaniche o altre emissioni di gas sotterranei. La quantità di cloruro di idrogeno prodotta può essere paragonabile a quella dell’anidride solforosa.
L’acido cloridrico è naturalmente presente nel succo gastrico dei mammiferi, con una concentrazione di circa 0,1 mol/L nello stomaco umano.
3.1. Metodi di preparazione dell’acido cloridrico (HCl)
L’acido cloridrico (HCl) viene preparato tramite diverse reazioni:
1. Sintesi da elementi:
La combinazione di idrogeno gassoso e cloro gassoso porta alla formazione di acido cloridrico gassoso:
H2 + Cl2 → 2 HCl
2. Reazione dei cloruri metallici con acido solforico:
I cloruri metallici, in particolare il cloruro di sodio, possono reagire con acido solforico o idrogeno solforato per produrre cloruro di idrogeno:
Cloruro metallico + H2SO4 → HCl + Solfato metallico
3. Sottoprodotti della clorurazione:
Durante la produzione di vari composti organici clorurati come diclorometano, tricloroetilene, percloroetilene o cloruro di vinile, l’acido cloridrico si forma come sottoprodotto attraverso una serie di reazioni:
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
4. Decomposizione termica di cloruri di metalli pesanti idrati:
L’acido cloridrico può essere ricavato dalla decomposizione termica di cloruri di metalli pesanti idrati presenti nel liquido di decapaggio esaurito utilizzato per il trattamento dei metalli.
5. Incenerimento di rifiuti organici clorurati:
Quando i rifiuti organici clorurati vengono sottoposti a incenerimento, si produce acido cloridrico come risultato:
C4H6Cl2 + 5 O2 → 4 CO2 + 2 H2O + 2 HCl
La fonte primaria di cloruro di idrogeno oggigiorno è il sottoprodotto ottenuto dai processi di clorurazione. Il livello di purificazione richiesto dipende dall’applicazione prevista. Attualmente, il recupero di cloruro di idrogeno dai materiali di scarto è in aumento.
Inoltre, il cloruro di idrogeno può essere formato in reazioni indesiderate come l’idrolisi dei catalizzatori di Friedel-Crafts:
AlCl3 + 3 H2O → Al(OH)3 + 3 HCl
3.2. Produzione industriale di acido cloridrico (HCl)
3.2.1. Da idrogeno e cloro
Il metodo più semplice per produrre acido cloridrico è la sua sintesi diretta dai suoi componenti elementari, che dà origine a un prodotto altamente puro. Questa reazione è altamente esotermica, con un’entalpia di reazione standard (ΔH) di -184 kJ.
È importante notare che le miscele di idrogeno e cloro possono essere estremamente esplosive in un’ampia gamma di composizioni. La luce può fungere da iniziatore per un’esplosione. Pertanto, è necessario prendere precauzioni per prevenire la formazione di miscele reattive di cloro e idrogeno nei processi industriali.
Nella produzione industriale, viene impiegato un bruciatore, in cui cloro e idrogeno vengono alimentati separatamente attraverso tubi concentrici nella camera di combustione. Una volta acceso, il cloro brucia in presenza di idrogeno, generando una fiamma calda e silenziosa a temperature superiori a 2000 °C.
La silice ha dimostrato efficacia come materiale da costruzione adatto per il bruciatore. Sono stati utilizzati anche ghisa o acciaio, a volte raffreddati ad acqua, o grafite.
In genere, il bruciatore è posizionato sul fondo di una camera di combustione cilindrica, con la fiamma rivolta verticalmente verso l’alto. La camera di combustione stessa è realizzata in acciaio e rivestita con mattoni refrattari. Una sezione di raffreddamento, opportunamente dimensionata e sagomata, è collegata alla camera di combustione.
Se i reagenti sono molto umidi o contaminati, devono essere impiegati materiali da costruzione resistenti alla corrosione come silice o grafite.
Gli impianti di produzione esistenti sono prevalentemente costruiti utilizzando acciaio al carbonio e l’acido cloridrico prodotto viene raffreddato ad acqua solo a una temperatura in cui l’acido cloridrico acquoso non può condensare.
I principali contaminanti sono l’umidità nell’idrogeno e l’ossigeno nel cloro, sebbene anche composti di ossigeno come l’ossido di dicloro (Cl2O) o l’anidride carbonica possano creare problemi formando acqua.
Il rapporto di miscelazione delle materie prime viene regolato in base all’uso previsto dell’acido cloridrico prodotto. Si può impiegare un leggero eccesso di idrogeno o cloro.
Non è consigliabile lavorare con miscele esattamente equimolari poiché la reazione non è completamente quantitativa e diventa più difficile prevenire miscele esplosive.
Le deviazioni nel controllo possono portare a spostamenti intermittenti tra eccesso di idrogeno e eccesso di cloro, con conseguente comparsa occasionale di miscele esplosive.
In genere, l’idrogeno nell’acido cloridrico presenta meno sfide rispetto al cloro, quindi viene comunemente utilizzato un leggero eccesso di 1-2% di idrogeno. A seconda della purezza delle materie prime, è possibile ottenere acido cloridrico completamente privo di cloro, con l’idrogeno in eccesso come unica impurità.
Questo acido cloridrico altamente puro può essere utilizzato per produrre acido cloridrico eccezionalmente puro o può essere liquefatto o fornito direttamente agli utenti come gas secco tramite condotte in acciaio.
L’uso dell’acciaio per forni di sintesi e refrigeratori è un’opzione interessante. Ciò consente il funzionamento a pressione elevata, che è determinata dalla pressione del cloro e dell’idrogeno, nonché dalla temperatura e dalla pressione nella conduttura.
È fondamentale mantenere una pressione sufficientemente bassa o una temperatura sufficientemente alta per impedire la condensazione dell’acido cloridrico acquoso. I forni per acciaio utilizzati a H€uls, ad esempio, possono produrre ciascuno 30-40 tonnellate di cloruro di idrogeno al giorno.
Il gas di cloruro di idrogeno generato ha una pressione fino a 0,7 MPa e un contenuto di acqua inferiore a 50 ppm (in volume), il che richiede l’uso di tubi di acciaio per il trasporto dall’impianto.
I processi chimicamente correlati includono la reazione del cloro con carbonio (sotto forma di coke) e vapore acqueo:
C + 2 H2O + 2 Cl2 → 4 HCl + CO2
Un altro processo correlato coinvolge la reazione del cloro con anidride solforosa e acqua:
SO2 + 2 H2O + Cl2 → 2 HCl + H2SO4
3.2.2. Reazione di cloruri metallici con acido solforico
Il processo al solfato è caratterizzato da un elevato consumo di energia. Di conseguenza, la sua importanza è gradualmente diminuita rispetto ad altri processi, in particolare la clorurazione organica, che genera quantità significative di acido cloridrico come sottoprodotto.
Inoltre, l’argomentazione secondo cui l’acido solfato-cloridrico produce un prodotto di purezza più elevata non è più valida. L’acido sottoprodotto può ora essere adeguatamente purificato per soddisfare i requisiti per standard di alta qualità. Pertanto, solo il processo più importante dell’acido solfato-cloridrico sarà discusso qui.
La reazione tra sale comune e acido solforico concentrato avviene a temperature relativamente basse (150-300 °C), con conseguente formazione di acido cloridrico e acido solfidrico di sodio.
Quest’ultimo reagisce con un eccesso di cloruro di sodio a una temperatura minima di 550-600 °C, producendo solfato di sodio neutro. Sebbene l’uso di idrogenosolfato di sodio come materiale di partenza sia tecnicamente fattibile, è stato interrotto a causa della natura antieconomica del processo causata dalle alte temperature (600-800 °C) e dal consumo energetico coinvolto.
Attualmente, l’acido solforico è l’unico materiale di partenza. Nel processo di Mannheim, viene prodotto solfato di sodio, mentre nel processo dell’acido cloridrico di Berlino, viene utilizzato idrogenosolfato di sodio.
Nel processo di Mannheim, vengono impiegati forni a muffola alimentati esternamente e rivestiti di mattoni. Questi forni includono un meccanismo di agitazione con un’azione di raschiatura per impedire la formazione di grumi nella massa pastosa e per rimuovere il solfato di sodio prodotto.
L’acido cloridrico viene scaricato attraverso il lato della muffola e spinto da una ventola verso la fase successiva, con il forno mantenuto a una pressione leggermente ridotta.
La miscela di gas di scarico della fornace contiene fino all’85% di cloruro di idrogeno, insieme ad aria, nebbia di acido solforico e particelle di sale fini. In genere, il gas subisce più fasi di purificazione, tra cui filtrazione tramite coke e carbone attivo, lavaggio a umido o reazioni chimiche.
Il processo di acido cloridrico di Berlino produce gas di cloruro di idrogeno di purezza significativamente più elevata rispetto al processo di Mannheim. La reazione tra sale comune e acido solforico avviene in idrogenosolfato di sodio fuso a circa 300 °C all’interno di storte in ghisa.
In alternativa, può essere utilizzato cloruro di potassio, con conseguente produzione di cloruro di idrogeno e idrogenosolfato di potassio. Questo processo mantiene una certa importanza commerciale in quanto i prodotti primari sono i sali di potassio formati (vale a dire, KHSO4 e K2S2O7), con l’idrogenosolfato considerato un sottoprodotto.
Il gas proveniente dalle storte è più concentrato grazie alla migliore tenuta stagna dell’apparecchiatura, con conseguenti livelli inferiori di nebbia di acido solforico come conseguenza della ridotta temperatura di lavoro.
3.2.3. Recupero come sottoprodotto della clorurazione
La fonte primaria di acido cloridrico e acido cloridrico è il sottoprodotto dei processi di clorurazione. La rottura del 1,2-dicloroetano per produrre cloruro di vinile si distingue come il principale fattore che contribuisce alla produzione di acido cloridrico.
Le quantità di acido cloridrico generate e consumate possono essere significative, con molti impianti che ne producono circa 10.000 m³/h (16 t/h o 140.000 t/a) o più.
Di conseguenza, l’acido cloridrico viene spesso fornito direttamente agli impianti chimici che lo utilizzano come materia prima. Le capacità di stoccaggio dell’acido cloridrico sono in genere relativamente ridotte. Pertanto, è fondamentale mantenere un tasso equilibrato di produzione e consumo.
In caso di problemi di produzione o fluttuazioni di mercato che interessano un impianto o un prodotto, l’altro impianto può continuare a funzionare solo se è presente una capacità di produzione di riserva (che di solito non è completamente utilizzata).
Lo stoccaggio tampone per l’acido cloridrico liquido viene utilizzato per affrontare gli squilibri a breve termine tra produzione e consumo.
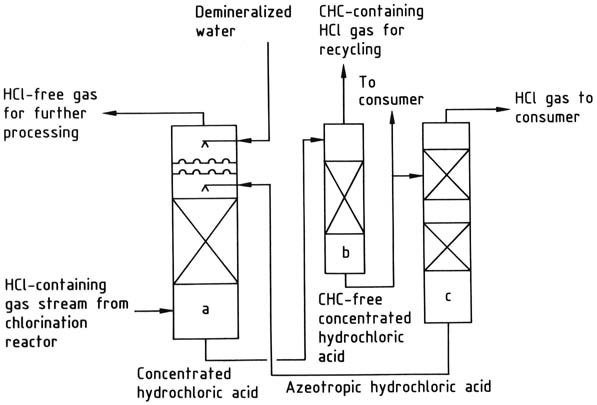
a) Colonna di assorbimento di acido cloridrico; b) Colonna di strippaggio di idrocarburi clorurati; c) Colonna di desorbimento di acido cloridrico
L’acido cloridrico prodotto tramite clorurazione organica può essere sottoposto a vari metodi di trattamento:
1. Semplice condensazione di idrocarburi clorurati: questo approccio viene utilizzato quando la presenza di idrocarburi clorurati residui o altri sottoprodotti del processo di clorurazione non pone problemi all’acido cloridrico, che viene fornito come gas.
Il livello di purificazione raggiunto dipende dalla pressione e dalla temperatura di condensazione. Ad esempio, nella clorurazione di clorometano in diclorometano, l’acido cloridrico risultante viene utilizzato esclusivamente per convertire metanolo in clorometano, che viene successivamente utilizzato per produrre diclorometano.
2. Isolamento e purificazione dell’acido cloridrico mediante distillazione: la distillazione frazionata del gas liquefatto può essere impiegata quando è richiesto un prodotto più puro. Ad esempio, i prodotti gassosi derivati dalla rottura del 1,2-dicloroetano vengono liquefatti e poi separati mediante distillazione in cloruro di vinile e acido cloridrico.
La liquefazione di questi gas a temperature estremamente basse è economicamente poco pratica, quindi la condensazione e la distillazione vengono eseguite a pressione elevata. Un vantaggio di questo metodo è che l’acido cloridrico gassoso viene prodotto a una pressione sufficientemente elevata (tipicamente 1-2 MPa) per la successiva lavorazione, eliminando la necessità di ulteriore compressione meccanica.
3. Assorbimento acquoso dell’acido cloridrico: questo metodo determina la produzione di acido cloridrico come prodotto intermedio, ma presenta delle sfide legate ai materiali da costruzione.
Tuttavia, l’introduzione dei fluoropolimeri ha in larga misura mitigato questi problemi. Tuttavia, molte installazioni hanno sostituito il trattamento acquoso con metodi non acquosi, come la distillazione frazionata.
L’acido cloridrico può essere assorbito utilizzando acqua o una soluzione di acido cloridrico al 20% in peso. L’acqua è adatta quando l’obiettivo primario è produrre acido cloridrico al 30-35% in peso come prodotto finale.
Se la domanda di tale acido è insufficiente, l’azeotropo al 20% viene utilizzato per l’assorbimento dell’acido cloridrico, concentrando così l’acido a una concentrazione del 30-35% in peso.
L’acido cloridrico concentrato viene purificato se necessario e quindi distillato per produrre acido cloridrico gassoso e acido cloridrico azeotropico. L’acido cloridrico viene essiccato e consegnato al consumatore, mentre l’azeotropo viene riciclato nella fase di assorbimento.
Se la presenza di idrocarburi clorurati nell’acido cloridrico è indesiderata, è possibile implementare una fase di stripping per rimuoverli.
Per rimuovere l’acido cloridrico da un flusso di gas, una piccola quantità di acqua viene introdotta nella colonna di assorbimento. Questa aggiunta di acqua assicura che il flusso di gas diventi privo di acido cloridrico. Tuttavia, una quantità corrispondente di acido deve essere separata per altri scopi.
Diversi parametri di processo e di apparecchiatura sono cruciali per valutare l’economia dell’assorbimento acquoso di acido cloridrico da un flusso di gas di produzione:
- La concentrazione di acido cloridrico nel flusso di gas determina la pressione e la temperatura mantenute nella colonna di assorbimento.
- L’energia richiesta per liberare gas di acido cloridrico puro diminuisce all’aumentare della concentrazione dell’acido concentrato formato.
- La produzione di acido cloridrico concentrato da un flusso di gas con bassa concentrazione di acido cloridrico richiede uno sforzo significativo. Ciò può comportare l’aumento della pressione, la riduzione della temperatura o entrambe le cose.
- La presenza di un’elevata concentrazione di vapore acqueo nel flusso di gas di produzione può rendere impossibile la produzione di acido cloridrico concentrato in determinate circostanze.
Un approccio proposto per assorbire bassi livelli di acido cloridrico da gas contenenti alti livelli di vapore acqueo è l’utilizzo di una soluzione di cloruro di magnesio.
La scelta dei materiali di costruzione per le apparecchiature di assorbimento dell’acido cloridrico è limitata a causa del potenziale attacco sia dell’acido cloridrico concentrato che degli idrocarburi clorurati. Per raffreddare l’acido vengono utilizzati scambiatori di calore in grafite.
Per le pompe, uno speciale materiale ceramico è tradizionalmente la scelta economicamente praticabile. La colonna di distillazione è rivestita con mattoni o blocchi di grafite resistenti agli acidi, con i mattoni cementati utilizzando resina fenolica.
Un rivestimento in gomma resistente agli acidi viene spesso applicato tra l’involucro in acciaio e la parete in mattoni per prevenire l’attacco dell’acido attraverso pori e crepe.
Le apparecchiature realizzate interamente in resina fenolica presentano un’eccellente resistenza chimica ma sono fragili e meccanicamente fragili, in genere richiedono un supporto, come un guscio esterno in resina poliestere rinforzata con fibra di vetro. Questo tipo di apparecchiatura è adatto per il funzionamento a pressione atmosferica o leggermente superiore.
Considerazioni simili si applicano alla colonna di stripping degli idrocarburi clorurati. Se la concentrazione di idrocarburi clorurati è bassa o sono stati rimossi efficacemente dall’acido, altri materiali come il polivinilcloruro possono essere utilizzati per i contenitori di stoccaggio.
La colonna di desorbimento, tuttavia, è realizzata in grafite a causa dell’elevata temperatura di esercizio. In alternativa, possono essere utilizzate colonne rivestite in gomma con rivestimenti interni in mattoni.
Le colonne in acciaio rivestite con perfluoropolimero, in particolare politetrafluoroetilene (PTFE), hanno mostrato risultati eccellenti, sebbene possano esistere variazioni di prodotto tra i diversi produttori per quanto riguarda microporosità, resistenza allo strappo e proprietà di flusso.
Le colonne in acciaio rivestite offrono vantaggi rispetto alle colonne in grafite in quanto possono funzionare a pressione elevata, ma un guasto del rivestimento in PTFE porterebbe alla rapida distruzione dell’involucro in acciaio. Queste colonne possono essere costruite utilizzando piccoli elementi individuali che possono essere sostituiti rapidamente, riducendo al minimo i tempi di fermo per manutenzione.
Gli scambiatori di calore in tutti i casi sono realizzati in grafite. Sono possibili anche rivestimenti ed evaporatori in tantalio, ma devono essere prese precauzioni per evitare l’infragilimento dovuto all’assorbimento di idrogeno. Inoltre, deve essere assente l’acido fluoridrico.
L’acido cloridrico completamente secco non corrode i tubi in acciaio o i compressori. In passato, per essiccare l’acido cloridrico gassoso si utilizzava l’acido solforico concentrato. Un altro approccio sfrutta le proprietà del sistema HCl-H2O.
A basse temperature, la pressione parziale del vapore dell’acqua sull’acido cloridrico altamente concentrato è molto bassa, consentendo l’essiccazione dell’acido cloridrico raffreddandolo a temperature sufficientemente basse sotto lo zero.
A pressione leggermente elevata (P ≈ 0,3 MPa), raggiungere -10 °C è solitamente sufficiente per risultati soddisfacenti. Tuttavia, la nebbia di acido cloridrico deve essere completamente rimossa per evitare una grave corrosione.
3.2.4. Recupero dall’incenerimento dei rifiuti
Tutti i processi di clorurazione comportano inevitabilmente la formazione di idrocarburi clorurati indesiderati insieme ai prodotti desiderati. Queste sostanze inutilizzabili e spesso dannose devono essere smaltite per motivi ambientali.
Un possibile metodo è l’incenerimento, che converte gli idrocarburi clorurati in acido cloridrico, acqua e anidride carbonica. Il recupero dell’acido cloridrico è essenziale sia per considerazioni economiche che ambientali.
Sebbene le tecniche specifiche impiegate possano variare, il principio di base rimane lo stesso. La combustione avviene in un forno rivestito con materiali refrattari a temperature superiori a 1000 °C.
Gli idrocarburi clorurati di scarto che contengono in genere fino al 70% in peso di cloro tendono a presentare buone proprietà di combustione. Tuttavia, ulteriori aumenti del contenuto di cloro diminuiscono il potere calorifico a tal punto che il processo di combustione richiede l’aggiunta di olio combustibile o gas per supportarlo.
Le condizioni di reazione ottimali rientrano nel seguente intervallo:
1. Deve essere presente un eccesso di ossigeno per garantire la completa decomposizione degli idrocarburi clorurati. Il gas di acido cloridrico risultante può quindi reagire con questo ossigeno secondo l’equazione di Deacon:
2 HCl + 0.5 O2 ↔ Cl2 + H2O
L’aumento della temperatura sposta l’equilibrio verso sinistra, favorendo la formazione di acido cloridrico. La temperatura viene mantenuta il più alta possibile per i materiali da costruzione per impedire la formazione di cloro.
Anche con un’elevata pressione parziale dell’acqua e un basso eccesso di ossigeno, è necessaria una temperatura superiore a 1000 °C per ottenere lo spostamento di equilibrio desiderato. Questo approccio aiuta a mantenere i livelli di cloro in un intervallo accettabile e garantisce una combustione completa.
2. La temperatura di reazione non deve superare i 1200 °C per impedire la formazione di ossidi di azoto. Questi ossidi contaminerebbero il prodotto acido cloridrico e porrebbero sfide per la purificazione dei gas di scarico. L’uso di ossigeno puro al posto dell’aria può essere una possibile soluzione.
Per queste ragioni, l’incenerimento degli idrocarburi clorurati di scarto avviene in genere tra 1000 e 1200 °C. Il raffreddamento dei gas di combustione e la generazione di vapore possono porre sfide relative ai materiali da costruzione. È importante garantire l’assenza di prodotti di combustione corrosivi.
I rifiuti trattati devono avere una composizione ben nota, inclusi i contaminanti in tracce, per prevedere con precisione i prodotti di combustione previsti, le loro concentrazioni e il comportamento. Si preferisce un raffreddamento rapido per impedire la riformazione del cloro, poiché un raffreddamento lento può portare alla sua riformazione.
L’acido cloridrico viene recuperato dai gas di combustione tramite assorbimento. Il processo di recupero è simile a quello utilizzato nei processi di clorurazione, con alcune eccezioni:
- Un processo a secco non è possibile poiché il vapore acqueo è sempre presente.
- I gas devono essere condensati in modo da consentire la formazione dell’acido cloridrico più concentrato possibile. Ciò consente il recupero di acido cloridrico gassoso o acido cloridrico concentrato. L’acido cloridrico diluito ha un valore commerciale limitato.
- Devono essere affrontate particolari sfide di corrosione nei potenziali punti di condensazione acida, che potrebbero non verificarsi regolarmente ma possono comunque presentare dei rischi.
- Se i prodotti di combustione gassosa vengono utilizzati direttamente, la temperatura di esercizio deve essere sempre mantenuta al di sopra della temperatura di condensazione dell’acido cloridrico.
Uno degli impianti più vecchi che produce quantità commerciali di acido cloridrico al 33% in peso tramite l’incenerimento di idrocarburi clorurati si trova a St. Auban, in Francia, gestito da Atochem. Questo impianto, fondato nel 1975, consuma circa 16.000 tonnellate di materiale idrocarburico clorurato all’anno.
3.3. Purificazione dell’acido cloridrico
Il carbone attivo può rimuovere efficacemente varie impurità nel gas di cloruro di idrogeno, tra cui SO2, As e Cl2, tramite adsorbimento. Man mano che l’importanza del processo al solfato diminuisce, la rimozione degli idrocarburi clorurati dal gas di cloruro di idrogeno o dall’acido cloridrico diventa più rilevante nella pratica.
Il cloruro di idrogeno gassoso può essere sottoposto a purificazione mediante lavaggio a bassa temperatura utilizzando un solvente ad alto punto di ebollizione, che potrebbe essere un altro idrocarburo clorurato (ad esempio, esaclorobutadiene o tetracloroetano) o frazioni di olio specifiche. Dopo tale trattamento, l’uso di carbone attivo è spesso superfluo.
Il cloro può essere eliminato utilizzando tetracloruro di carbonio, poiché è significativamente più solubile nel tetracloruro di carbonio rispetto al gas di cloruro di idrogeno.
L’acido cloridrico, sia utilizzato direttamente che per la generazione di cloruro di idrogeno, contiene principalmente impurità volatili come gli idrocarburi clorurati. In tali casi, queste impurità possono essere rimosse dall’acido tramite stripping.
Lo stripping con un flusso di gas inerte è un’opzione fattibile che comporta un consumo energetico inferiore. Tuttavia, nella maggior parte dei casi, si preferisce riscaldare il gas per motivi ambientali. Le impurità inorganiche, in particolare il ferro, possono essere eliminate tramite scambio ionico.
4. Utilizzi dell’acido cloridrico
L’acido cloridrico e l’acido cloridrico sono sostanze chimiche vitali in vari processi industriali.
La maggior parte dell’acido cloridrico viene in genere utilizzata immediatamente dal produttore, poiché il sottoprodotto dei processi di clorurazione organica deve essere completamente utilizzato. Ciò si ottiene tramite tecniche di ossiclorurazione o idroclorurazione o, in alcuni casi, metodi di recupero del cloro come il processo KEL, il processo Deacon modificato o l’elettrolisi dell’acido cloridrico.
L’acido cloridrico acquoso trova ampie applicazioni come acido inorganico forte. Viene impiegato nella produzione di cloruri, nella dissoluzione di minerali, nel decapaggio e nell’incisione di metalli, nella rigenerazione di resine a scambio ionico per il trattamento delle acque, nella neutralizzazione di prodotti alcalini o materiali di scarto, nell’acidificazione della salamoia nell’elettrolisi cloro-alcalina e in molti altri processi industriali.
5. Tossicologia e salute sul lavoro
È noto che l’acido cloridrico causa gravi irritazioni agli occhi, alle vie respiratorie e alla pelle, anche se in misura minore. L’esposizione al suo vapore può causare cheratocongiuntivite e l’inalazione può causare irritazione e danni alle mucose. L’odore dell’acido cloridrico può essere in genere rilevato a concentrazioni di 1-5 ppm, diventando sgradevole a 5-10 ppm.
L’esposizione professionale prolungata ad alti livelli di acido cloridrico può aumentare il rischio di bronchite cronica, disturbi allo stomaco e all’intestino e carie dentale, anche a concentrazioni apparentemente tollerabili. Concentrazioni superiori a 10 ppm possono causare forti irritazioni, anche con l’acclimatamento.
Il personale che lavora con acido cloridrico deve indossare occhiali protettivi, indumenti, guanti di gomma e stivali. Si deve evitare l’inalazione del vapore e si raccomandano filtri respiratori progettati per gas inorganici.
Nella Repubblica Federale Tedesca, le normative per il controllo delle sostanze pericolose si applicano all’acido cloridrico e all’acido cloridrico (>10% in peso), in conformità con le direttive CEE. Tali normative specificano simboli di pericolo, istruzioni di sicurezza e precauzioni per la manipolazione di queste sostanze.
In caso di contatto con la pelle o gli occhi, è essenziale un risciacquo immediato e accurato con acqua. Gli indumenti contaminati devono essere trattati in modo simile e possono essere utilizzate soluzioni detergenti alcaline.
Quando si lavora con l’acido cloridrico, in particolare a pressione elevata, è fondamentale avere a portata di mano un respiratore con alimentazione d’aria indipendente e indumenti protettivi completi in caso di incidenti.
In Germania, la concentrazione massima consentita (MAK) per l’acido cloridrico è di 5 ppm in volume, equivalenti a 7 mg/m³. Gli stessi valori servono come valore limite di soglia (TLV) negli Stati Uniti. Nell’Unione Sovietica, il limite stabilito è di 3 ppm (5 mg/m³).
Le normative sull’aria pulita specificano limiti di concentrazione per l’acido cloridrico nell’atmosfera, come 0,1 mg/m³ come media annuale e 0,2 mg/m³ per brevi periodi. Diverse specie di piante mostrano diverse tolleranze all’esposizione all’acido cloridrico.
Per quanto riguarda i gas di scarico industriali, la concentrazione di acido cloridrico non dovrebbe generalmente superare i 30 mg/m³ secondo le normative tedesche, sebbene il limite sia di 50 mg/m³ per gli impianti di incenerimento dei rifiuti. Il costo della pulizia dei gas può variare notevolmente di conseguenza.
Lo scrubbing con acqua è spesso sufficiente per la rimozione dell’acido cloridrico, ma potrebbero essere necessarie più fasi, tra cui uno scrubbing finale con una soluzione alcalina.
In alcuni casi, non è possibile produrre acido cloridrico commerciale e l’acido diluito viene neutralizzato prima dello smaltimento nelle acque reflue. La neutralizzazione con soda caustica può occasionalmente produrre una soluzione salina sufficientemente pura per il riciclaggio in un impianto di cloro.
Riferimento
- Hydrochloric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_283
