Óxido de zinc: propiedades, producción y usos

¿Qué es el óxido de zinc?
El óxido de zinc es un compuesto inorgánico con la fórmula química ZnO. Se presenta en forma de polvo blanco insoluble en agua. Si bien se encuentra en la naturaleza como el mineral zincita, la mayor parte del óxido de zinc comercial se produce sintéticamente.
Anteriormente, el óxido de zinc solo se utilizaba como pigmento blanco, conocido con diversos nombres, como blanco de zinc (C.I. Pigmento Blanco 4), blanco chino y flores de zinc.
El óxido de zinc surgió como subproducto de la fundición del cobre. Los antiguos romanos lo llamaban «cadmia» y lo utilizaban en la producción de latón. También lo refinaban mediante un proceso de reducción-oxidación para la elaboración de ungüentos medicinales. Los alquimistas medievales creían que la cadmia podía convertirse en oro.
A mediados del siglo XVIII, el químico alemán Cramer produjo óxido de zinc mediante la combustión de zinc metálico. Courtois inició la producción de blanco de zinc en Francia en 1781. Sin embargo, la fabricación a escala industrial no comenzó hasta 1840 con Leclaire, utilizando el proceso indirecto o francés.
El óxido de zinc sustituyó rápidamente al albayalde debido a sus propiedades superiores, como la no toxicidad, la resistencia a la decoloración por gases sulfurosos y la buena opacidad.
Alrededor de 1850, S. Wetherill, de la New Jersey Zinc Company, desarrolló un horno de tostación en el que se cargaba carbón en una parrilla y luego se cubría con una mezcla de mineral de zinc y carbón. El zinc se reducía mediante la combustión parcial del carbón y luego se reoxidaba al salir del horno.
Este método se conoció como el proceso directo o americano. Si bien estos hornos experimentaron mejoras posteriores, ya no se utilizan.
En la segunda mitad del siglo XIX, se incorporó óxido de zinc a las formulaciones de caucho para reducir el tiempo de vulcanización. El descubrimiento de aceleradores orgánicos en 1906 mejoró significativamente el proceso de vulcanización, aumentando así la importancia del óxido de zinc, que se utilizaba como activador en la industria del caucho.
Tabla de contenido
1. Propiedades físicas del óxido de zinc
El óxido de zinc es un polvo blanco fino que vira a amarillo al calentarse por encima de 300 °C. Absorbe la luz ultravioleta (UV) en longitudes de onda inferiores a 366 nm.
La introducción de trazas de elementos monovalentes o trivalentes en su red cristalina le confiere propiedades semiconductoras. Las partículas elementales de ZnO producidas mediante métodos térmicos pueden ser granulares, nodulares (0,1-5 µm) o aciculares (con forma de aguja).
El ZnO es insoluble en agua, con una solubilidad de aproximadamente 0,16 mg/100 mL a 30 °C; sin embargo, se disuelve en ácidos diluidos y bases fuertes debido a su naturaleza anfótera.
Las propiedades físicas importantes del óxido de zinc se resumen en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número CAS | [1314-13-2] |
| Fórmula química | ZnO |
| Peso molecular | 81,38 g/mol |
| Punto de fusión | 1975 °C |
| Punto de ebullición | aproximadamente 2360 °C |
| Densidad | 5,65–5,68 g/cm³ |
| Índice de refracción | 1,95–2,1 |
| Capacidad térmica a 25 °C | 40,26 J mol-1 K-1 |
| Capacidad térmica a 100 °C | 44,37 J mol-1 K-1 |
| Capacidad térmica a 1000 °C | 54,95 J mol-1 K-1 |
| Conductividad térmica | 25,2 W m-1 K-1 |
| Estructura cristalina | hexagonal, wurtzita |
| Dureza de Mohs | 4–4,5 |
| Valor de absorción de aceite | 20–24 g/100 g |
| Densidad aparente | 100 cm3/100 g |
| Tamaño medio de partícula | 0,11–0,22 mm |
| Área superficial BET | 3–10 m2/g |
2. Propiedades químicas del óxido de zinc
El óxido de zinc es anfótero. Reacciona con ácidos orgánicos e inorgánicos. También se disuelve en soluciones alcalinas y amoníaco para formar cincatos. El ZnO reacciona fácilmente con gases ácidos, como el dióxido de carbono, el dióxido de azufre y el sulfuro de hidrógeno. Las reacciones a alta temperatura con otros óxidos producen compuestos como las ferritas de zinc.
Reacciona con ácidos para producir sales de zinc y agua. Esto representa una reacción de neutralización donde el ZnO actúa como base.
ZnO + 2 HCl → ZnCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2 HNO3 → Zn(NO3)2 + H2O
El óxido de zinc reacciona con bases fuertes para formar cincatos solubles. El ZnO funciona como ácido en estas reacciones.
ZnO + 2 NaOH → Na2ZnO2 + H2O (zincato de sodio)
El óxido de zinc puede reducirse a zinc metálico mediante el uso de altas temperaturas y un agente reductor. Es un paso estándar en la extracción de minerales de zinc.
El carbón (coque) reduce el óxido de zinc a zinc metálico, y el carbono se oxida a monóxido de carbono. Esta reacción tiene importancia histórica e industrial.
El hidrógeno o metales reactivos como el magnesio también pueden reducir el óxido de zinc.
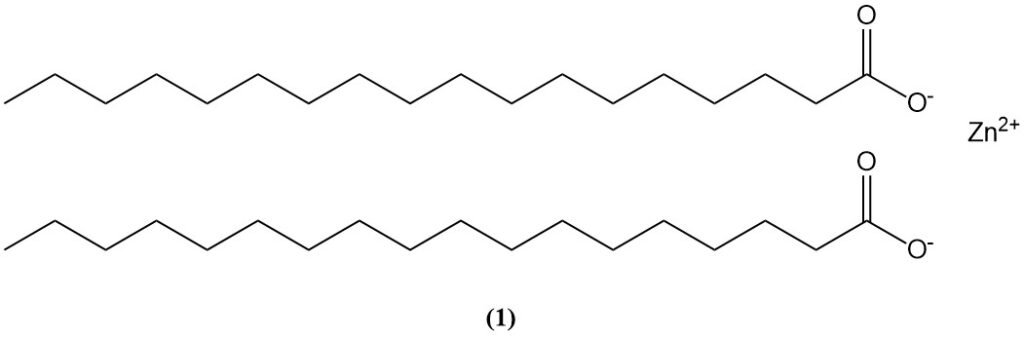
El óxido de zinc reacciona con muchos compuestos orgánicos, especialmente ácidos carboxílicos y ácidos grasos (p. ej., ácido esteárico, presente en aceites y formulaciones de caucho), para formar carboxilatos de zinc (jabones de zinc).
El estearato de zinc (1), formado por la reacción del ácido esteárico con óxido de zinc, se utiliza como activador acelerador y también puede contribuir a la degradación de pinturas al óleo que contienen pigmento ZnO.
El óxido de zinc es térmicamente estable, pero puede disociarse a temperaturas extremadamente altas. Esta descomposición térmica es un paso clave en ciertos ciclos termoquímicos para la producción de hidrógeno.
3. Producción Industrial de Óxido de Zinc
Industrialmente, el óxido de zinc se produce principalmente mediante dos procesos principales: el Proceso Indirecto (Proceso Francés) y el Proceso Directo (Proceso Americano). También se produce una cantidad menor mediante procesos químicos húmedos.
El proceso húmedo representa aproximadamente entre el 1% y el 2% de la producción de óxido de zinc. El proceso directo contribuye entre el 10% y el 20%, y el proceso indirecto produce la mayor parte restante.
Históricamente, las materias primas para el proceso directo consistían principalmente en minerales o concentrados de zinc. El proceso indirecto utilizaba zinc metálico virgen de los productores. La fabricación actual de óxido de zinc utiliza predominantemente residuos y zinc secundario.
Este hecho, sumado a las demandas de los usuarios de una alta pureza química, condujo a modificaciones del proceso y al uso de diversas técnicas de purificación.
3.1. Producción de óxido de zinc mediante proceso directo o americano
El proceso directo, o americano, para la producción de óxido de zinc se caracteriza por su simplicidad, rentabilidad y alta eficiencia térmica. Implica la reducción inicial a alta temperatura (1000-1200 °C) de materiales que contienen zinc. Se utiliza carbón como agente reductor. La reducción se produce según las reacciones de Boudouard:
ZnO + C ⇌ Zn + CO
ZnO + CO ⇌ Zn + CO
2 C + O2 ⇌ CO
2 CO2 + C ⇌ 2 CO
El vapor de zinc y el gas de monóxido de carbono se oxidan posteriormente para formar óxido de zinc y dióxido de carbono sobre el lecho de reacción o a la salida del horno.
Se utilizan diversas materias primas que contienen zinc. Estos incluyen concentrados de zinc, residuos de metalización, subproducto hidróxido de zinc y, principalmente, escoria de zinc procedente de hornos de fundición o de operaciones de galvanización. La escoria debe pretratarse mediante calentamiento a aproximadamente 1000 °C en hornos rotatorios para eliminar las impurezas de cloruro y plomo.
Actualmente, solo se emplean hornos rotatorios para el proceso directo. Los hornos estáticos ya no se utilizan. Las materias primas suelen contener zinc en un rango de entre el 60 % y el 75 %. Existen dos tipos principales de hornos rotatorios: hornos largos y estrechos y hornos más cortos y anchos.
1. Hornos largos y estrechos: Estos hornos tienen aproximadamente 30 m de longitud y 2,5 m de diámetro, y se calientan con gas o petróleo. La materia prima, una mezcla de sustancia que contiene zinc y carbón, se alimenta continuamente a contracorriente o en paralelo a los gases de combustión.
Los residuos, que contienen zinc residual y carbón sin quemar, salen continuamente del horno por el extremo opuesto al punto de alimentación. El carbón sobrante se tamiza y se recicla. Los gases de combustión, compuestos por vapor de zinc, ZnO y CO, entran en una cámara donde se completa la oxidación y sedimentan las partículas de impurezas grandes.
A continuación, los gases se enfrían mediante un intercambiador de calor o dilución con aire. El óxido de zinc se recoge posteriormente en filtros de mangas.
2. Hornos más cortos y anchos: Este tipo de horno rotatorio tiene aproximadamente 5 m de longitud y 3 m de diámetro. La carga de materias primas es continua; sin embargo, los residuos descincados se eliminan por lotes.
Las condiciones de operación de ambos tipos de horno se controlan con precisión para garantizar un alto rendimiento y la obtención de la forma y el tamaño de partícula deseados. La pureza química, suponiendo que no haya contaminación externa, está determinada únicamente por la composición de las materias primas iniciales.
3.2. Producción de óxido de zinc mediante el proceso indirecto o francés
En el proceso indirecto o francés, el zinc se hierve y el vapor de zinc formado se oxida por combustión en aire bajo parámetros controlados. Las propiedades cristalográficas y físicas del óxido de zinc generado pueden ajustarse modificando las condiciones de combustión, como la turbulencia de la llama y el exceso de aire.
La composición química del producto de ZnO depende exclusivamente de la composición del vapor de zinc.
Diversos tipos de hornos facilitan la producción de vapor de zinc con la pureza requerida a partir de diversas materias primas, lo que garantiza un alto rendimiento de zinc.
Las materias primas utilizadas en este proceso incluyen zinc puro (de grado superalto, SHG; de grado alto, HG) y, cada vez más, residuos metálicos (por ejemplo, chatarra de zinc, escoria de fundición a presión, escoria de galvanizado). Antes de la oxidación, las técnicas de separación en fase líquida o en fase de vapor eliminan impurezas como cadmio, plomo, hierro y aluminio del zinc metálico.
Los métodos específicos para la vaporización y purificación del zinc incluyen:
1. Hornos de mufla o retortas (grafito/carburo de silicio): La materia prima metálica se introduce en el horno en lotes sólidos o en corrientes líquidas continuas. El calor de vaporización se suministra mediante el calentamiento externo de la retorta con un quemador.
Los residuos no volátiles, como el hierro y el plomo de las escorias de fundición, se acumulan en la retorta. Es necesario retirarlos periódicamente, a menudo mediante la inclinación de las retortas.
2. Destilación fraccionada: El vapor de zinc, que contiene impurezas como Cd, Pb, Fe, Al y Cu, puede purificarse mediante destilación fraccionada. Este proceso se lleva a cabo en columnas, a menudo equipadas con placas de carburo de silicio (p. ej., el diseño de New Jersey Zinc Co.). La oxidación del vapor de zinc purificado tiene lugar a la salida de la columna.
3. Hornos de dos cámaras: La materia prima metálica, principalmente en trozos grandes, entra en una cámara de fusión primaria, que conecta con una cámara secundaria calentada eléctricamente. La destilación se realiza en la segunda cámara, en un entorno sin aire.
Los residuos no metálicos se extraen de la superficie de la cámara de fusión. Las impurezas, como el hierro, el aluminio y una parte del plomo, se acumulan en la cámara de destilación y se eliminan periódicamente en forma líquida. Las trazas de plomo residuales se eliminan posteriormente mediante destilación fraccionada. Lundevall desarrolló la primera versión de este tipo de horno.
4. Proceso de fundición en horno rotatorio: El óxido de zinc indirecto también puede producirse mediante un proceso de fundición en un horno rotatorio, utilizando las mismas materias primas. La fusión, la destilación y una parte de la oxidación se producen en una única zona de reacción, lo que permite aprovechar gran parte del calor de combustión del zinc.
Controlando la temperatura y las presiones parciales de dióxido de carbono y oxígeno, se puede limitar el contenido de impurezas de plomo y ajustar la forma y el tamaño de las partículas de ZnO, aunque con menor precisión que con otros métodos.
3.3. Producción de óxido de zinc por vía húmeda
El óxido de zinc se produce por vía húmeda, que precipita carbonato de zinc básico a partir de soluciones purificadas de sulfato o cloruro de zinc. El precipitado se lava y filtra, y luego se calcina para formar óxido de zinc. Este método produce ZnO con una alta superficie específica.
Se obtienen productos similares a partir de hidróxidos residuales, que se purifican químicamente y luego se calcinan.
3.4. Postratamiento
El postratamiento térmico, a temperaturas de hasta 1000 °C, mejora las propiedades pigmentarias del ZnO y se aplica principalmente al óxido producido mediante el método directo. La calcinación atmosférica controlada mejora aún más las propiedades fotoconductoras del óxido de alta pureza. Este óxido de alta pureza se utiliza en aplicaciones de fotocopiado.
La superficie del óxido de zinc puede hacerse más organófila recubriéndola con aceite y ácido propiónico. El óxido de zinc suele someterse a desaireación. En ocasiones se peletiza o granula para mejorar sus propiedades de manipulación.
| A | B | C | D | |
|---|---|---|---|---|
| Parámetro | Proceso indirecto | Proceso indirecto | Proceso directo | Proceso húmedo |
| ZnO (mín.), % en peso | 99,5 | 99 | 98,5 | 93 |
| Pb (máx.), % en peso | 0,004 | 0,25 | 0,25 | 0,001 |
| Cd (máx.), % en peso | 0,001 | 0,05 | 0,03 | 0,001 |
| Cu (máx.), % en peso | 0,0005 | 0,003 | 0,005 | 0,001 |
| Mn (máx.), % en peso | 0,0005 | 0,001 | 0,005 | 0,001 |
| Sales solubles en agua (máx.), % en peso | 0,02 | 0,1 | 0,65 | 1 |
| Pérdida por ignición (máx.), % en peso | 0,3 | 0,3 | 0.3 | 4 |
| Acidez, g H2SO4/100 g | 0,01 | 0,1 | 0,3 | 0,2 |
| Superficie específica, m2/g | 3–8 | 3–10 | 1–5 | 25 (mín.) |
4. Usos del óxido de zinc

El óxido de zinc tiene múltiples usos. El más importante, con diferencia, se encuentra en la industria del caucho. Casi la mitad del ZnO mundial se utiliza como activador de aceleradores de vulcanización en caucho natural y sintético.
4.1. Uso de óxido de zinc en la producción de caucho natural y sintético
La adición de óxido de zinc a compuestos de caucho que contienen azufre y aceleradores aumenta la densidad de reticulación. Para cauchos de uso general, como el caucho natural y el caucho de estireno-butadieno, dosis de ZnO de hasta aproximadamente 5 phr (partes por cien de caucho) producen altos valores de resistencia a la tracción y tensión. Dosis mayores no mejoran aún más estas propiedades.
Los ácidos grasos activan el sistema caucho-azufre-acelerador-óxido de zinc. El ácido esteárico o estearato de zinc se utiliza comúnmente. La adición de sales de zinc específicas, además de ZnO, puede aumentar la densidad de reticulación y mejorar el comportamiento de reversión.
La reactividad del óxido de zinc depende de su superficie específica, pero la presencia de impurezas, como plomo y sulfatos, también influye en ella. El óxido de zinc garantiza una buena durabilidad del caucho vulcanizado y aumenta su conductividad térmica. Normalmente, el contenido de ZnO oscila entre el 2 % y el 5 %.
4.2. Uso del óxido de zinc en pinturas y revestimientos
El óxido de zinc ya no es el pigmento blanco principal en pinturas y revestimientos. Sin embargo, los artistas aún lo utilizan por su excelente color blanco. Se utiliza como aditivo en pinturas para la conservación de la madera en exteriores y en pinturas antiincrustantes y anticorrosivas.
El óxido de zinc suele combinarse con otros pigmentos anticorrosivos activos. Su propiedad inhibidora se basa en su capacidad para reaccionar con sustancias corrosivas y mantener un pH alcalino dentro del revestimiento. También reacciona con componentes ácidos del aglutinante para formar jabones y absorbe la luz ultravioleta (UV).
El contenido de plomo del óxido de zinc comercial varía según el fabricante, entre el 0,002 % y el 1,5 %. Un recubrimiento de óxido de zinc sin plomo requiere un contenido de plomo inferior al 1,5 %.
El óxido de zinc mejora la formación de la película, la durabilidad y la resistencia al moho. Presenta un efecto sinérgico con otros fungicidas, ya que puede reaccionar con los productos ácidos de la oxidación y absorber la radiación UV.
4.3. Uso del óxido de zinc en las industrias farmacéutica y cosmética
Las industrias farmacéutica y cosmética utilizan el óxido de zinc en polvos y ungüentos por sus propiedades bactericidas. También se utilizaba para formar cementos dentales mediante la reacción con eugenol, pero ahora se utiliza con poca frecuencia.
Los componentes reactivos, ZnO y eugenol (80-96 % en peso), se presentan en dos pastas. Los aceites (p. ej., aceite de oliva, aceite mineral) y los rellenos (p. ej., talco, caolín, colofonia, vaselina) ajustan la consistencia. El acetato de zinc y el cloruro de magnesio se utilizan como aceleradores de la formación de eugenolato de zinc.
El óxido de zinc también se utiliza como aditivo protector de los rayos UV en cosméticos. Se utiliza como protector solar en la capa córnea. Actúa como filtro físico de luz, principalmente reflejando y dispersando la radiación UVA y UVB, proporcionando una protección de amplio espectro. El ZnO micronizado y a escala nanométrica se utiliza a menudo para reducir el residuo blanco visible.
Se utiliza como pigmento blanco para la producción de polvos de colores y pigmentos perlados, como las sombras de ojos en polvo.
El óxido de zinc se utiliza en diversos productos para la piel por sus propiedades calmantes, astringentes y antisépticas. Algunos ejemplos incluyen cremas para la dermatitis del pañal, lociones de calamina, ungüentos antisépticos y tratamientos para el acné.
4.4. Uso del óxido de zinc en la industria cerámica y del vidrio
El óxido de zinc se utiliza en la industria del vidrio, la cerámica y los esmaltes para reducir los puntos de fusión y mejorar el brillo, la luminosidad y la resistencia al agrietamiento (evitando el agrietamiento y la vibración). También se puede utilizar para modificar el brillo o mejorar la opacidad.
Concentraciones más altas de ZnO pueden producir superficies mate y cristalinas. Su alta capacidad calorífica y conductividad térmica son beneficiosas para la producción cerámica.
4.5. Uso del óxido de zinc como materia prima
El óxido de zinc se utiliza como materia prima para diversos productos, como estearatos, fosfatos, cromatos, bromatos, ditiofosfatos orgánicos y ferritas (ZnO, MnO, Fe2O3). También se utiliza en la electrogalvanización (específicamente en formulaciones de baños de cianuro).
El óxido de zinc se utiliza como fuente de zinc en piensos y también para la desulfuración de gases.
El óxido de zinc se utiliza como catalizador en síntesis orgánicas, como la producción de metanol, a menudo junto con otros óxidos. También es un componente de algunos adhesivos.
4.6. Uso del óxido de zinc en electrónica
El ZnO de máxima pureza, calcinado con aditivos como el óxido de bismuto (Bi2O3), se utiliza en la producción de varistores, que se caracterizan por una resistencia dependiente del voltaje, es decir, un comportamiento no óhmico.
Una composición típica incluye 96,5 % en masa de ZnO, 0,5 % de Bi2O3, 1 % de CoO, 0,5 % de MnO, 1 % de Sb2O3 y 0,5 % de Cr2O3. El comportamiento no óhmico se debe a los granos semiconductores de ZnO y a una fina fase aislante en el límite de grano.
Un varistor de óxido metálico basado en ZnO dopado con bismuto es superior a los varistores clásicos de carburo de silicio (SiC) porque sus características de tensión-corriente tienen una pendiente mucho menor, lo que resulta en un aumento de tensión mucho menor por unidad de aumento de corriente.
Las propiedades fotoconductoras del ZnO se utilizan en procesos de fotorreproducción. Doparlo con alúmina reduce la resistencia eléctrica, por lo que puede utilizarse en recubrimientos de papeles maestros para reproducción offset.
El óxido de zinc es un semiconductor de banda ancha (3,3 eV). Esta propiedad lo hace adecuado para:
- Láseres UV y LED, especialmente para aplicaciones optoelectrónicas de longitud de onda corta.
- Sensores de gas, debido a su sensibilidad a diversos gases.
- Electrodos conductores transparentes en dispositivos como células solares (p. ej., como capa amortiguadora en células solares CIGS).
- Transistores y diodos.
- Dispositivos piezoeléctricos, explorados para sensores y captación de energía.
5. Toxicología del óxido de zinc
A diferencia de otros metales pesados, el zinc no está clasificado como inherentemente tóxico ni peligroso. Es un elemento esencial para la fisiología humana, animal y vegetal. El cuerpo humano contiene aproximadamente 2 g de zinc. Se recomienda una ingesta diaria de 10 a 20 mg.
La DL50 oral para ratas es de 630 mg/kg. Las concentraciones de polvo de óxido de zinc en el aire del lugar de trabajo se permiten en 5 mg/m³ (MAK) y 10 mg/m³ (TLV-TWA). Para los humos de óxido de zinc, los valores son de 5 mg/m³ (TLV-TWA) y 10 mg/m³ (TLV-STEL).
Los límites de exposición ocupacional (LEO) para el óxido de zinc se detallan en la Tabla 3.
| País | TWA 8 h, mg/m3 | STEL 15 min, mg/m3 | Referencias |
|---|---|---|---|
| EE. UU. | 5 (humos), 10 (polvo) | 10 (humos) (límite superior) | ACGIH (1991, valores orientativos) |
| EE. UU. | 5 (humos), 15 (polvo; total), 5 (polvo; respirable) | OSHA (1989, valores límite legales) | |
| Países Bajos | 5 (humos) | SZW (1997) | |
| Alemania | 5 (humos), 6 (polvo) | DFG (1997) | |
| Reino Unido | 5 (humos), 10 (polvo) | HSE (1998) | |
| Suecia | 5 (humos) | Junta Nacional de Seguridad y Salud en el Trabajo, Suecia (1993) | |
| Dinamarca | 4 (humos), 10 (polvo) | Arbejdstilsynet (1992) |
La ingestión o inhalación accidental de grandes cantidades de ZnO puede provocar fiebre, náuseas e irritación de las vías respiratorias después de varias horas. Estos síntomas son transitorios y desaparecen rápidamente sin consecuencias a largo plazo.
Referencias
- Pigments, Inorganic, 2. White Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n01.pub2
- Rubber, 9. Chemicals and Additives. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a23_365.pub3
- Pigments, Inorganic, 5. Anticorrosive Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n04
- Pigments, Inorganic, 7. Transparent Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n06
- Dental Materials. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_251.pub2
- Skin Cosmetics. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_219
- Ceramics, Electronic. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_079.pub2
- The effect of formulation on the penetration of coated and uncoated zinc oxide nanoparticles into the viable epidermis of human skin in vivo
- Zinc Compounds. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a28_537.pub2
