Dióxido de titanio: una visión completa

¿Qué es el dióxido de titanio?
El dióxido de titanio es un compuesto inorgánico con la fórmula química TiO2. Es un sólido blanco insoluble en agua. El dióxido de titanio se encuentra en la naturaleza como polimorfos de rutilo, anatasa y brookita.
El rutilo y la anatasa se utilizan industrialmente para producir pigmentos, catalizadores, cerámicas y otros materiales técnicos.
El dióxido de titanio es el pigmento blanco más importante debido a sus excepcionales propiedades de dispersión, alta estabilidad química y ausencia de toxicidad. En 2007, se produjeron aproximadamente 5 millones de toneladas métricas de pigmentos de dióxido de titanio.
El dióxido de titanio se encuentra entre los cinco principales productos químicos inorgánicos en términos de importancia económica, con ventas anuales globales que superan los 12 mil millones de dólares.
La producción de dióxido de titanio aumentó de 1,389 millones de toneladas en 1965 a 3,220 millones de toneladas en 1995. El proceso de sulfato dominó la producción inicial (90,3 % en 1965), pero disminuyó al 46,0 % en 1995, a medida que el proceso de cloruro se expandió del 9,7 % al 54,0 %. La capacidad de producción alcanzó los 5,915 millones de toneladas en 2008, con el proceso de cloruro manteniendo un ligero predominio del 53,2 % frente al 46,8 % del proceso de sulfato.
Tabla de contenido
1. Propiedades físicas del dióxido de titanio
El dióxido de titanio existe en tres formas cristalinas: rutilo, anatasa y brookita. El rutilo es la forma más estable termodinámicamente. A pesar de ello, la anatasa y la brookita poseen energías reticulares similares, lo que contribuye a su estabilidad a largo plazo. La anatasa se convierte irreversiblemente en rutilo por encima de los 700 °C. La brookita tiene usos industriales limitados debido a su dificultad de producción.
En las tres formas de dióxido de titanio, cada átomo de titanio está coordinado octaédricamente por seis átomos de oxígeno, y cada átomo de oxígeno está coordinado trigonalmente por tres átomos de titanio. Las tres estructuras cristalinas corresponden a diferentes formas de enlace de los octaedros en sus vértices y aristas.
La Tabla 1 muestra las constantes de red cristalina y las densidades de estas modificaciones de TiO2.
El rutilo y la anatasa cristalizan en el sistema tetragonal, mientras que la brookita cristaliza en el sistema rómbico. El dióxido de titanio funde aproximadamente a 1800 °C. Por encima de 1000 °C, la presión parcial de oxígeno aumenta debido a la liberación de oxígeno y la formación de óxidos de titanio inferiores. Este proceso induce cambios de color y altera la conductividad eléctrica. Por encima de 400 °C, aparece una coloración amarilla reversible debido a la expansión térmica de la red.
El rutilo presenta la mayor densidad y empaquetamiento atómico, lo que resulta en una dureza superior (Mohs 6,5-7,0) en comparación con la anatasa (Mohs 5,5-6,0). Los aditivos pueden influir significativamente en la dureza de estos materiales en aplicaciones prácticas.
Su alto índice de refracción, combinado con una mínima absorción en el espectro visible, convierte al dióxido de titanio en un pigmento blanco excepcional. Los índices de refracción promedio son de 2,55 para la anatasa y 2,80 para el rutilo, que dependen de la longitud de onda.
El dióxido de titanio es un semiconductor fotosensible que absorbe la radiación electromagnética ultravioleta cercana. La energía de banda prohibida, que representa la diferencia de energía entre las bandas de valencia y conducción, es de 3,03 eV para el rutilo y de 3,15 eV para la anatasa, que corresponden a los bordes de absorción a 415 nm y 385 nm, respectivamente.
Según el punto de inflexión de la curva de absorción, estos valores son 3,13 eV (397 nm) para el rutilo y 3,29 eV (377 nm) para la anatasa. Las impurezas traza, como las partes por millón de hierro, pueden causar absorción de la luz visible y provocar una desviación del blanco puro.
La absorción de energía luminosa excita un electrón de la banda de valencia a la banda de conducción. El electrón móvil y el hueco de electrón resultantes pueden migrar a la superficie del sólido, donde pueden participar en reacciones redox.
| Fase | N.º de registro CAS | Sistema cristalino | Constantes de red, nm | Densidad, g/cm3 |
|---|---|---|---|---|
| Rutilo | [1317-80-2] | tetragonal | a = 0,4594, c = 0,2958 | 4,21 |
| Anatasa | [1317-70-0] | tetragonal | a = 0.3785, c = 0.9514 | 4.06 |
| Brookita | [12188-41-9] | rómbica | a = 0.9184, b = 0.5447, c = 0.5145 | 4.13 |
2. Propiedades químicas del dióxido de titanio
El dióxido de titanio presenta propiedades anfóteras con características ácidas y básicas débiles. Por lo tanto, los titanatos de metales alcalinos y los ácidos titánicos libres son inestables en ambientes acuosos y se hidrólisis para formar hidróxidos de óxido de titanio amorfos.
El dióxido de titanio es químicamente muy estable y no reacciona con la mayoría de los reactivos orgánicos e inorgánicos. Se disuelve en ácido sulfúrico concentrado tras un calentamiento prolongado y en ácido fluorhídrico. Las sustancias alcalinas y ácidas fundidas también lo atacan y lo disuelven.
A temperaturas elevadas, el TiO2 reacciona con agentes reductores como el monóxido de carbono, el hidrógeno y el amoníaco para producir óxidos de titanio de baja valencia sin formación de titanio metálico. Por encima de 500 °C, el dióxido de titanio reacciona con cloro en presencia de carbono para generar tetracloruro de titanio.
3. Propiedades superficiales de los pigmentos de dióxido de titanio
Las áreas superficiales específicas del dióxido de titanio comercial varían de 0,5 a >300 m²/g, según las aplicaciones. Los pigmentos estándar presentan áreas superficiales de 5 a 30 m²/g.
La superficie del dióxido de titanio está cubierta naturalmente por agua coordinadamente enlazada para formar grupos hidroxilo, lo que polariza la superficie del dióxido de titanio sin recubrimiento. La cobertura superficial de hidroxilo influye en las características del pigmento, como la dispersabilidad y la resistencia a la intemperie.
La presencia de estos grupos hidroxilo superficiales posibilita diversas reacciones fotoquímicas, como la descomposición fotocatalítica del agua en hidrógeno y oxígeno, y la reducción del nitrógeno a amoníaco e hidracina.
4. Producción industrial de dióxido de titanio
El dióxido de titanio comercial se produce principalmente mediante dos métodos industriales distintos: el proceso del sulfato y el proceso del cloruro. Ambos métodos están diseñados para formar pigmentos de dióxido de titanio.
El proceso del sulfato es una técnica más antigua que comienza con la reacción de materias primas ricas en titanio, como la ilmenita, con ácido sulfúrico concentrado a altas temperaturas (150-220 °C). Esta reacción crea una solución que contiene titanio, hierro y otras impurezas. Mediante pasos posteriores de hidrólisis y purificación, se precipita un hidrato de óxido de titanio. Este hidrato se calcina (se calienta a altas temperaturas), se muele y, a menudo, se recubre para obtener el pigmento final.
El proceso de cloruro implica la cloración de materias primas que contienen titanio, como la ilmenita o el rutilo, a temperaturas aún más altas (700–1200 °C). Esto produce tetracloruro de titanio (TiCl4), que posteriormente se oxida a 900–1400 °C para formar dióxido de titanio. Al igual que en el proceso de sulfato, el TiO2 resultante se muele y se recubre.
Cabe destacar que, si bien estos dos procesos dominan la producción de pigmentos, existen otros métodos especializados para producir dióxido de titanio sin propiedades pigmentarias, en particular para la síntesis de nanopartículas. Estos métodos alternativos incluyen técnicas como la hidrólisis de alcoholatos de titanio o la reacción pirolítica del tetracloruro de titanio con agua.
Para obtener información detallada sobre los procesos de producción de dióxido de titanio, visite el siguiente artículo.
4.1. Producción de dióxido de titanio mediante el proceso de sulfato
El proceso de sulfato para la producción de dióxido de titanio consta de una serie de etapas que comienzan con la molienda de las materias primas que contienen titanio hasta obtener un polvo fino (menos de 40 μm) tras el secado. A continuación, se realiza la digestión, donde el material molido se mezcla con ácido sulfúrico concentrado (80-98 %) a altas temperaturas (hasta 220 °C), lo que da como resultado una masa sólida de digestión.
Esta masa sólida se disuelve y se reduce en agua fría o ácido diluido para formar una solución de dióxido de titanio, donde el hierro trivalente se reduce a hierro divalente para evitar la contaminación. A continuación, la solución se clarifica para eliminar todos los sólidos no disueltos mediante sedimentación y filtración. En las soluciones derivadas de ilmenita, el sulfato de hierro se cristaliza mediante enfriamiento para reducir su concentración.
El paso clave es la hidrólisis, donde el hidrato de óxido de titanio se precipita de la solución a 94-110 °C, a menudo utilizando núcleos para controlar las propiedades de las partículas. Este hidrolizado se purifica posteriormente mediante reducción (blanqueo) con agentes como polvo de zinc o aluminio para eliminar las impurezas coloreadas restantes, seguido de una segunda filtración y lavado.
Antes del paso final de calentamiento, el hidrato se dopa con compuestos de metales alcalinos y ácido fosfórico, y en ocasiones con núcleos de rutilo y estabilizadores, para lograr características pigmentarias específicas.
Finalmente, el hidrato dopado se calcina en hornos rotatorios a 800-1100 °C para eliminar el agua y el ácido sulfúrico residual y convertirlo en dióxido de titanio cristalino. El clínker resultante se muele (en húmedo o seco) para lograr la finura de pigmento deseada.
4.2. Producción de dióxido de titanio mediante el proceso de cloruro
El proceso de cloruro para producir pigmento de dióxido de titanio comienza con la cloración, donde las materias primas que contienen titanio y el coque de petróleo reaccionan con cloro y oxígeno en un reactor de lecho fluidizado a altas temperaturas (800-1200 °C) para producir tetracloruro de titanio (TiCl4).
Los gases de reacción calientes resultantes se enfrían, primero para separar otros cloruros sólidos y polvo del TiCl4, y luego para condensar la mayor parte del tetracloruro de titanio enfriándolo por debajo de 0 °C.
El TiCl4 condensado se purifica posteriormente por destilación para eliminar los cloruros sólidos y las impurezas disueltas, como el cloro, el tetracloruro de vanadio y el fosgeno, y así garantizar un producto de tetracloruro de titanio de alta pureza.
Finalmente, el vapor de TiCl4 purificado se calienta y reacciona con oxígeno precalentado a temperaturas muy altas (900–1400 °C) en un reactor especialmente diseñado. Esta reacción produce pigmento de dióxido de titanio y cloro gaseoso.
El pigmento de TiO2 se separa posteriormente de la corriente de gas, y el cloro gaseoso suele reciclarse de nuevo a la etapa de cloración. La calidad del pigmento (tamaño y distribución de las partículas) se controla cuidadosamente mediante factores como la temperatura de reacción y la adición de compuestos específicos.
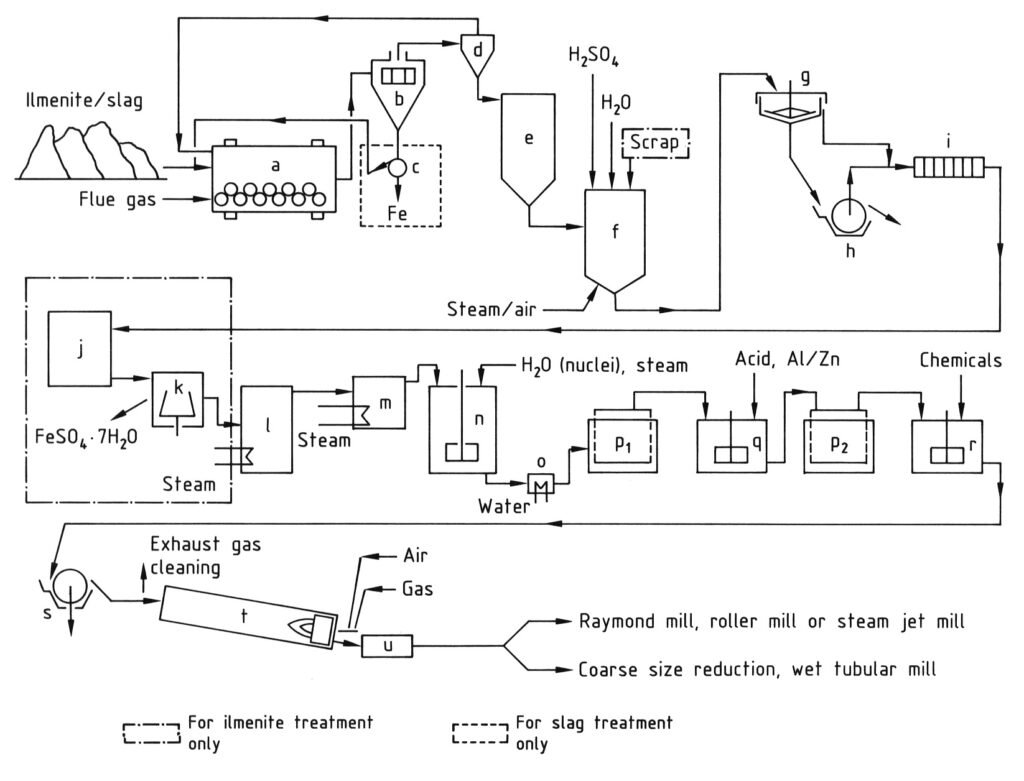
a) Molino de bolas/secador; b) Tamiz; c) Separador magnético; d) Ciclón; e) Silo; f) Recipiente de digestión; g) Espesador; h) Filtro rotatorio; i) Filtro prensa; j) Cristalizador; k) Centrífuga; l) Evaporador al vacío; m) Precalentador; n) Tanque agitado para hidrólisis; o) Enfriador; p) Filtros Moore; q) Tanque agitado para blanqueo; r) Tanque agitado para dopaje; s) Filtro rotatorio para deshidratación; t) Horno rotatorio; u) Enfriador.
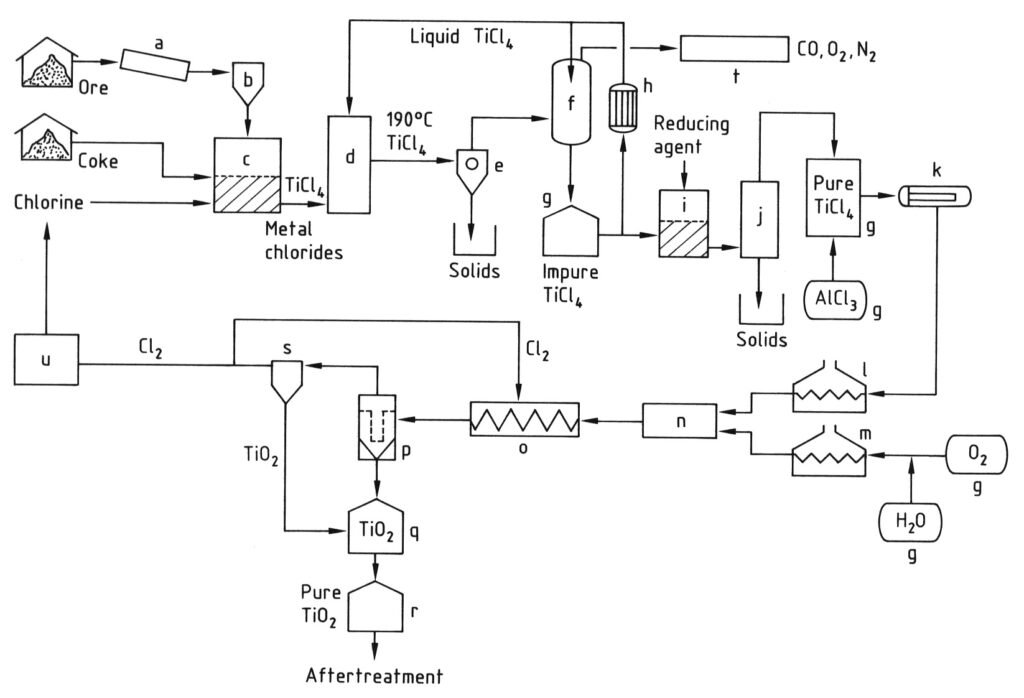
a) Molino; b) Silo; c) Reactor de lecho fluidizado; d) Torre de enfriamiento; e) Separación de cloruros metálicos; f) condensación de TiCl4; g) Tanque; h) Enfriador; i) Reducción de vanadio; j) Destilación; k) Evaporador; l) sobrecalentador de TiCl4; m) Sobrecalentador de O2; n) Quemador; o) Serpentín de enfriamiento; p) Filtro; q) Purificación de TiO2; r) Silo; s) Purificación de gases; t) Limpieza de gases residuales; u) Licuefacción de Cl2
5. Propiedades del pigmento del dióxido de titanio
Las características importantes del pigmento del dióxido de titanio incluyen el poder de dispersión, el poder cubriente, el brillo, la densidad de masa, la formación de brillo, la turbidez, la dispersabilidad, la solidez a la luz y la resistencia a la intemperie. Estas propiedades dependen de la pureza química, la estabilización reticular, la distribución del tamaño de partícula y los recubrimientos superficiales. La evaluación de las propiedades requiere considerar las interacciones pigmento-matriz.
5.1. Poder de dispersión
Los índices de refracción del rutilo (n = 2,80) y la anatasa (n = 2,55) son incluso superiores a los del diamante (n = 2,42). Los coeficientes de refracción relativos suelen oscilar entre 1,5 y 2,0 en diversos sistemas aglutinantes.
La dispersión óptima se produce a un tamaño de partícula de 0,2 μm según la teoría de Mie. El poder de dispersión depende de la longitud de onda. Las partículas más pequeñas de dióxido de titanio dispersan los matices azules, mientras que las partículas más grandes dispersan los matices amarillos.
5.2. Masa y color
La blancura del dióxido de titanio depende de la pureza, la modificación cristalina y el tamaño de partícula. Los pigmentos de anatasa tienen un matiz amarillo menor que el de rutilo porque su banda de absorción (385 nm) se desplaza hacia la región UV.
La presencia de impurezas de elementos de transición afecta la blancura, por lo que los pigmentos del proceso de cloruro tienen una pureza de color superior, ya que el TiCl4 se purifica por destilación antes de la oxidación.
5.3. Dispersión
La desintegración y dispersión efectivas de los pigmentos de dióxido de titanio son esenciales para lograr un alto brillo y minimizar la opacidad del brillo. Esto se logra mediante un pulido intensivo y un recubrimiento orgánico de la superficie. La selección del tratamiento de la superficie depende de los requisitos de la aplicación.
5.4. Solidez a la luz y resistencia a la intemperie
La erosión de las pinturas y recubrimientos que contienen dióxido de titanio provoca la desintegración de los pigmentos. La ausencia de oxígeno o la baja permeabilidad al oxígeno en los aglutinantes (p. ej., las resinas de melamina-formaldehído) previene la desintegración, pero provoca un agrisamiento reversible. Este agrisamiento se reduce significativamente en ausencia de agua.
La anatasa muestra una mayor susceptibilidad a ambos efectos. Los fabricantes de pigmentos utilizan métodos de estabilización, como el dopaje con zinc o aluminio antes de la calcinación o durante la oxidación.
En presencia de un aglutinante estable, los pigmentos de dióxido de titanio actúan como fotocatalizadores, induciendo la degradación del aglutinante, y con aglutinantes de baja estabilidad, lo protegen de la degradación. Por consiguiente, las pruebas de durabilidad requieren sistemas de aglutinantes altamente estables.
El mecanismo de degradación sigue un ciclo de cinco pasos:
- La adsorción de agua forma grupos hidroxilo superficiales.
- La absorción de luz de longitud de onda corta (anatasa <385 nm, rutilo <415 nm) genera un electrón y un hueco electrónico (excitón) dentro de la red cristalina, que migran a la superficie del pigmento.
- En la superficie, un ion OH– se oxida a un radical OH• por el hueco electrónico. Este radical OH• se desorbe y puede degradar oxidativamente el aglutinante. Simultáneamente, el Ti4+ se reduce a Ti3+ por el electrón restante.
- El ion Ti3+ se oxida por el oxígeno adsorbido para formar un ion O2–, que reacciona con H+ para producir un radical HO2•.
- El ciclo finaliza con la unión del agua a la superficie de TiO2 regenerada.
En resumen, el proceso de caleo es la reacción del agua y el oxígeno para formar radicales OH• y HO2• bajo la influencia de la radiación de onda corta y la actividad catalítica de la superficie de dióxido de titanio.
Este ciclo puede interrumpirse mediante la exclusión de aire o agua. La exclusión de oxígeno o la difusión limitante de oxígeno en el aglutinante provoca la acumulación de iones Ti3+ y el agrisamiento, que se revierte con la exposición gradual al oxígeno. La exclusión de agua impide la rehidratación y la formación de hidroxilos superficiales.
A pesar de esta actividad fotoquímica, los pigmentos de rutilo tratados estabilizan muchos aglutinantes al impedir la penetración de la luz en las capas de recubrimiento. Los pigmentos de TiO2 de alta calidad deben demostrar una excelente resistencia a la intemperie, como la resistencia al descascarillado significativo o al deterioro del brillo después de una exposición de dos años en la prueba de Florida.
5.5. Abrasividad
La abrasividad es una propiedad indeseable de los pigmentos de dióxido de titanio. La anatasa presenta una abrasividad menor (Mohs 5,5-6,0) en comparación con el rutilo (Mohs 6,5-7,0). Si bien estos valores de dureza intrínseca parecen similares, los aditivos dopantes influyen significativamente en la dureza práctica.
Por ejemplo, los pigmentos de rutilo dopados con alúmina presentan una abrasividad considerablemente mayor que los pigmentos de anatasa sin alúmina. Los pigmentos del proceso de cloruro, que suelen contener más alúmina, suelen mostrar una abrasividad mayor que los pigmentos de sulfato.
Este fenómeno se atribuye a la segregación de iones aceptores como el Al2O3 a la superficie durante la calcinación, incluso a bajas concentraciones (<0,4%). Por lo tanto, los estudios sobre la topología superficial y los parámetros reticulares del dióxido de titanio requieren materiales de ultraalta pureza para evitar interpretaciones erróneas.
6. Usos del dióxido de titanio pigmentario
El dióxido de titanio ha alcanzado una adopción universal, prácticamente reemplazando a otros pigmentos blancos. En 2007, Asia lideró el consumo mundial, seguida de Europa y Norteamérica. El rutilo representa aproximadamente el 90 % del consumo total y la anatasa el 10 %.
6.1. Usos en pinturas y recubrimientos
Las pinturas y los recubrimientos son los principales consumidores de dióxido de titanio. El pigmento de TiO2 mejora la capacidad protectora de los materiales de recubrimiento. Los pigmentos de TiO2 modernos pueden formar recubrimientos delgados (de unos pocos micrómetros) que cubren completamente el sustrato. Las concentraciones volumétricas del pigmento oscilan entre el 10 % y el 35 % en pinturas brillantes y pueden superar el 80 % en pinturas de emulsión mate.
Los pigmentos comerciales permiten la fabricación de pinturas utilizando equipos de dispersión básicos, como los disolventes de disco. El tratamiento orgánico previo a la micronización por chorro de vapor mejora las propiedades de brillo y reduce la opacidad de brillo en los esmaltes de secado al horno. Estos productos no sedimentan durante el almacenamiento y poseen buena resistencia a la luz y a la intemperie.
6.2. Usos en tintas de impresión
La impresión moderna opera con espesores de recubrimiento inferiores a 10 μm, lo que requiere pigmentos de dióxido de titanio de la mayor calidad posible. Estas películas ultrafinas solo son posibles con pigmentos de TiO2, que tienen un poder aclarante (reductor) siete veces superior al del litopón.
Su excepcional dispersabilidad resulta esencial para lograr el brillo. La masa neutra del dióxido de titanio lo hace especialmente adecuado para aclarar pigmentos de color.
6.3. Usos en plásticos
El dióxido de titanio se utiliza ampliamente para colorear productos plásticos tanto duraderos como no duraderos, como juguetes, electrodomésticos, automóviles, muebles y películas de embalaje. Los pigmentos de TiO2 absorben la radiación UV por debajo de 415 nm; por lo tanto, se utilizan para proteger los plásticos pigmentados de los rayos nocivos.
Incluso una cantidad mínima de dióxido de titanio confiere opacidad a los plásticos, por lo que se añade a productos de colores oscuros para evitar una apariencia translúcida y deslucida.
6.4. Usos en fibras
Los pigmentos de dióxido de titanio proporcionan una apariencia sólida a las fibras sintéticas al eliminar las propiedades translúcidas y el aspecto grasiento asociado. Los pigmentos de anatasa son los preferidos en esta aplicación debido a su menor efecto abrasivo en la hilatura en comparación con el rutilo. Un recubrimiento adecuado puede aumentar la baja resistencia a la luz de los pigmentos de anatasa en las fibras de poliamida.
6.5. Usos en papel
En Europa, se utilizan comúnmente cargas como el caolín, la tiza o el talco para abrillantar y opacificar el papel. Los pigmentos de dióxido de titanio son ideales para papel de alta blancura que requiere opacidad en calibres muy finos (por ejemplo, papel para correo aéreo o papel de impresión fino).
El TiO2 puede añadirse a la pulpa de papel o aplicarse como recubrimiento para obtener una calidad superior de papel «artístico». Los papeles laminados suelen colorearse con pigmentos de rutilo extremadamente resistentes a la luz antes de impregnarlos con resina de melamina-urea para obtener capas o películas decorativas.
6.6. Aplicaciones adicionales
Los pigmentos de dióxido de titanio se utilizan en las industrias del esmalte y la cerámica, la fabricación de cemento blanco y la coloración de caucho y linóleo. Además, se emplean como absorbentes de rayos UV en protectores solares, jabones, polvos cosméticos, cremas, pasta de dientes y envoltorios de cigarros.
El dióxido de titanio también se utiliza como colorante alimentario y en la industria cosmética en general debido a sus propiedades como la no toxicidad (por vía oral), la compatibilidad con la piel y las mucosas, y la buena dispersabilidad en diversas soluciones y aglutinantes.
Se han producido pigmentos de TiO2 eléctricamente conductores mediante tratamientos superficiales con recubrimientos de óxido mixto de indio-estaño o antimonio-estaño. Estos pigmentos se utilizan en fibras para papeles electrofotográficos y en la producción de plásticos antiestáticos.
7. Usos del dióxido de titanio no pigmentario

El TiO2 no pigmentario se utiliza en esmaltes vítreos, vidrio y vitrocerámica, electrocerámica, catalizadores y soportes de catalizadores, fundentes de soldadura, pigmentos coloreados, conductores eléctricos, intermedios químicos (p. ej., fluorotitanato de potasio), cerámica estructural, absorbentes de rayos UV y revestimientos refractarios.
7.1. Electrocerámica
Los titanatos (p. ej., titanato de bario, estroncio, calcio y plomo), sintetizados a partir de sustratos de dióxido de titanio de alta pureza, se utilizan en la producción de condensadores, resistencias PTC y materiales piezoeléctricos.
Los requisitos de pureza, reactividad y características de sinterización de las materias primas de TiO2 son cada vez más estrictos debido a la tendencia a la miniaturización de los componentes electrónicos, que requiere capas cerámicas más delgadas y partículas más pequeñas.
Los avances recientes en el uso de hidrato de óxido de titanio (procedente del proceso de sulfato) han permitido la producción en estado sólido de BaTiO3 ultrapuro y ultrafino por debajo de 500 °C.
Los componentes piezocerámicos multicapa, como los actuadores para sistemas de inyección de combustible, requieren cerámicas de baja sinterización. Los componentes de TiO2 y ZrO2, altamente reactivos para el zirconato titanato de plomo (PZT), facilitan la formación de la estructura de perovskita y su posterior sinterización a temperaturas lo suficientemente bajas como para reducir significativamente el costoso contenido de paladio en los electrodos de estos actuadores.
El consumo mundial de dióxido de titanio para electrocerámica supera las 10 000 toneladas anuales. A pesar del efecto de la miniaturización de los componentes electrocerámicos, que resulta en una menor necesidad de materia prima por pieza electrónica, se prevé un crecimiento anual continuo.
7.2. Catalizadores
El dióxido de titanio se utiliza como catalizador activo en diversas reacciones térmicas y fotoquímicas, que involucran compuestos tanto inorgánicos como orgánicos. Puede ser autoportante o depositarse sobre otros materiales. El dopaje con elementos adicionales suele potenciar su efecto catalítico deseado.
La principal aplicación catalítica del dióxido de titanio es la eliminación de óxido de nitrógeno de gases residuales industriales (centrales eléctricas, incineradoras y automóviles diésel). En este proceso, denominado reducción catalítica selectiva (RCS), los óxidos de nitrógeno reaccionan con amoníaco en presencia de oxígeno sobre el catalizador para producir nitrógeno y agua.
El consumo mundial de dióxido de titanio para catalizadores de RCS es de aproximadamente 25.000 t/a. Estos catalizadores suelen contener hasta un 15 % de óxido de tungsteno y aproximadamente un 1 % de V2O5 junto con TiO2. Los métodos de fabricación de catalizadores incluyen la extrusión en forma de panal, el recubrimiento sobre sustratos (p. ej., cordierita) o la aplicación de capas sobre láminas metálicas.
Existen requisitos estrictos de pureza, tamaño de partícula y porosidad para garantizar una actividad catalítica sostenida durante largas vidas útiles. Se prevé una creciente demanda de eliminación de óxido de nitrógeno de motores diésel estacionarios y móviles.
Muchas otras aplicaciones catalíticas utilizan TiO2 puro, TiO2 con aditivos incorporados o TiO2 con metales depositados superficialmente (p. ej., Rh, Pt, Pd, Au, Ag).
7.3. Fotocatalizadores
Una amplia investigación mundial se centra en el aprovechamiento de la fotoactividad de las nanopartículas de dióxido de titanio, tratadas o sin tratar. El dióxido de titanio puede utilizarse para la descomposición catalítica de compuestos orgánicos en aguas residuales o para la purificación fotocatalítica del aire.
La fotocatálisis de TiO2 puro requiere radiación UV debido a su banda prohibida de semiconductores de aproximadamente 3,1 eV, por lo que solo se utiliza en aplicaciones exteriores. Sin embargo, el dopaje del dióxido de titanio con metales, carbono o nitrógeno permite reacciones fotocatalíticas que utilizan la parte visible del espectro. No obstante, la intensidad de la radiación puede ser un factor limitante incluso para aplicaciones de luz visible.
Ejemplos de aplicaciones fotocatalíticas recientes son los recubrimientos arquitectónicos autolimpiables (para exteriores), los recubrimientos interiores para la descomposición de contaminantes atmosféricos en edificios y las baldosas, recubrimientos o hormigón que incorporan dióxido de titanio nanoestructurado para la descomposición de óxido de nitrógeno urbano.
Estas tecnologías se limitan a aplicaciones especializadas, como hospitales o lugares de interés público específico.
7.4. Pigmentos de óxidos metálicos mixtos
Los pigmentos de anatasa, o hidrolizados de dióxido de titanio, se calcinan con óxidos de metales de transición para formar pigmentos de rutilo de cromo o rutilo de níquel (pigmentos de óxidos metálicos mixtos).
7.5. Absorción UV
Las partículas nanoestructuradas de TiO2 (5-50 nm) se incorporan a protectores solares para la industria cosmética y a recubrimientos con protección UV (p. ej., para madera). Generalmente, se utilizan partículas nanoestructuradas de rutilo con recubrimientos inorgánicos y orgánicos opcionales.
El dióxido de titanio nanométrico presenta un aspecto transparente; absorbe eficazmente la radiación UV-B (280-320 nm) y UV-A (320-400 nm). Debido a su pequeño tamaño de partícula, estas partículas nanoestructuradas de dióxido de titanio requieren un recubrimiento más inorgánico u orgánico que el TiO2 pigmentado.
7.6. Otras aplicaciones
El dióxido de titanio no pigmentario también se utiliza en baterías, pilas de combustible, sistemas de hidrodisociación y sistemas fotovoltaicos. Las baterías de titanato de litio están ganando interés como sistemas recargables de almacenamiento de energía para diversas aplicaciones.
Si bien los sistemas fotovoltaicos basados en TiO2 (células de Grätzel) son bien conocidos, la aplicación del dióxido de titanio en pilas de combustible y para la generación fotocatalítica de hidrógeno a partir del agua mediante la luz solar aún requiere una investigación exhaustiva.
8. Toxicología del dióxido de titanio
El dióxido de titanio presenta buena estabilidad y es completamente no tóxico tras la administración oral. Estudios a largo plazo en animales con TiO2 dietético no muestran evidencia de absorción de titanio.
Históricamente, la absorción pulmonar de pigmentos de dióxido de titanio finamente divididos no se ha asociado con efectos cancerígenos específicos. En consecuencia, la Agencia Internacional para la Investigación del Cáncer (IARC) clasificó inicialmente el dióxido de titanio como una sustancia de Clase 3, lo que significa que no era clasificable en cuanto a su carcinogenicidad para los humanos.
Sin embargo, en 2007, la IARC reclasificó el TiO2 como una sustancia de Clase 2B, lo que indica que es posiblemente carcinógeno para los humanos. Esta clasificación se aplica tanto al dióxido de titanio de grado pigmentario (tamaño de partícula primaria de 200-300 nm) como al de grado ultrafino (tamaño de partícula primaria inferior a 50 nm).
A pesar de esta reclasificación, los estudios epidemiológicos sobre la exposición al polvo de dióxido de titanio en trabajadores no han mostrado un aumento de la mortalidad ni de la incidencia de cáncer de pulmón.
Referencias
- Auer, G., Woditsch, P., Westerhaus, A., Kischkewitz, J., Griebler, W.-d., Rohe, M. and Liedekerke, M. (2017). Pigments, Inorganic, 2. White Pigments. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.n20_n01.pub2
- Kang, X.; Liu, S.; Dai, Z.; He, Y.; Song, X.; Tan, Z. «Titanium Dioxide: From Engineering to Applications.» Catalysts, 2019, 9 (2), 191. DOI: 10.3390/catal9020191.
- Haider, A. J.; Jameel, Z. N.; Al-Hussaini, I. H. M. «Review on: Titanium Dioxide Applications.» Energy Procedia, 2019, 157, 17-29. DOI: 10.1016/j.egypro.2018.11.159.
- Fujishima, A.; Rao, T. N.; Tryk, D. A. «Titanium dioxide photocatalysis.» Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2000, 1 (1), 1-21. DOI: 10.1016/S1389-5567(00)00002-2.
- Diebold, U. «The surface science of titanium dioxide.» Surface Science Reports, 2003, 48 (5–8), 53-229. DOI: 10.1016/S0167-5729(02)00100-0.
- Chen, X.; Mao, S. S. «Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications, and Applications.» Chem. Rev., 2007, 107 (7), 2891–2959. DOI: 10.1021/cr0500535.
- Racovita, A. D. «Titanium Dioxide: Structure, Impact, and Toxicity.» Int. J. Environ. Res. Public Health, 2022, 19 (9), 5681. DOI: 10.3390/ijerph19095681.
- Weir, A.; Westerhoff, P.; Fabricius, L.; Hristovski, K.; von Goetz, N. «Titanium Dioxide Nanoparticles in Food and Personal Care Products.» Environ. Sci. Technol., 2012, 46 (4), 2242–2250. DOI: 10.1021/es204168d.
- Ghamarpoor, R.; Fallah, A.; Jamshidi, M. «Investigating the use of titanium dioxide (TiO2) nanoparticles on the amount of protection against UV irradiation.» Sci Rep, 2023, 13, 9793. DOI: 10.1038/s41598-023-37057-5.
- Middlemas, S.; Fang, Z. Z.; Fan, P. «A new method for production of titanium dioxide pigment.» Hydrometallurgy, 2013, 131–132, 107-113. DOI: 10.1016/j.hydromet.2012.11.002.
- Gázquez, M.; Bolívar, J.; Garcia-Tenorio, R.; Vaca, F. «A Review of the Production Cycle of Titanium Dioxide Pigment.» Materials Sciences and Applications, 2014, 5, 441-458. DOI: 10.4236/msa.2014.57048.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. «Titanium Dioxide.» In Some Organic Solvents, Resin Monomers and Related Compounds, Pigments and Occupational Exposures in Paint Manufacture and Painting; IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 47; International Agency for Research on Cancer: Lyon (FR), 1989. Available from: https://www.ncbi.nlm.nih.gov/books/NBK524874/.
- Goparaju, V. R. R.; Marshall, D. F.; Kazerooni, V. «Process for manufacturing titanium dioxide pigments using ultrasonication.» U.S. Patent 9,353,266, 2016. Available from: https://patents.google.com/patent/US9353266B2/en.
- Davis, B. R.; Rahm, J. A. «Process for manufacturing titanium dioxide.» U.S. Patent 4,288,418, 1981. Available from: https://patents.google.com/patent/US4288418A/en.
- Ayorinde, T.; Sayes, C. M. «An updated review of industrially relevant titanium dioxide and its environmental health effects.» J. Hazard. Mater. Lett., 2023, 4, 100085. DOI: 10.1016/j.hazl.2023.100085.
