Ácido nitrilotriacético: propiedades, producción, usos y toxicología
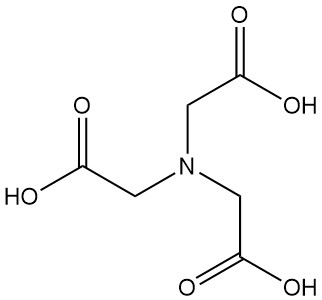
¿Qué es el ácido nitrilotriacético?
El ácido nitrilotriacético, también conocido como NTA o N,N-bis(carboximetil)glicina, es un ácido tricarboxílico con la fórmula C6H9NO6. Es un sólido incoloro que pertenece a la familia de los ácidos aminopolicarboxílicos y es uno de los agentes quelantes más importantes, junto con el EDTA.
Fue sintetizado por primera vez en 1861 por Heintz al hacer reaccionar amoníaco con ácido cloroacético. La producción industrial a gran escala comenzó en Ludwigshafen en 1936. Desde entonces, el ácido nitrilotriacético se ha establecido como un agente quelante utilizado en varios procesos industriales.
Tabla de contenido
1. Propiedades físicas del ácido nitrilotriacético
El ácido nitrilotriacético es un triácido que forma cristales incoloros con forma de aguja cuando se cristaliza en una solución acuosa. Es insoluble en agua y en la mayoría de los disolventes orgánicos; sin embargo, los nitrilotriacetatos de metales alcalinos tienen una alta solubilidad en agua. Por ejemplo, el nitrilotriacetato trisódico se disuelve hasta 640 g/L en agua.
Las propiedades físicas más importantes del ácido nitrilotriacético se presentan en la siguiente tabla.
| Propiedad | Valor |
|---|---|
| Número CAS | [139-13-9] |
| Fórmula química | C6H9NO6 |
| Masa molecular | 191,14 g/mol |
| Punto de fusión | 242 °C (descomposición) |
| Solubilidad en agua | 0,13 g/100 g a 5 °C 0,13 g/100 g a 22,5 °C 0,95 g/100 g a 80 °C 3,3 g/100 g a 100 °C |
| pH de la solución saturada | 2,3 |
| pK1 a 25 °C | 1,80 |
| pK2 a 25 °C | 2,48 |
| pK3 a 25 °C | 9,65 |
2. Propiedades químicas del ácido nitrilotriacético
El ácido nitrilotriacético (NTA) se caracteriza principalmente por la formación de quelatos solubles en agua con cationes metálicos multivalentes. Tanto los grupos carboxilo como el nitrógeno terciario actúan como sitios de ligando. Las posiciones de coordinación de iones metálicos desocupadas pueden estar ocupadas por moléculas de agua.
Si bien la geometría octaédrica (número de coordinación 6) a menudo representa quelatos de metal-NTA, estudios estructurales recientes por difracción de rayos X indican el potencial de números de coordinación más altos en ciertos complejos metálicos. Por ejemplo, Ca2+ en el complejo CaNTA– muestra un número de coordinación de 7.
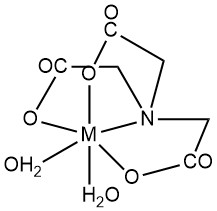
En general, los complejos metálicos se forman en una proporción molar de metal a NTA de 1:1, y un exceso de NTA puede dar lugar a complejos de 1:2. Las constantes de estabilidad (K1 para 1:1, K2 para 1:2) cuantifican la estabilidad del complejo. La polarización del enlace H-O en el quelato confiere una propiedad de ácido débil a los complejos de 1:1, caracterizada por la constante de disociación Kd.
K1 = [MNTA]/[M][NTA]
K2 = [MNTA2]/[M][NTA]2
Kd = [MNTAOH][H+]/[MNTA]
Donde M es el ion metálico multivalente, NTA representa el anión N(CH2COO–)3.
La Tabla 2 enumera algunas de las constantes de estabilidad de los quelatos de NTA.
| Ión metálico | log K1 | log K2 | pKd |
|---|---|---|---|
| Al3+ | 11,4 | - | 5,09 |
| Ca2+ | 6,39 | 8,76 | - |
| Cd2+ | 9,78 | 14,39 | 11,25 |
| Co2+ | 10,38 | 14,33 | 10,80 |
| Cu2+ | 12,94 | 17,42 | 9,14 |
| Fe2+ | 8,33 | 12,80 | 10,60 |
| Fe3+ | 15,90 | 24,30 | 4,1-7,8 |
| Hg2+ | 14,60 | - | - |
| Mg2+ | 5,47 | - | - |
| Mn2+ | 7,46 | 10,94 | - |
| Ni2+ | 11,50 | 16,32 | 10,86 |
| Pb2+ | 11,34 | - | - |
| Zn2+ | 10,66 | 14,24 | 10,06 |
La formación de complejos entre metales y ácido nitrilotriacético compite con otras reacciones. Los cationes metálicos pueden formar precipitados poco solubles con aniones como carbonato, sulfuro, sulfato u oxalato. Además, los iones de hidrógeno compiten con los cationes metálicos por los sitios de unión de los trianiones nitrilotriacéticos. En consecuencia, los sistemas de ácido nitrilotriacético se controlan mediante múltiples equilibrios.
Los quelatos de nitrilotriacetato son estables en un amplio rango de pH que depende de la concentración de quelato y del exceso de agente complejante; por ejemplo, Ca2+ (pH 9–12), Mg2+ (pH 7–10), Cu2+ (pH 3–12) y Fe2+ (pH 1,5–3).
3. Producción de ácido nitrilotriacético
La producción histórica de ácido nitrilotriacético a partir de amoníaco y ácido cloroacético ya no se utiliza. La oxidación de la trietanolamina no tiene relevancia industrial.
En la actualidad, el ácido nitrilotriacético se produce mediante procesos de cianometilación ácida de dos etapas o alcalina de una etapa utilizando amoníaco (o sulfato de amonio), formaldehído y cianuro de sodio (o cianuro de hidrógeno).
3.1. El proceso alcalino
El proceso alcalino es un proceso establecido desde hace mucho tiempo en el que se produce nitrilotriacetato trisódico mediante la reacción de amoníaco, formaldehído y cianuro de sodio. La hidrólisis del nitrilotriacetato produce la sal de nitrilotriacetato.
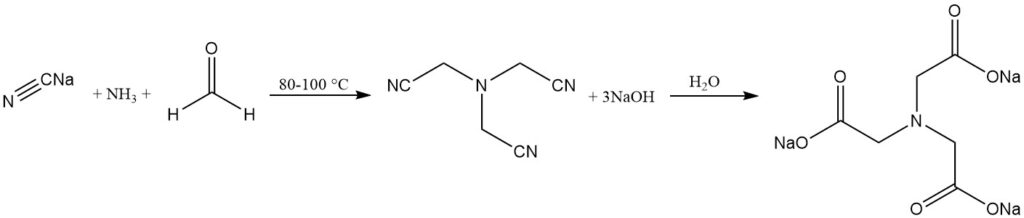
NH3 + 3 HCHO + 3 NaCN → N(CH2CN)3 + 3 NaOH
N(CH2CN)3 + 3 NaOH + 3 H2O → N(CH2COONa)3 + 3 NH3
Este proceso puede llevarse a cabo de forma discontinua o continua y se lleva a cabo a una temperatura de 80 a 100 °C. A un pH alto (aproximadamente 14), la triscianometilamina se hidroliza in situ a nitrilotriacetato trisódico.
En un proceso continuo industrial, se introduce una solución acuosa de cianuro de sodio en un sistema de reactor en cascada junto con una solución de formaldehído. Este método genera un exceso de amoníaco tres veces superior, que debe limitarse para evitar la producción de subproductos con bajos grados de carboximetilación, como la glicina y el ácido iminodiacético.
La eliminación del exceso de amoníaco durante el proceso se lleva a cabo destilando continuamente el amoníaco con vapor o aire durante todo el proceso; sin embargo, es inevitable la formación de pequeñas cantidades de productos indeseables como el ácido glicólico y otros mencionados anteriormente.
La solución final se vende como una solución al 40%, se convierte en polvo o se acidifica para formar ácido nitrilotriacético.
3.2. El proceso ácido
Para limitar la formación de subproductos en el proceso alcalino, algunos productores han construido plantas basadas en el proceso ácido; sin embargo, este método exige estrictos protocolos de seguridad debido al uso de cianuro de hidrógeno, y también existe el problema de la corrosión.
Primero, el amoníaco y el formaldehído producen inicialmente hexametilentetramina, que posteriormente reacciona con cianuro de hidrógeno en ácido sulfúrico para formar triscianometilamina.
La triscianometilamina sólida es insoluble en el medio de reacción, por lo que se filtra, se lava y luego se saponifica con hidróxido de sodio para producir una solución de nitrilotriacetato trisódico con subproductos mínimos.
Esta solución también se vende como un producto al 40% o se utiliza en la producción de ácido nitrilotriacético en polvo o sólido.
El ácido nitrilotriacético comercial se vende con diferentes nombres comerciales, incluidos los grados Dissolvine A (Akzo), los grados Masquol NTA (Protex), los grados Rexene NTA (Akzo), los grados Trilon A (BASF) y los grados Versene NTA (Dow).
4. Usos del ácido nitrilotriacético
El uso principal del ácido nitrilotriacético y sus sales se basa en su capacidad para formar complejos con iones metálicos. Estas propiedades de formación de complejos se utilizan en diversos campos para secuestrar iones metálicos que interfieren, disolver precipitados, modular los potenciales redox de iones metálicos o crear tampones de iones metálicos.
4.1. Usos del ácido nitrilotriacético para ablandar el agua
El ácido nitrilotriacético ablanda el agua de manera eficaz mediante la complejación de iones de calcio (Ca2+) y magnesio (Mg2+) dentro de un rango de pH neutro a alcalino. La cantidad de ácido nitrilotriacético o nitrilotriacetato trisódico necesaria para ablandar el agua varía según la dureza del agua.
Industrias como la del papel, los textiles, el jabón, los cosméticos, los detergentes, el tratamiento del agua de alimentación de calderas y el procesamiento químico (por ejemplo, fotografía, galvanoplastia) utilizan ácido nitrilotriacético para ablandar el agua.
4.2. Usos del ácido nitrilotriacético como sustituto del fosfato en detergentes
El nitrilotriacetato trisódico se utiliza como sustituto del trifosfato pentasódico en detergentes con bajo contenido de fosfato o sin fosfato, a menudo junto con zeolitas o policarboxilatos.
A diferencia del trifosfato pentasódico, el nitrilotriacetato trisódico resiste la hidrólisis y sigue siendo totalmente eficaz después del secado por pulverización y durante el lavado. Si bien la relación de equivalencia entre el nitrilotriacetato trisódico y el trifosfato pentasódico es de aproximadamente 0,6 a 1, no compromete la detergencia primaria o secundaria.
4.3. Usos del ácido nitrilotriacético como sustituto del difosfato tetrapotásico en limpiadores
El nitrilotriacetato trisódico reemplaza al difosfato tetrapotásico en limpiadores en una relación de equivalencia favorable de 1:3, lo que a menudo elimina la necesidad de hidrótropos o solubilizantes. Los efectos constructores sinérgicos ocurren con la sustitución parcial de fosfato.
4.4. Usos del ácido nitrilotriacético en el enmascaramiento de iones de metales pesados
Aunque es menos eficaz que el EDTA, el ácido nitrilotriacético se utiliza para enmascarar iones de metales pesados como Fe3+, Cu2+ y Mn2+. Industrias como la fabricación de jabón, el blanqueo de textiles, la limpieza de superficies y varios procesos químicos lo utilizan para este propósito.
4.5. Aplicaciones especializadas
El ácido nitrilotriacético también se utiliza en aplicaciones especializadas como la separación de elementos de tierras raras, titulaciones complexométricas y formulación de micronutrientes agrícolas.
5. Toxicología del ácido nitrilotriacético
El ácido nitrilotriacético es altamente biodegradable y se mineraliza fácilmente en productos finales inorgánicos sin metabolitos orgánicos persistentes.
Los estudios ambientales, en particular tras la introducción de detergentes que contienen ácido nitrilotriacético, confirman su rápida biodegradación en plantas de tratamiento de aguas residuales (>98%) y aguas superficiales (vida media < 1 día). Se pueden detectar trazas mínimas de ácido nitrilotriacético en aguas subterráneas después de una infiltración limitada.
Si bien la capacidad de formación de complejos del ácido nitrilotriacético puede movilizar metales pesados, su rápida biodegradación minimiza este riesgo. Los estudios sobre plantas de tratamiento de aguas residuales y sedimentos fluviales indican una removilización insignificante de metales pesados en condiciones realistas.
El ácido nitrilotriacético demuestra una baja toxicidad aguda para los organismos acuáticos, con valores de LC50 que varían de aproximadamente 100 a más de 10 000 mg/L, influenciados por la dureza del agua. Los estudios de toxicidad crónica en diversos organismos no revelan efectos adversos por debajo de 1 mg/L, con umbrales de toxicidad significativos en concentraciones mucho más altas.
La toxicidad aguda en mamíferos varía según la especie. El valor de LD50 oral para el nitrilotriacetato trisódico en roedores es de aproximadamente 2000 mg/kg; esta dosis induce vómitos en perros y monos.
Los estudios de inhalación y las pruebas de irritación de la piel/ojos/tracto respiratorio muestran efectos mínimos, sin indicaciones de sensibilización o alergia. El ácido nitrilotriacético no tiene efectos teratogénicos, solo o en combinación con metales pesados como el cadmio y el mercurio. Además, las pruebas de mutagenicidad arrojan resultados negativos.
Los mamíferos no metabolizan el ácido nitrilotriacético; en cambio, los riñones lo excretan sin cambios. Las células del túbulo renal y del uréter acumulan concentraciones más altas de ácido nitrilotriacético.
Los estudios subcrónicos y crónicos vinculan el ácido nitrilotriacético con la toxicidad renal debido a alteraciones del metabolismo de electrolitos y hierro. Las dosis altas pueden dañar las células epiteliales de los riñones, los uréteres y la vejiga, lo que puede provocar la formación de tumores.
Sin embargo, existe un umbral significativo por debajo del desarrollo del tumor, que supera con creces el nivel sin efectos adversos (NOEL) de 14 mg/kg de peso corporal por día.
Referencia
- Ácido nitrilotriacético; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_377.pub3
