Natriumchlorit: Eigenschaften, Herstellung und Verwendung
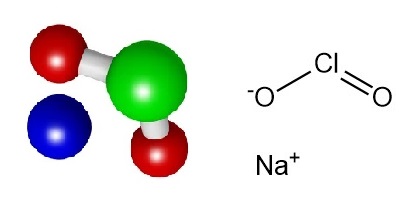
Natriumchlorit ist das Natriumsalz der instabilen chlorigen Säure mit der Formel NaClO2. Es erscheint als weißer, kristalliner Feststoff, der in Wasser löslich ist.
Inhaltsverzeichnis
1. Eigenschaften von Natriumchlorit
Natriumchlorit ist ein festes Salz mit einem Molekulargewicht von 90,45 g/mol. Es liegt sowohl in wasserfreier als auch in trihydratisierter Form vor (Übergangspunkt: 38 °C). Hochreine Kristalle sind weiß, weisen jedoch aufgrund des Vorhandenseins von Chlordioxid typischerweise einen grünlichen Farbton auf (ClO2) als Spurenverunreinigung.
Da keine organischen Stoffe vorhanden sind, weist es eine geringe Schlagempfindlichkeit auf. Es kann ohne Detonation mit einer sauberen Metalloberfläche getroffen werden. Allerdings können organische Materialien, wie zum Beispiel die Folie eines Hammers, beim Aufprall zu spontanem Aufblähen führen.
Als starkes Oxidationsmittel bildet festes Natriumchlorit explosive Gemische mit oxidierbaren Materialien wie Schwefel, Kohlenstaub, Metallpulver und organischen Verbindungen. Natriumchloritlösungen sollten niemals auf Textilien trocknen, um die Bildung entzündlicher Gemische zu vermeiden.
Natriumchlorit ist wasserlöslich (Tabelle 1) und seine Löslichkeit wird durch die Anwesenheit anderer Substanzen wie Natriumhydroxid, Natriumchlorat, Natriumchlorid und Natriumcarbonat.
| Temperatur, °C | Löslichkeit, Gew.-% |
|---|---|
| 5 | 34 |
| 17 | 39 |
| 20 | 40,5 |
| 30 | 46 |
| 40 | 50,7 |
| 45 | 53 |
| 50 | 53,7 |
| 60 | 55 |
Bei wässrigen Natriumchloritlösungen sollte die Lichtexposition minimiert werden. Bei niedrigem pH-Wert (ca. 2) enthalten Chloritlösungen chlorige Säure, die zu Chlordioxid und Chlorat zerfällt:
4 HClO2 → 2 ClO2 + HClO3 + HCl + H2O
Bei pH 3–4 verlangsamt sich die Zersetzung. Alkalische Lösungen von Natriumchlorit sind stabil und verdünnte Lösungen können sogar ohne Zersetzung gekocht werden. Konzentrierte alkalische Lösungen zersetzen sich beim Erhitzen langsam:
3 NaClO2 → 2 NaClO3 + NaCl
Die Reaktion von Natriumchlorit mit Hypochlorit hängt vom pH-Wert ab. Bei niedrigem pH-Wert entsteht Chlordioxid, bei hohem pH-Wert Chlorat. Eine Reaktion mit Chlor ergibt Chlordioxid und Natriumchlorid:
2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
Kristallines Natriumchlorit weist eine leichte Hygroskopizität auf, ohne zusammenzubacken. Zur Langzeitlagerung ist eine alkalische Stabilisierung erforderlich. Erhitzen auf 180–200 °C führt zu einer teilweisen Zersetzung zu Natriumchlorat und Natriumchlorid oder zu einer vollständigen Zersetzung zu Natriumchlorid und Sauerstoff.
Tabelle 2 zeigt einige physikalische Eigenschaften von Natriumchlorit.
| Eigenschaft | Wert |
|---|---|
| Chemische Formel | NaClO2 |
| Molmasse | 90,442 g/mol (wasserfrei) 144,487 g/mol (Trihydrat) |
| Aussehen | weißer Feststoff |
| Geruch | geruchlos |
| Dichte | 2,468 g/cm3 |
| Schmelzpunkt | Wasserfrei: zersetzt sich bei 180–200 °C Trihydrat: zersetzt sich bei 38 °C |
| Löslichkeit in Wasser | 75,8 g/100 ml (25 °C) 122 g/100 ml (60 °C) |
| Löslichkeit | schwer löslich in Methanol, Ethanol |
| pKa | 10-11 |
| Bildungsenthalpie | -307,0 kJ/mol |
2. Industrielle Produktion von Natriumchlorit
Natriumchlorit entsteht durch die Reaktion von Chlordioxid mit Natriumhydroxid:
2 ClO2 + 2 NaOH → NaClO2 + NaClO3 + H2O
Natriumchlorit und Natriumchlorat haben ähnliche Wasserlöslichkeiten, was ihre Trennung schwierig macht. Der aktuelle industrielle Prozess beruht auf der Absorption von Chlordioxid in einer Natriumhydroxidlösung bei gleichzeitiger Chloratreduktion zu Chlorit unter Verwendung eines geeigneten Reduktionsmittels, wie beispielsweise Wasserstoffperoxid:
2 ClO2 + 2 NaOH + H2O2 → 2 NaClO2 + 2 H2O + O2
Dieser Prozess ergibt eine 33 Gew.-%ige Natriumchloritlösung. Nach den Verarbeitungsschritten wird ein trockener Feststoff erhalten, der etwa 80 Gew.-% Natriumchlorit und Stabilisatoren enthält.
Obwohl zahlreiche komplexe Chlorite synthetisiert wurden, hat nur Natriumchlorit einen signifikanten kommerziellen Wert.
Versuche, Natriumchlorit durch Elektrolyse herzustellen, ähnlich wie bei Hypochlorit und Chlorat, waren erfolglos. Die Synthese aus Chlordioxid und Natriumamalgam erwies sich aufgrund der Schwierigkeiten bei der Kontrolle des Redoxpotentials und des pH-Werts als unrentabel. Andere vorgeschlagene Methoden zur direkten Chlordioxidreduktion waren nicht effizient.
3. Verwendung von Natriumchlorit
Aufgrund seines spezifischen Oxidationspotentials wird Natriumchlorit als hochwirksames Bleichmittel eingesetzt. Im Gegensatz zu anderen Bleichmitteln ermöglicht es kontrollierte Bleichprozesse und ist daher in der Textilindustrie nützlich.
Es kann als Vorprodukt für die Chlordioxidproduktion im kleinen Maßstab verwendet werden.
Einige der häufigsten Anwendungen von Natriumchlorit sind:
- Desinfektionsmittel in einer Vielzahl von Anwendungen, einschließlich Trinkwasseraufbereitung, Lebensmittelverarbeitung und Industrieumgebungen.
- Bleichmittel in der Zellstoff- und Papierindustrie sowie in der Textilbleiche.
- In einigen Ländern wird Natriumchlorit als Lebensmittelzusatzstoff verwendet, um das Wachstum von Bakterien zu verhindern.
- In einigen Mundwässern und Zahnpasten werden Natriumchlorit in geringen Konzentrationen als antimikrobielles Mittel verwendet.
Referenz
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2
