Cyclohexanol: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Cyclohexanol?
Cyclohexanol ist eine organische Verbindung mit der chemischen Formel C6H12O. Es ist eine farblose, viskose Flüssigkeit oder ein kristalliner Feststoff mit kampferartigem Geruch, der in den meisten organischen Lösungsmitteln sehr gut löslich ist.
Cyclohexanol ist ein wichtiges chemisches Produkt, das in großem kommerziellen Maßstab hergestellt wird.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Cyclohexanol
Cyclohexanol ist eine farblose Substanz, die hygroskopische kristalline Nadeln mit einem kampferartigen Geruch bildet. In reinem Zustand schmilzt es bei Raumtemperatur bei 25,15 °C.
Cyclohexanol ist in den meisten organischen Lösungsmitteln wie Alkoholen, Ketonen, Ethern und alicyclischen und aromatischen Kohlenwasserstoffen sehr gut löslich. Es löst viele Öle, Wachse, Gummis und Harze und bildet ein Azeotrop mit Wasser und Phenol.
Die wichtigsten physikalischen Eigenschaften von Cyclohexanol sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [108-93-0] |
| Chemische Formel | C6H11OH |
| Molekularmasse | 100,16 g/mol |
| Schmelzpunkt | 25,15 °C |
| Siedepunkt | 161,1 °C |
| Dampfdruck | 0,15 kPa bei 20 °C 0,48 kPa bei 35 °C |
| Dichte | 0,9493 g/cm3 |
| Brechungsindex | 1,4656 |
| Ausdehnungskoeffizient | 8,25 × 10-4 |
| Dynamische Viskosität | 41,07 mPa · s bei 30 °C 17,20 mPa · s bei 45 °C |
| Spezifische Wärmekapazität | 1,747 J/g |
| Oberflächenspannung bei 30 °C | 33,47 mN/m |
| Schmelzwärme | 1,791 kJ/mol |
| Verbrennungswärme | -3,722 MJ/mol |
| Verdampfungswärme | 45,51 kJ/mol |
| Bildungswärme | -352 kJ/mol |
| Flammpunkt | 68 °C |
| Zündungstemperatur | 300 °C |
| Wasserlöslichkeit bei 20 °C | 3,6 g/100 g Wasser |
2. Chemische Reaktionen von Cyclohexanol
Cyclohexanol unterliegt den meisten typischen Reaktionen sekundärer Alkohole. Es bildet Ester mit organischen Säuren und Cyclohexylhalogenide mit Halogensäuren. Die wichtigsten kommerziellen Ester von Cyclohexanol sind Dicyclohexylphthalat, Dicyclohexyladipat und Cyclohexylacrylat.
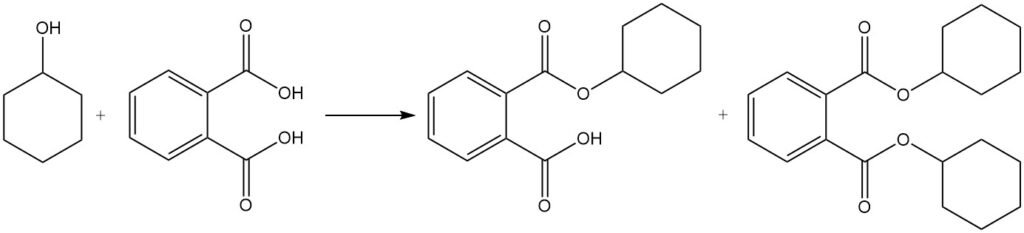
Die Reaktion von Cyclohexanol mit Phthalsäure erzeugt Cyclohexyl- und Dicyclohexylphthalate, die als Weichmacher verwendet werden.
Durch Dehydratisierung von Cyclohexanol mit Schwefelsäure oder durch Dampfphasenbehandlung mit Aluminiumoxid bei 300–400 °C entsteht Cyclohexen.
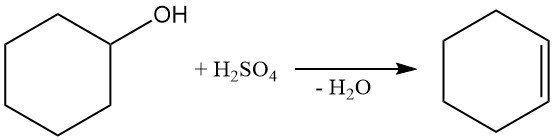
Cyclohexanol reagiert mit Natriumbromid und Schwefelsäure zu Bromcyclohexan mit einer Ausbeute von > 50 %.
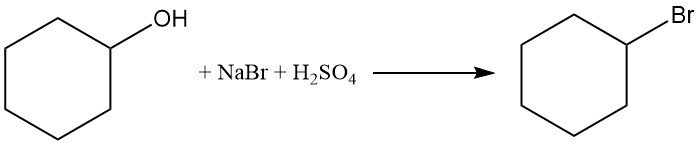
Durch milde Oxidation oder katalytische Dehydrierung entsteht Cyclohexanon, das mit Salpetersäure bei 75–80 °C und 1–4 bar weiter zu Adipinsäure oxidiert werden kann. Diese Reaktion ist industriell wichtig.
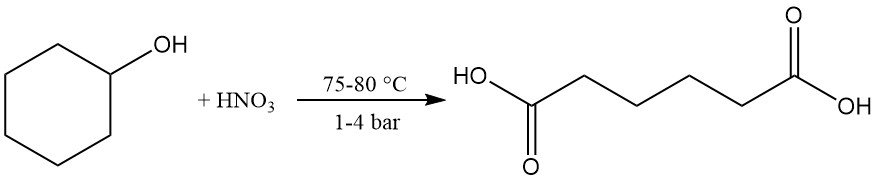
Die Reaktion von Cyclohexanol mit Ammoniak ergibt Cyclohexylamin.
3. Industrielle Produktion von Cyclohexanol
Cyclohexanol wurde industriell durch Hydrierung von Phenol hergestellt, wobei auch Cyclohexanon entsteht. In den 1940er Jahren wurde die durch Übergangsmetalle katalysierte Flüssigphasen-Luftoxidation von Cyclohexan entwickelt, um ein Cyclohexanol-Cyclohexanon-Gemisch zu synthetisieren. Die Katalysatorauswahl beeinflusste das Produktverhältnis.
In den 1950er Jahren produzierte Scientific Design Cyclohexanol selektiv durch Borsäure-modifizierte Flüssigphasen-Luftoxidation von Cyclohexan, wobei ein Zwischenprodukt Cyclohexylhydroperoxid entstand. Um 1990 produzierte Asahi Cyclohexanol aus Cyclohexen, das durch partielle Hydrierung von Benzol gewonnen wird.
3.1. Herstellung von Cyclohexanol durch Hydrierung von Phenol
Die Wahl der Metallkatalysatoren bei der Phenolhydrierung bestimmt die Produktverteilung, entweder Cyclohexanol, Cyclohexanon oder deren Mischung.
Cyclohexanol kann in hohen Ausbeuten durch sowohl Dampf- als auch Flüssigphasenhydrierung von Phenol hergestellt werden.
Cyclohexanol wird mit einer Ausbeute von 98 % durch Dampfphasenhydrierung von Phenol unter Verwendung nickelbasierter Katalysatoren hergestellt, die häufig auf Aluminiumoxid oder Siliciumdioxid aufgebracht sind.
Ein Flussdiagramm der Dampfphasenhydrierung von Phenol ist in Abbildung 1 dargestellt.
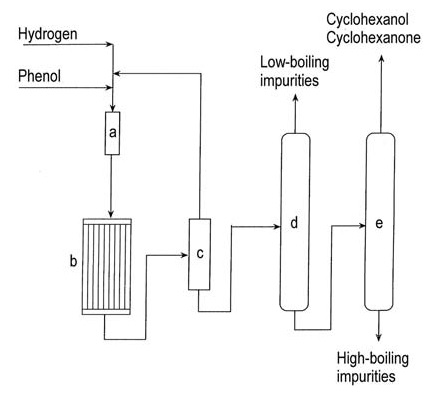
a) Phenolverdampfer; b) Hydrierungsreaktor; c) Kondensator; d) Kolonne zur Entfernung leichtsiedender Bestandteile; e) Kolonne zur Rückgewinnung von Cyclohexanol/Cyclohexanon
Die kommerzielle Flüssigphasenhydrierung von Phenol unter milden Bedingungen mit einem Raney-Nickel-Katalysator erreicht eine Selektivität von 99,9 % für Cyclohexanol.
3.2. Herstellung von Cyclohexanol durch Flüssigphasenoxidation von Cyclohexan
Die Flüssigphasen-Luftoxidation von Cyclohexan zu Cyclohexanol und Cyclohexanon entwickelte sich in den 1940er Jahren. Dieser Prozess wird in Rührreaktoren bei 140–180 °C und 0,8–2 MPa durchgeführt und verwendet entweder Kobaltkatalyse oder unkatalysierte Bedingungen.
Cyclohexylhydroperoxid ist ein Zwischenprodukt, das während der Reaktion entsteht und anschließend in Cyclohexanol und Cyclohexanon umgewandelt wird.
Die Wahl des Katalysators beeinflusst das Verhältnis von Cyclohexanol zu Cyclohexanon, wobei Kobaltkatalysatoren ein Verhältnis von Cyclohexanol zu Cyclohexanon von 3,5 ergeben. Als Nebenprodukte entstehen verschiedene sauerstoffhaltige Verbindungen.
Die Cyclohexanolausbeute kann durch die Aufrechterhaltung hoher Hydroperoxidwerte im Oxidationsmittelabfluss verbessert werden.
Die zur Zersetzung von Hydroperoxidzwischenprodukten verwendeten Methoden und Bedingungen beeinflussen das erzielte Verhältnis von Cyclohexanol zu Cyclohexanon. (siehe Tabelle 2)
| Lösung/Modifikation | Katalysator | Temperatur (°C) | Verhältnis (Cyclohexanol : Cyclohexanon) |
|---|---|---|---|
| A | keine | 155 | 0,8 |
| A | Cr | 155 | 0,4 |
| A | Ni | 155 | 1,4 |
| A | V | 155 | 1,4 |
| A | Co | 155 | 3,0 |
| A | Mn | 155 | 3,3 |
| B | Co | 160 | 2,5 |
| A - Hydrierung von Cyclohexylhydroperoxid | Pd | 150 | 5 - 10 |
| A - separate ätzende wässrige Phase | Co | 120 | 0,2 |
* A = Cyclohexylhydroperoxid in Cyclohexan; B = Cyclohexylhydroperoxid in Luftoxidationsmittelrückständen.
3.3. Herstellung von Cyclohexanol durch Borsäure-modifizierte Oxidation von Cyclohexan
In den 1950er Jahren modifizierte Scientific Design den Prozess der Cyclohexan-Luftoxidation, indem dem ersten Oxidationsreaktor wasserfreie Metaborsäure zugesetzt wurde (Abbildung 2). Cyclohexylhydroperoxid wird als Cyclohexylperboratester abgefangen und reagiert dann mit Cyclohexan zu Boratester und Cyclohexanol.
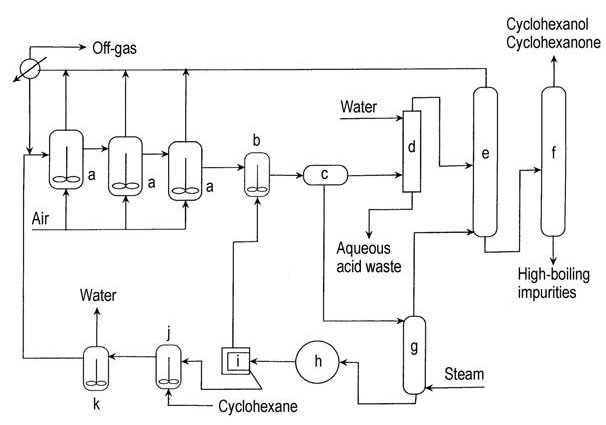
a) Luftoxidationsmittel; b) Esterhydrolysebehälter; c) Dekantiergefäß; d) Extraktionskolonne; e) Cyclohexan-Rückgewinnungskolonne; f) Raffinationskolonne; g) Strippkolonne; h) Vakuumkristallisator; i) Borsäurezentrifuge; j) Borsäure-Aufschlämmungstank; k) Dehydrator
Dieser stabile Ester widersteht Überoxidation und wird anschließend zu Cyclohexanol und Borsäure hydrolysiert. Borsäure wird zu Metaborsäure dehydriert, die in den Luftoxidierer zurückgeführt wird.
Die Prozesschemie ähnelt der metallkatalysierten Oxidation von Cyclohexan, aber der Cyclohexylring wird vor Oxidation geschützt.
Trotz höherer Investitions- und Betriebskosten im Vergleich zu anderen Verfahren liefert das Borsäureverfahren höhere Cyclohexanol- und Cyclohexanon-Ausbeuten von bis zu 88 % bei einer hohen Cyclohexanol-Selektivität von 91 %. Das Institut Francais du Petrole hat diese Technologie weiterentwickelt.
Die wichtigsten Hersteller, die dieses Verfahren derzeit verwenden, sind Solutia, DuPont (UK), Bayer und Mitsubishi. Das ursprüngliche Werk von Rhône-Poulenc, das auf dieser Technologie basierte, ist inzwischen geschlossen.
3.4. Herstellung von Cyclohexanol durch Hydratisierung von Cyclohexen
1972 wurde erstmals die selektive Benzolhydrierung zu Cyclohexen patentiert. Anschließend folgten Patente für die Cyclohexenhydratisierung zu Cyclohexanol unter Verwendung verschiedener Katalysatoren.
Asahi hat dieses Verfahren 1990 mit einer Anlage mit einer Kapazität von 100 t/a kommerzialisiert. Das Verfahren umfasst drei Stufen: selektive Benzolhydrierung, Cyclohexenabtrennung von nicht umgewandeltem Benzol und Cyclohexan und Cyclohexenhydratisierung (Abbildung 3).
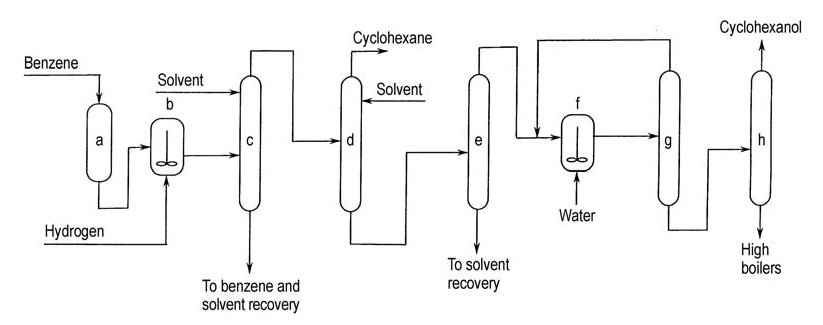
a) Benzolreinigung; b) Partielle Hydrierung; c) Trennung von nicht umgewandeltem Benzol von Cyclohexen und Cyclohexan; d) Trennung von Cyclohexen von Cyclohexan; e) Trennung von Cyclohexen vom Extrahierungslösungsmittel; f) Hydratisierung von Cyclohexen; g) Rückführung von nicht umgewandeltem Cyclohexen; h) Reinigung von Cyclohexanol
Bei der Hydrierung von Benzol wird ein spezieller heterogener Nickelkatalysator verwendet und bei einer Umwandlungsrate von etwa 50 % entsteht ein Gemisch aus etwa 35 % Cyclohexen, 15 % Cyclohexan und 50 % nicht umgewandeltem Benzol.
Verunreinigungen wie Schwefel und Eisen beeinträchtigen die Selektivität erheblich, weshalb gereinigtes Benzol verwendet und das Hydrierungsgefäß mit einem inerten Material ausgekleidet werden muss.
Das Cyclohexan-Cyclohexen-Benzol-Gemisch wird zwei aufeinanderfolgenden Extraktivdestillationen unterzogen. Zurückgewonnenes Cyclohexan kann wieder in Benzol umgewandelt oder an andere Caprolactam– und Adipinsäureproduzenten verkauft werden.
Bei der Hydratisierung von Cyclohexen zu Cyclohexanol wird ebenfalls ein heterogener Katalysator in einem Suspensionsreaktor verwendet. Das Gleichgewicht begrenzt die Umwandlung auf etwa 14 %.
Die Ausbeute von Benzol zu Cyclohexanol ist außergewöhnlich hoch und liegt wahrscheinlich über 95 %. Obwohl die Nebenprodukte minimal sind, übersteigt die Investition die konventioneller Cyclohexanoxidationsanlagen.
4. Verwendung von Cyclohexanol
Cyclohexanol wird industriell hauptsächlich zur Herstellung von Adipinsäure verwendet, die zur Herstellung von Nylon-6,6 und Cyclohexanon, einem Caprolactam-Vorläufer, verwendet wird.
1992 erreichte der US-amerikanische Cyclohexanolmarkt (ohne Nylon-Zwischenprodukte) 10.000 Tonnen.
Die wichtigsten Verwendungszwecke von Cyclohexanol sind:
- Als Lösungsmittel für Lacke, Firnisse, Öle, Alkydharze, Gummi, Schellack, Ethylcellulose, Säurefarbstoffe und Naturharze.
- Bei der Herstellung von Estern für Weichmacher, z. B. Dicyclohexylphthalat.
- In der Wäschereiindustrie und in Seifen und synthetischen Reinigungsmitteln als Homogenisator und Stabilisator.
- In Farb- und Lackentfernern.
- Bei der Herstellung von Cyclohexylamin, einem Korrosionsinhibitor.
- In der Insektizid-, Duftstoff-, Politur- und Gummikleberindustrie.
- In der Textilindustrie als Farbstofflösungsmittel und Kochhilfsmittel.
5. Toxikologie von Cyclohexanol
Cyclohexanol weist eine geringe orale Toxizität und leichte Hautreizungen auf. Augenexposition verursacht schwere Reizungen und vorübergehende Hornhautschäden. Das Einatmen hoher Dampfkonzentrationen (ca. 1000 ppm) führt bei Kaninchen zu Bindehaut- und Atemreizungen, Lethargie, Koordinationsstörungen, Narkose und leichten Krämpfen.
Studien zur Reproduktionstoxizität an Mäusen weisen auf eine erhöhte Sterblichkeit der Nachkommen nach Cyclohexanol-Einnahme durch die Mutter während der Schwangerschaft hin. Bei Ratten und Rennmäusen wurde nach wiederholter subkutaner Verabreichung von Hodenatrophie mit Verlust von Spermatogenzellen berichtet.
Ähnliche Effekte traten bei Kaninchen nach oraler Exposition auf. Eine Studie konnte jedoch trotz hochdosierter oraler Verabreichung keine Hodenatrophie bei Ratten nachweisen.
Die ACGIH hat einen TLV-TWA von 50 ppm (ca. 200 mg/m³) mit Hauthinweis festgelegt.
Der ordnungsgemäße Umgang mit Cyclohexanol erfordert ausreichende Belüftung, die Vermeidung längerer Exposition, die Verhinderung der Einnahme und Augenschutz.
Referenzen
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://www.sciencedirect.com/science/article/abs/pii/B9780323851596501093
- https://onlinelibrary.wiley.com/doi/abs/10.1002/recl.19630820107
- https://onlinelibrary.wiley.com/doi/10.1002/0471740039.vec0746
- https://www.sciencedirect.com/science/article/abs/pii/S1460156705800200
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanol
