Tricloroacetaldeide (cloralio)
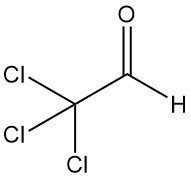
Cos’è la tricloroacetaldeide?
La tricloroacetaldeide [75-87-6], nota anche come cloralio o 2,2,2-tricloroetanale, è un composto organico con formula CCl3CHO. È un liquido incolore prodotto per la prima volta nel 1832 da Justus von Liebig tramite la clorurazione dell’etanolo.
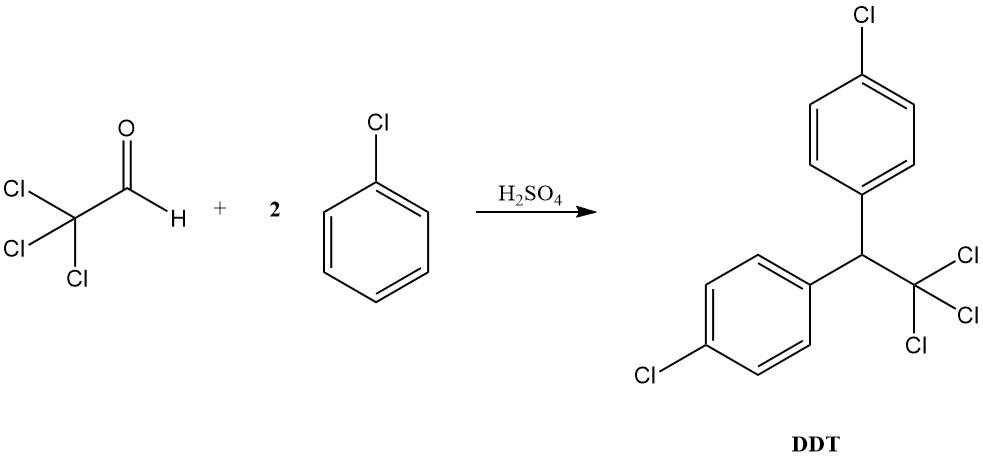
Il cloralio ha un significato storico in quanto primo farmaco ipnotico, introdotto nel 1869. Inoltre, funge da precursore del noto insetticida DDT (1,1,1-tricloro-2,2-bis(4-clorofenil)etano), scoperto nel 1941.
Mentre il cloralio era una sostanza chimica preziosa negli anni ’60, il suo utilizzo è notevolmente diminuito da allora a causa delle restrizioni sul DDT e altri insetticidi clorurati dovute a preoccupazioni ambientali.
Sommario
1. Proprietà fisiche della tricloroacetaldeide
Il cloralio, noto anche come tricloroacetaldeide o tricloroetanale, presenta le seguenti proprietà fisiche:
- Peso molecolare: 147,39 g/mol
- Punto di fusione: −56,5 °C
- Punto di ebollizione: 97,8 °C a 101,3 kPa
- Densità: 1,5121 g/cm³ a 20 °C
- Indice di rifrazione: 1,4557 a 20 °C
- Pressione di vapore: 4,7 kPa a 20 °C
- Aspetto: Liquido oleoso, incolore, mobile
- Odore: penetrante
- Solubilità: Facilmente solubile in acqua, alcool, etere e cloroformio
- Coefficiente di ripartizione ottanolo-acqua: 0,99 (basso)
- Formazione di azeotropi: forma azeotropi con 1,2-dicloroetano, eptano e benzene
2. Reazioni chimiche della tricloroacetaldeide
La tricloroacetaldeide ha proprietà chimiche distintive rispetto alle tipiche aldeidi, principalmente a causa della forte influenza di attrazione degli elettroni dei suoi tre atomi di cloro. Si decompone se esposta alla luce solare o al calore.
Il cloralio reagisce facilmente con i nucleofili, formando vari prodotti di addizione. Con gli alcoli, genera emiacetali isolabili (CCl3CH(OH)OR) e, con l’acqua, forma il noto idrato di cloralio [302-17-0] (CCl3CH(OH)2, punto di fusione: 53 °C e punto di ebollizione 97,5 °C).
A differenza della maggior parte delle aldeidi, il cloralio non può partecipare a molte condensazioni catalizzate da basi. Le basi forti tendono a scindere il legame carbonio-carbonio, dando origine a prodotti come cloroformio e HCO2Na, o HCONR2 (R = alchile), a seconda del reagente specifico.
CCl3CHO + NaOH → CHCl3 + HCO2Na
CCl3CHO + R2NH → CHCl3 + HCONR2 (R = alchile)
In condizioni acide, il cloralio si comporta più come una tipica aldeide, formando acetali con alcoli e condensandosi con composti aromatici per produrre diariltricloroetani, come esemplificato dalla formazione di DDT dal clorobenzene.
In presenza di iniziatori anionici come il litio terz-butossido, il cloralio polimerizza in un polimero alto insolubile e non infiammabile di formula [CH(CCl3)O]n. Questo polimero, tuttavia, non ha applicazioni commerciali note.
L’ossidazione della tricloroacetaldeide produce acido tricloroacetico.
3. Produzione di tricloroacetaldeide
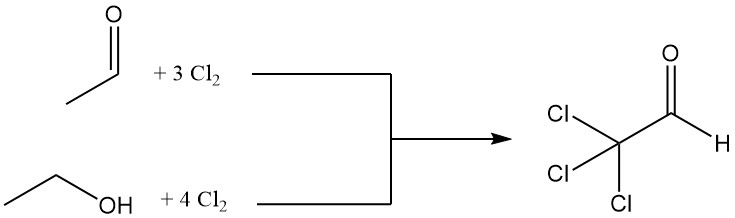
Il cloralio viene prodotto tramite la clorurazione di acetaldeide o etanolo, con acetaldeide spesso preferita per i suoi vantaggi economici.
CH3CHO + 3 Cl2 → CCl3CHO + 3 HCl
L’acetaldeide reagisce con il cloro in una soluzione di acido cloridrico per ridurre i sottoprodotti della condensazione e l’ossidazione dell’aldeide. Il tricloruro di antimonio viene utilizzato come catalizzatore.
La temperatura aumenta gradualmente da 0 °C a 90 °C per mantenere la velocità di reazione.
Il cloralio viene distillato dalla miscela come idrato, che viene poi decomposto con acido solforico concentrato per separarsi dallo strato acido più pesante. Viene poi distillato da una colonna di frazionamento.
La clorurazione di una mole di etanolo richiede quattro moli di cloro, con una mole utilizzata per l’ossidazione ad acetaldeide.
CH3CH2OH + Cl2 → CH3CHO + 2 HCl
I recipienti di reazione e le tubazioni sono rivestiti con materiali resistenti agli acidi (ceramica, ecc.) per resistere all’acido cloridrico caldo. Le valvole sono realizzate in leghe di nichel-molibdeno (Hastelloy B) per la resistenza alla corrosione.
La purezza del cloralio di grado tecnico varia dal 94% al 99%, con l’acqua come principale impurità.
4. Usi della tricloroacetaldeide
Il cloralio è stato inizialmente utilizzato nella produzione dell’insetticida DDT, ma i suoi usi si estendono ben oltre. Sebbene il DDT sia vietato in molti paesi, il cloralio è stato utilizzato nella produzione di vari altri insetticidi, come il metossicloro e il naled, e di erbicidi (acido tricloroacetico).
Viene anche utilizzato nella produzione di schiuma rigida di poliuretano.
La tricloroacetaldeide può indurre il rigonfiamento dei granuli di amido a temperatura ambiente, con un potenziale impatto su varie industrie a base di amido.
L’idrato di cloralio, la forma idrata del cloralio, è stato utilizzato in medicina come farmaco sedativo e ipnotico (cloralio betaina, α-cloralosio e triclofos sodico). Sebbene utilizzato principalmente per il trattamento dell’insonnia a breve termine, è stato utilizzato anche per gestire l’ansia, indurre la sedazione prima delle procedure e trattare i sintomi di astinenza da alcol e altre droghe.
Il suo utilizzo nei bambini è diminuito a favore di alternative più sicure, ma trova ancora applicazione in determinate situazioni mediche.
In microscopia, la soluzione di Hoyer, contenente idrato di cloralio, viene utilizzata per montare vari organismi come briofite, felci, semi e artropodi per un’osservazione dettagliata.
5. Tossicologia del cloralio
Sintomi di esposizione:
- Il cloralio e il suo idrato presentano proprietà identiche e agiscono come deprimenti del sistema nervoso centrale.
- Le dosi terapeutiche (0,5-1,0 g) influenzano minimamente la respirazione e la pressione sanguigna, ma dosi più elevate deprimono entrambe.
- Si verificano effetti sinergici con l’etanolo, amplificando l’azione del cloralio.
- L’irritazione della pelle e delle mucose è un noto effetto collaterale.
- Il metabolismo converte il cloralio in tricloroetanolo, il principale fattore ai suoi effetti fisiologici.
- L’escrezione avviene prevalentemente tramite coniugazione urinaria con glucuronide.
Tossicità:
- L’ingestione orale di 4-30 g si è dimostrata letale negli adulti.
- Studi di inalazione nei ratti dimostrano un’elevata tossicità, con una LC50 di 440 mg/m³ per un’esposizione di 4 ore.
- L’esposizione cronica a concentrazioni inferiori (75-78 mg/m³) induce gravi lesioni polmonari e mortalità nei ratti.
- Mutagenicità osservata nel test di Ames.
- Non esistono valori limite di soglia (TLV) o concentrazioni massime consentite (MAK) stabiliti per il cloralio, che richiedono una manipolazione cauta simile a quella della cloroacetaldeide.
Carcinogenicità:
- L’Agenzia internazionale per la ricerca sul cancro (IARC) classifica il cloralio e l’idrato di cloralio come Gruppo 3: “non classificabile per quanto riguarda la sua cancerogenicità per l’uomo”.
- Sebbene prove limitate suggeriscano cancerogenicità negli studi sugli animali, i dati sull’uomo rimangono inadeguati.
Classificazione UE:
In base alla direttiva 67/548/CEE, il cloralio e l’idrato di cloralio sono designati come “Tossici” (T) con frasi di rischio R25-36/38, che indicano tossicità in caso di ingestione e irritazione della pelle/degli occhi.
Riferimento
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
