Benzene: proprietà, reazioni e usi
Cos’è il benzene?
Il benzene è un composto aromatico ad anello singolo con formula C6H6. È un liquido incolore e infiammabile dall’odore dolce. Il benzene è termicamente stabile e chimicamente reattivo, il che lo rende un prezioso precursore di molte altre sostanze chimiche.
Il benzene è utilizzato principalmente per produrre stirene, fenolo e cicloesano, che vengono utilizzati nella fabbricazione di materie plastiche, resine e altri prodotti. Viene utilizzato anche come solvente, ma il suo utilizzo è diminuito a causa della sua elevata tossicità. Il benzene è anche un componente della benzina, dove viene utilizzato per aumentare il numero di ottano.
Il benzene fu isolato per la prima volta da Michael Faraday nel 1825 e i processi di produzione commerciale furono sviluppati a metà del XIX secolo. Oggigiorno, il benzene si ottiene principalmente dal petrolio.
Sommario
1. Proprietà fisiche del benzene
La struttura di Kekulé del benzene, un anello a sei atomi di carbonio con legami singoli e doppi alternati, non può spiegare le sue proprietà. Il benzene è più stabile del previsto, il suo spettro NMR è insolito e le sue lunghezze di legame sono intermedie tra legami singoli e doppi. È anche più reattivo degli idrocarburi semplici.
Queste proprietà suggeriscono che il benzene abbia una struttura ibrida, con elettroni delocalizzati.
La tabella 1 fornisce importanti proprietà fisiche del benzene:
| Proprietà | Valore |
|---|---|
| Peso molecolare | 78,11 g/mol |
| Odore | Dolce |
| Colore | Incolore |
| Densità a 20 °C | 0,879 g/cm³ |
| Punto di fusione | 5,53 °C |
| Punto di ebollizione | 80,01 °C |
| Indice di rifrazione a 20 °C | 1,501 |
| Densità critica | 0,309 g/cm³ |
| Pressione critica | 48,9 bar |
| Temperatura critica | 288,9 °C |
| Punto di infiammabilità | -11 °C |
| Temperatura di accensione | 595 °C |
| Limiti di esplosività in aria (vol%) | 1,4–6,7 |
| Viscosità a 20 °C | 0,654 mPa·s |
| Solubilità in acqua | Leggermente solubile |
| Solubilità in solventi organici | Miscibile con la maggior parte dei solventi organici |
2. Proprietà chimiche del benzene
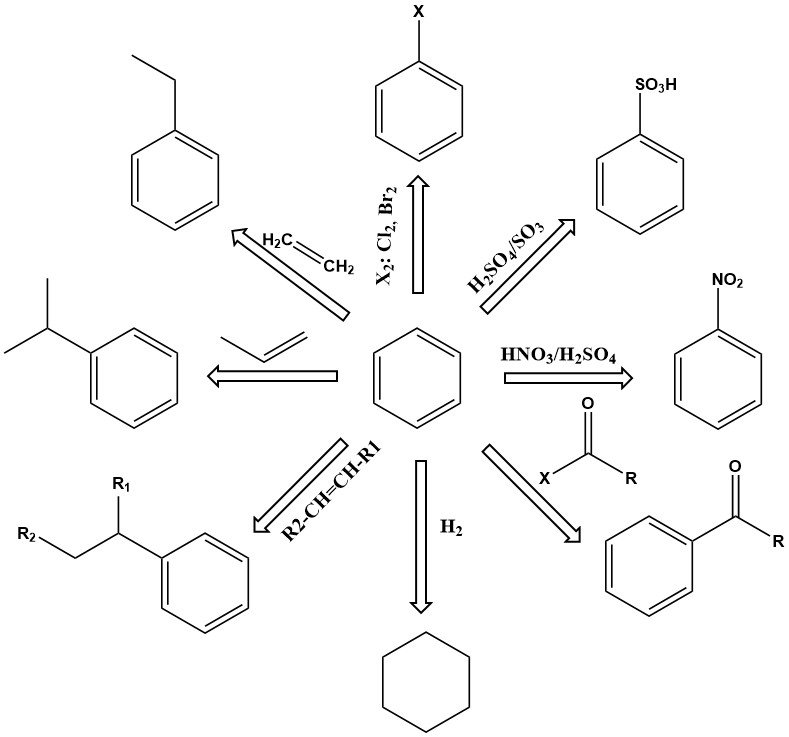
Il benzene, in quanto unità di base dei composti aromatici, è un importante prodotto chimico industriale con un’ampia gamma di applicazioni. È termicamente stabile e subisce una serie di reazioni, tra cui sostituzione, addizione e deidrogenazione, per produrre una miriade di prodotti utili.
Le reazioni di sostituzione del benzene sono di primaria importanza. A seconda delle condizioni di reazione, uno o più atomi di idrogeno nell’anello benzenico possono essere scambiati con nitro, acido solfonico, ammina, idrossile, cloro, bromo o altri gruppi. I prodotti includono fenolo, nitrobenzene, clorobenzene, acido benzenesolfonico e molti altri.
Altre importanti reazioni del benzene comportano l’addizione, come alchilazione e idrogenazione. Queste reazioni generalmente avvengono a temperatura e pressione elevate, a volte richiedendo catalizzatori attivi.
Ad esempio, l’etilbenzene viene prodotto dall’alchilazione del benzene con etilene in presenza di un catalizzatore cloruro di alluminio.
Il cumene è un altro importante prodotto di addizione primaria del benzene, prodotto dall’alchilazione catalitica in fase vapore del benzene con propene su catalizzatori di acido fosforico o kieselguhr a 200-250 °C e 2,7-4,2 MPa di pressione relativa.
Anche l’idrogenazione è una reazione di addizione. Una delle più importanti è l’idrogenazione del benzene per produrre cicloesano.
La deidrogenazione dell’etilbenzene in stirene è un’importante reazione commerciale. Questa reazione endotermica richiede alte temperature per procedere cineticamente e termodinamicamente.
Il benzene è una materia prima essenziale per la produzione di molti altri importanti prodotti chimici, tra cui materie plastiche, resine, detergenti e prodotti farmaceutici. La maggior parte delle reazioni discusse in questo capitolo sono reazioni primarie del benzene. Un’infinità di reazioni e prodotti si basano sul benzene, direttamente o indirettamente, come fonte.
3. Materie prime per il benzene
Il benzene e i suoi omologhi, come toluene e xileni, si trovano nel petrolio greggio in piccole quantità, rendendo la separazione fisica e il recupero poco pratici. Le frazioni di petrolio greggio provenienti dall’Arabia Saudita e dal Regno Unito hanno bassi contenuti di benzene, toluene e xilene (BTX), ma contenuti più elevati di naftene.
I greggi più pesanti e i greggi sintetici provenienti dalle sabbie bituminose possono avere contenuti aromatici più elevati nella frazione di nafta leggera. Un’analisi della frazione di nafta C5-150 °C da un greggio convenzionale e da una nafta sintetica derivata dalle sabbie bituminose di Athabasca mostra che la nafta sintetica ha contenuti aromatici e naftenici inferiori rispetto alla frazione di greggio convenzionale.
Tuttavia, la frazione di nafta più elevata dal greggio sintetico ha un contenuto aromatico considerevolmente più elevato (32 contro 19%), sebbene il contenuto di naftenici sia inferiore. Ciò è probabilmente dovuto alla dealchilazione o all’apertura dell’anello degli aromatici a massa molecolare più elevata nel bitume.
- Visita il link per un articolo dettagliato sulla Produzione di benzene →
4. Utilizzi del benzene
Il benzene viene utilizzato per produrre etilbenzene, cumene e cicloesano, che rappresentano il 75-80% del suo consumo come materia prima chimica.
L’etilbenzene viene deidrogenato in stirene, il monomero per polimeri importanti come le resine acriliche-butadiene-stirene e la gomma stirene-butadiene.
Il cumene viene utilizzato per produrre fenolo e acetone. Il fenolo viene utilizzato principalmente per le resine fenoliche.
Il cicloesano viene utilizzato per produrre acido adipico, che viene utilizzato per realizzare nylon.
Circa il 5% del benzene viene nitrato a nitrobenzene, che viene poi idrogenato a anilina.
Il benzene può anche essere ossidato ad anidride maleica, un precursore per le resine poliestere.
Altri prodotti del benzene includono benzeni alogenati e alchilbenzeni lineari, che vengono utilizzati per realizzare detergenti.
5. Tossicologia e salute occupazionale del benzene
Il benzene è un composto tossico che può causare effetti acuti e cronici. Viene assorbito tramite inalazione, ingestione o assorbimento cutaneo. L’avvelenamento acuto può causare mal di testa, confusione, perdita del controllo muscolare e irritazione del tratto respiratorio e gastrointestinale. Concentrazioni più elevate possono portare a perdita di coscienza o morte. L’esposizione cronica può causare anemia e leucemia.
L’inalazione è la principale fonte di avvelenamento da benzene. L’ingestione può causare irritazione della bocca, dell’esofago e dello stomaco. L’assorbimento cutaneo non è una fonte significativa di avvelenamento.
Diversi studi hanno indagato la tossicità del benzene. Viene assorbito selettivamente dai polmoni e trattenuto in vari tessuti corporei. Il benzene viene metabolizzato lentamente, formando intermedi tossici. La suscettibilità individuale all’avvelenamento varia.
L’esposizione al benzene è stata collegata a leucemia, pancitopenia e anemia aplastica. Sono necessarie ulteriori ricerche per determinare l’esatta relazione causale.
Le emissioni di benzene provengono dalla benzina per motori, dalla carbonizzazione del carbone e storicamente da solventi contenenti benzene.
La prevenzione dell’avvelenamento da benzene comporta buone pratiche di laboratorio e di stabilimento, riducendo al minimo le concentrazioni nelle aree di lavoro e utilizzando misure protettive.
Gli enti normativi hanno stabilito limiti di esposizione al benzene e lo hanno classificato come sostanza potenzialmente cancerogena.
Le recenti normative mirano a ridurre le emissioni di composti organici volatili, tra cui il benzene, dalle raffinerie di petrolio e dagli impianti chimici.
Studi in corso e sforzi normativi riflettono l’impegno attivo nella comprensione e nel controllo della tossicità del benzene.
Sono necessarie ricerche continue e misure rigorose per mitigare i rischi associati all’esposizione al benzene.
Riferimento
- Benzene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_475
