Fluorzwavelzuur: eigenschappen, productie en toepassingen
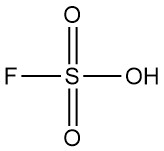
Wat is fluorzwavelzuur?
Fluorzwavelzuur is een anorganische verbinding met de chemische formule HSO3F. Het is een kleurloze tot lichtgele vloeistof met een scherpe geur die gemakkelijk dampt in vochtige lucht. Het wordt erkend als een van de sterkste zuren die commercieel verkrijgbaar zijn.
De fluor-zwavelbinding is sterker dan die van chloorzwavelzuur, waardoor fluorzwavelzuur langzamer wordt gehydrolyseerd dan chloorzwavelzuur. Onder optimale omstandigheden is de synthese van fluorzwavelzuurzouten in een waterige oplossing mogelijk.
Fluorzwavelzuur werd voor het eerst genoemd in 1892, samen met een synthetische methode die waterstoffluoride en zwaveltrioxide gebruikt, wat nog steeds het voorkeursproces is.
Historisch gezien werd fluorzwavelzuur gebruikt in fluoreringsreacties en als katalysator in alkylerings- en cyclisatieprocessen. Industriële processen zoals de productie van boortrifluoride en tetrahydrofuraan-polymerisatie gebruiken fluorzwavelzuur. Ook wordt het sinds de jaren 60 gebruikt bij het chemisch polijsten van loodkristalglas.
Commercieel fluorzwavelzuur bestaat uit ongeveer 99,0% HSO3F, met kleine onzuiverheden zoals zwavelzuur, zwaveltrioxide, zwaveldioxide en ijzer.
Tot op heden hebben zouten en derivaten van fluorzwavelzuur een beperkt industrieel belang.
Inhoudsopgave
1. Fysieke eigenschappen van fluorzwavelzuur
Fluorzwavelzuur is een kleurloze vloeistof die oplosbaar is in polaire organische oplosmiddelen (bijv. nitrobenzeen, azijnzuur en ethylacetaat), maar slecht oplosbaar is in niet-polaire oplosmiddelen.
De fysieke eigenschappen van fluorzwavelzuur worden samengevat in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [7789-21-1] |
| Chemische formule | HSO3F |
| Moleculair gewicht | 100,07 g/mol |
| Smeltpunt | - 88,98 °C |
| Kookpunt |
bij 101,3 kPa: 162,7 °C bij 16,0 kPa: 110 °C bij 2,5 kPa: 77 °C |
| Dichtheid |
bij 18 °C: 1,740 g/cm3 bij 25 °C: 1,725 g/cm3 |
| Dampspanning bij 25 °C | 330 Pa |
| Viscositeit bij 25 °C | 1,56 mPa.s |
| Vormingswarmte (vloeistof) | 792,45 kJ/mol |
2. Productie van fluorzwavelzuur
Fluorzwavelzuur wordt industrieel geproduceerd door waterstoffluoride en zwaveltrioxide in fluorzwavelzuur te roeren als oplosmiddel voor de reactie. Het fluorzwavelzuur wordt gekoeld om de temperatuur in de reactor constant te houden op < 100 °C, zoals weergegeven in Figuur 1.
HF + SO3 → HSO3F
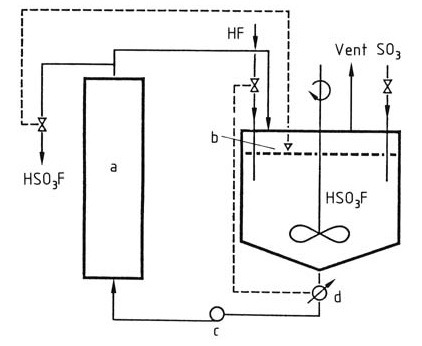
Figuur 1: Productie van fluorzwavelzuur
a) Koeler; b) Niveauregeling; c) Pomp; d) Geleidingsmeter
Als alternatief kan fluorzwavelzuur worden gesynthetiseerd door kaliumwaterstoffluoride of calciumfluoride te laten reageren met oleum (rokend zwavelzuur) bij verhoogde temperaturen (ongeveer 250 °C).
Na de reactie wordt alle resterende waterstoffluoride verwijderd door te spoelen met een inert gas. Het resulterende fluorzwavelzuur kan vervolgens worden gezuiverd door destillatie in een glazen apparaat.
Vanwege de corrosieve aard van fluorzwavelzuur, vereisen de productie en verwerking ervan gespecialiseerde apparatuur en strenge veiligheidsprotocollen.
3. Toepassingen van fluorzwavelzuur
3.1. Toepassingen van fluorzwavelzuur in anorganische chemie
Fluorzwavelzuur wordt gebruikt als een fluoreringsmiddel dat een mildere reactiviteit vertoont in vergelijking met waterstoffluoridezuur. Voorbeelden van fluoreringsreacties zijn de omzetting van siliciumdioxide in siliciumtetrafluoride, boorzuur in boortrifluoride, arseentrioxide in arseentrifluoride en kaliumperchloraat in perchlorylfluoride. De laatste verbinding wordt gebruikt als fluoreringsmiddel in organische synthese.
3.2. Toepassingen van fluorzwavelzuur bij het polijsten van glas
Fluorzwavelzuur wordt gebruikt om loodglaspolijstbaden te herstellen, die 60-70% zwavelzuur, 2-6% waterstoffluoridezuur en water bevatten. Het polijstproces verbruikt deze zuren door het glasoppervlak gedeeltelijk op te lossen, zoals weergegeven in de volgende vergelijkingen:
PbO + H2SO4 → PbSO4 + H2O
SiO2 + 6 HF → H2SiF6 + 2 H2O
Wanneer fluorzwavelzuur aan het polijstbad wordt toegevoegd, wordt het gehydrolyseerd om deze zuren in het zure medium te reproduceren door een deel van het gevormde water te verbruiken.
HSO3F + H2O → H2SO4 + HF
Deze methode vermindert het verbruik van waterstoffluoridezuur met ongeveer 28% en vermindert ook afvalzuur vergeleken met traditionele regeneratietechnieken met zwavelzuur en waterstoffluoridezuur.
3.3. Toepassingen van fluorzwavelzuur in organische chemie
Fluorzwavelzuur katalyseert alkylerings-, polymerisatie- en isomerisatiereacties in organische synthese. Het reactieve alkylfluorosulfaat-tussenproduct is verantwoordelijk voor de katalytische activiteit. Voorbeelden van deze reactie zijn:
- Alkylering van olefinen en isoparaffinen
- Vorming van brandstoffen met een hoog octaangehalte uit koolwaterstoffen met een laag octaangehalte
- Productie van gealkyleerde aromaten en alkylering van fenol tot tert-butylfenol.
Bovendien wordt het gebruikt in polymerisatiereacties, zoals de polymerisatie van tetrahydrofuraan, van ethyleen tot onverzadigde koolwaterstoffen met een lange keten en van trioxaan tot polyoxymethyleen. Isomerisatie van C7-koolwaterstoffen, penteen en methylpenteen wordt ook gekatalyseerd door fluorzwavelzuur.
Selectieve productie van beta-naftol uit naftaleen door katalytische hydroxylatie met waterstofperoxide wordt bereikt met behulp van een combinatie van fluorzwavelzuur en antimoonpentafluoride als katalysatorsysteem.
3.4. Toepassingen van fluorzwavelzuur bij de zuivering van fluor
Fluorzwavelzuur biedt een alternatief voor natriumfluoride voor het verwijderen van waterstoffluoride uit elementair fluor. In tegenstelling tot natriumfluoride, dat slecht oplosbaar natriumwaterstoffluoride vormt, kan het product dat met fluorzwavelzuur wordt gevormd, worden verwijderd door destillatie.
4. Veiligheidsrisico’s en behandeling van fluorzwavelzuur
Fluorzwavelzuur vormt aanzienlijke risico’s voor de menselijke gezondheid vanwege de corrosieve aard en reactiviteit. Contact met ogen, huid of slijmvliezen kan leiden tot ernstige brandwonden en weefselschade. Blootstelling aan dampen kan de luchtwegen irriteren. Hydrolyse van fluorzwavelzuur in aanwezigheid van vocht genereert waterstoffluoride en zwavelzuur, wat de corrosieve effecten verergert.
Waterstoffluoride heeft unieke toxicologische eigenschappen; het dringt door de huid en veroorzaakt diepe weefselschade. Het vermogen om calcium- en magnesiumionen te cheleren verstoort het cellulaire metabolisme.
Strikte naleving van veiligheidsprotocollen is noodzakelijk bij het hanteren van fluorzwavelzuur. Persoonlijke beschermingsmiddelen, waaronder ademhalingsbescherming, chemisch bestendige handschoenen, oogbescherming en volledige bodypakken in ernstige gevallen, zijn verplicht.
Noodprocedures voor blootstellingsincidenten vereisen onmiddellijke decontaminatie met water en een calciumgluconaatoplossing, gevolgd door medische hulp. Inname vereist toediening van magnesiamelk of calciumgluconaatoplossing.
Fluorzwavelzuur kan organische materialen onder specifieke omstandigheden ontsteken. Morsingen moeten met extreme voorzichtigheid worden behandeld, waarbij grote hoeveelheden water worden gebruikt voor verdunning, terwijl de vorming van corrosieve nevels wordt voorkomen.
Bij kleine lekkages wordt het toevoegen van koud geconcentreerd zwavelzuur aanbevolen, gevolgd door verdunning en neutralisatie met kalk.
Referentie
- Fluorosulfuric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a11_431.pub2
