Sorbinezuur: eigenschappen, reacties, productie en toepassingen
Wat is sorbinezuur?
De trans, trans-isomeer van 2,4-hexadieenzuur, algemeen bekend als sorbinezuur, is een onverzadigd vetzuur met een korte keten met de chemische formule C6H8O2. Het is een natuurlijk voorkomend organisch zuur dat eruitziet als een kleurloze vaste stof met een zwakke geur.
Sorbinezuur ontleent zijn naam aan “Sorbus aucuparia Linnaeus”, de wetenschappelijke nomenclatuur van de lijsterbes. In 1859 isoleerde Hofmann een olie met een kenmerkende geur uit onrijpe lijsterbessen door middel van destillatie.
Het primaire bestanddeel van deze olie was parasorbinezuur, geïdentificeerd als het d-lacton van sorbinezuur. Sterke zuren, of alkaliën, katalyseren de omzetting van parasorbinezuur in isomeer sorbinezuur. Onrijpe lijsterbessen bevatten ongeveer 0,1% parasorbinezuur.
Sorbinezuur wordt aangetroffen in de vetafzettingen van bepaalde bladluizen als 2-sorboyl-1,3-dimyristine. Doebner stelde de structuur van sorbinezuur vast in 1890 en het werd voor het eerst gesynthetiseerd in 1900.
Müller (Duitsland) en Gooding (Verenigde Staten) ontdekten onafhankelijk van elkaar de antimicrobiële eigenschappen van sorbinezuur in 1939-1940. De industriële productie van sorbinezuur en kaliumsorbaat begon in de jaren 1950, aanvankelijk in de Verenigde Staten, gevolgd door Duitsland en Japan.
Sorbinezuur wordt gebruikt als primair conserveermiddel voor levensmiddelen vanwege de veiligheid en gunstige sensorische eigenschappen.
Inhoudsopgave
1. Fysieke eigenschappen van sorbinezuur
Sorbinezuur vormt naald- of plaatvormige kristallen met een milde, karakteristieke geur en een licht zure smaak. De oplosbaarheid in water is beperkt, met waarden van 0,16 g, 0,58 g en 3,9 g per 100 ml bij respectievelijk 20 °C, 50 °C en 100 °C.
De oplosbaarheid van sorbinezuur in watervrije alcoholen met een lager moleculair gewicht en watervrij azijnzuur is ongeveer 11–12 g per 100 ml. Vloeibare vetten kunnen 0,5–1 g sorbinezuur per 100 ml oplossen.
Sorbinezuur is vluchtig in stoom zonder ontleding. Deze eigenschap wordt gebruikt voor de analytische isolatie uit voedingsproducten.
De belangrijke fysieke eigenschappen van sorbinezuur staan in de volgende tabel.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [110-44-1] |
| Formule | C6H8O2 |
| Moleculaire massa | 112,13 g/mol |
| Smeltpunt | 132–135 °C |
| Kookpunt | 228 °C (ontleding) |
| Sublimatietemperatuur | boven 60 °C |
| Breukindex | 1,4248 |
| Dichtheid | 1,204 g/cm3 |
| Dissociatieconstante | 1,73×10-5 bij 25 °C |
| pKa | 4,76 |
| Damp druk bij 20 °C | <0,001 kPa |
| Dampspanning bij 100 °C | 0,25 kPa |
| Dampspanning bij 120 °C | 1,3 kPa |
2. Chemische reacties van sorbinezuur
De reactiviteit van sorbinezuur wordt gekenmerkt door de aanwezigheid van een carboxylgroep en een geconjugeerd dubbelbindingssysteem.
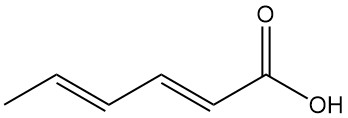
Carboxylzuurreacties omvatten typische reacties zoals de vorming van zouten, esters en andere derivaten. Lithiumaluminiumhydride reduceert de carboxylgroep selectief tot sorbylalcohol (2,4-hexadien-1-ol).
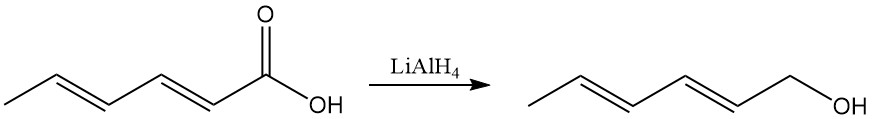
In tegenstelling tot sorbinezuur hebben alkalizouten een hogere oplosbaarheid in water, waardoor ze de voorkeur hebben voor waterige conserveringssystemen. Kaliumsorbaat wordt geproduceerd uit sorbinezuur en kaliumhydroxide en heeft een goede oplosbaarheid in water.
Calciumsorbaat wordt gevormd uit sorbinezuur en calciumhydroxide en wordt gekenmerkt door een lage oplosbaarheid in water.
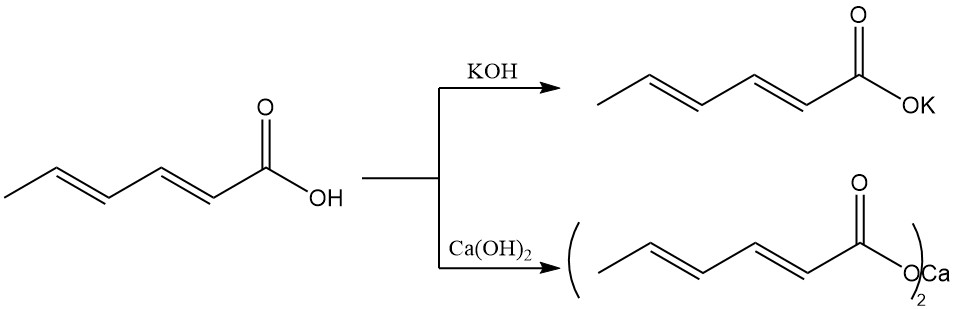
Lagere alkylsorbaat-esters bezitten antimicrobiële eigenschappen en zijn, in tegenstelling tot sorbinezuur, actief in neutrale en zwak alkalische omgevingen.
Reacties waarbij het dubbele bindingssysteem is betrokken, leveren vaak complexe productmengsels op vanwege variërende dubbele bindingsreactiviteiten en potentiële isomerisaties, herrangschikkingen, migraties en polymerisaties.
Additiereacties en gedeeltelijke hydrogenering richten zich bij voorkeur op de 4,5 dubbele binding.
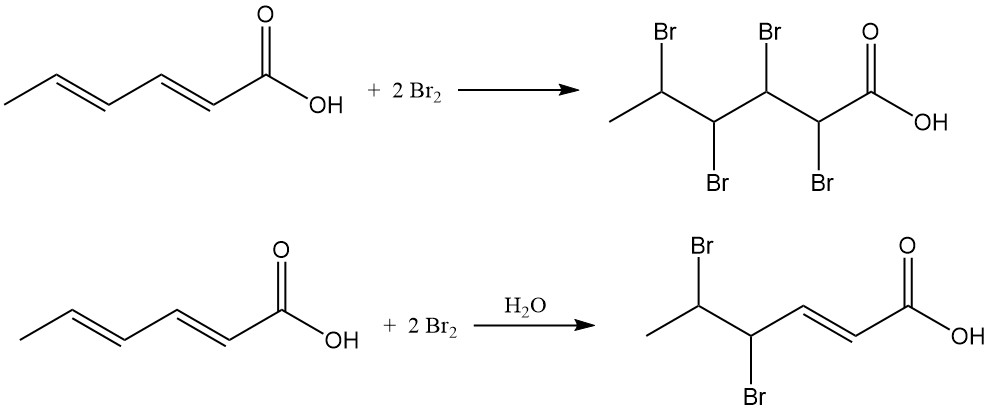
Chlooradditie resulteert in chloorhexeenzuurmengsels met een gemiddeld chloorgehalte van 38–48 gew.%. De reactie van broom met sorbinezuur in organische oplosmiddelen produceert 2,3,4,5-tetrabroomhexaanzuur, terwijl waterige bromering voornamelijk 4,5-dibroom-2-hexeenzuur oplevert.
Ondanks de dubbele onverzadiging vertoont zuiver kristallijn sorbinezuur een hoge weerstand tegen oxidatie in de lucht, en blijft het jarenlang stabiel bij kamertemperatuur. Onzuiverheden zoals oplosmiddelen, zware metalen of isomere hexadieenzuren verminderen de stabiliteit echter aanzienlijk.
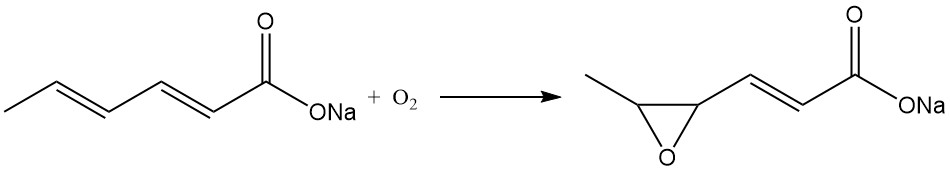
Soortgelijke overwegingen gelden voor kaliumsorbaat, terwijl natriumsorbaat in vaste vorm onstabiel is en niet commercieel wordt geproduceerd. Natriumsorbaat wordt snel omgezet in het natriumzout van 4,5-epoxy-2-hexeenzuur in aanwezigheid van lucht.
Oxidatie van waterige sorbaten of sorbinezuur in organische oplosmiddelen genereert talrijke carbonylverbindingen, hoewel deze reactie afhankelijk is van de aanwezigheid van een grote hoeveelheid zuurstof en sterk wordt verhoogd door blootstelling aan zonlicht.
Zuurstofvrije oplossingen behouden stabiliteit, zelfs bij blootstelling aan licht. Sorbinezuur in voedingsmiddelen met een gemiddelde vochtigheidsgraad ondergaat geleidelijke afbraak gedurende maanden in aanwezigheid van lucht.
De oxidatie van zure waterige sorbinezuuroplossingen met kaliumdichromaat produceert malonaldehyde. De reactie van malonaldehyde met 2-thiobarbituurzuur produceert een rood, fluorescerend 1:2 (malonaldehyde:2-thiobarbituurzuur) adduct, gebruikt als een kleurindicator in sorbinezuuranalyse.
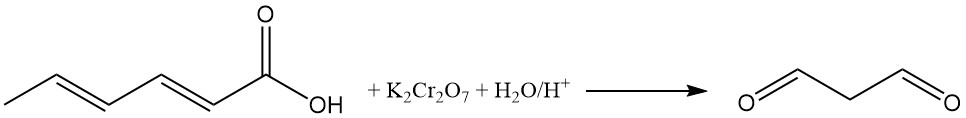
Wanneer het in voedsel wordt verwerkt, komt de stabiliteit van sorbinezuur over het algemeen overeen met die van essentiële voedingscomponenten zoals vitaminen, smaakstoffen en aroma’s. Daarom levert het theoretische autoxidatiepotentieel van sorbinezuur minimale praktische conserveringsuitdagingen op.
3. Productie van sorbinezuur
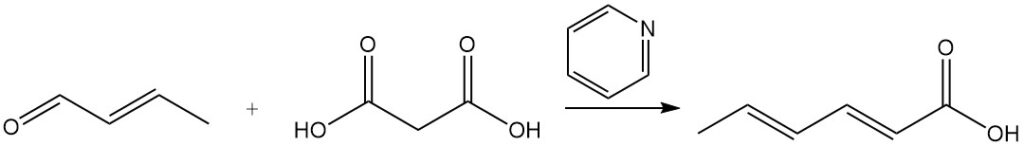
Sorbinezuur werd aanvankelijk gesynthetiseerd door het Doebner-proces, waarbij een condensatiereactie tussen crotonaldehyde en malonzuur in pyridine plaatsvond. Hoewel veel andere syntheses vergelijkbare principes gebruiken, zijn de meeste commercieel onpraktisch vanwege lage opbrengsten, dure uitgangsmaterialen of hoge productiekosten.
Dit geldt ook voor een Union Carbide-proces uit de jaren 1950-1960 dat 2,4-hexadiënal oxideerde tot sorbinezuur met katalysatoren. Het proces werd verlaten vanwege de vorming van maximaal 20% isomere hexadiënoïnezuren, die minder stabiel zijn dan sorbinezuur en een complexe zuivering vereisen. Micro-organismen kunnen 2,4-hexadiënal ook oxideren tot sorbinezuur.
Als alternatief kan sorbinezuur worden geproduceerd door 2,5-hexadiënoïnezuur (1) te isomeriseren door te koken met waterige alkali. 2,5-hexadiënoïnezuur wordt gevormd door de reactie van allylchloride met acetyleen, koolmonoxide en water met behulp van een tetracarbonylnikkelkatalysator.
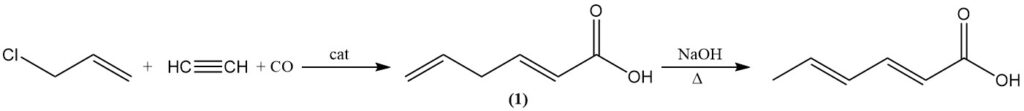
De zure splitsing van 5-vinyl-γ-butyrolacton, dat wordt verkregen uit 1,3-butadieen en azijnzuur met redoxkatalysatoren, is niet van industrieel belang. Koolstofdioxide-additie aan 1,3-pentadieen in aanwezigheid van nikkelcomplexen is een andere mogelijke synthese.
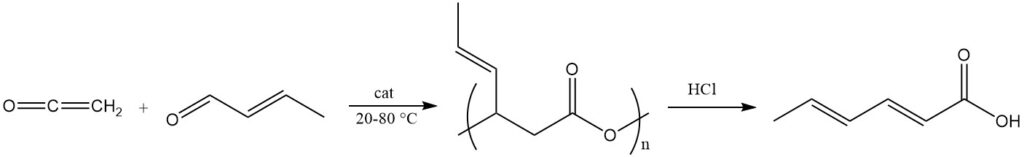
Een gebruikelijk proces gebruikt keteen en crotonaldehyde in aanwezigheid van tweewaardige overgangsmetaalzouten als katalysatoren bij een temperatuur van 20–80 °C om een polymere ester van 3-hydroxy-4-hexeenzuur te verkrijgen met een geschatte moleculaire massa van 2000.
Deze polyester wordt gesplitst om sorbinezuur te verkrijgen door middel van base- of zuurbehandeling (bijv. zoutzuur) of metaalcomplexkatalysatoren. Deze polyester wordt ook gebruikt als een precursor voor de synthese van sorbaatesters door reacties met alcoholen in aanwezigheid van zure veresteringskatalysatoren.
Ruw sorbinezuur wordt gezuiverd door herkristallisatie uit een waterige oplossing, water-alcohol of aceton mengsels, of niet met water mengbare organische oplosmiddelen zoals methylacetaat. Behandeling met organische oplosmiddelen en stoomdestillatie zijn ook gemeld.
4. Toepassingen van sorbinezuur
Sorbinezuur en zijn zouten (voornamelijk kalium- en calciumsorbaten) worden voornamelijk gebruikt als conserveermiddelen vanwege hun lage toxiciteitsprofiel. Het is actief tegen schimmels en gisten. De primaire toepassingsgebieden omvatten:
- Voedsel: kaas (verschillende soorten), gebakken goederen, fruitproducten (pruimen, pulp, marmelade, jam, sappen, gelei en snoepgoed), wijn, gefermenteerde groenten, margarine, boter en worst.
- Diervoeder
- Tabak
- Cosmetica
- Farmaceutica
- Verpakkingsmaterialen voor voedsel, diervoeder, cosmetica en farmaceutica
- Andere producten die in contact komen met de huid van mens of dier
Het is vermeldenswaard dat hoewel potentiële toepassingen voor sorbinezuur in chemische reacties en polymerisaties zijn onderzocht in de octrooiliteratuur, deze toepassingen commercieel onbeduidend blijven vanwege de relatief hoge kosten.
Sorbinezuur kan ook worden gebruikt als additief bij de productie van koud rubber en als tussenproduct in het productieproces van bepaalde weekmakers en smeermiddelen.
5. Toxicologie van sorbinezuur
Sorbinezuur vertoont een lage acute toxiciteit, met een LD50 van ongeveer 10 g/kg lichaamsgewicht bij ratten. Studies rapporteren vergelijkbare waarden variërend van 7,4 tot 8,7 g/kg. Hoewel sorbinezuur slijmvliezen kan irriteren vanwege de zure aard ervan, is huidirritatie ongebruikelijk.
Er zijn uitgebreide toxicologische onderzoeken uitgevoerd naar sorbinezuur vanwege de vroege introductie ervan als conserveermiddel voor levensmiddelen en verplichte testvereisten. Acute, subacute, subchronische en chronische studies tonen consequent een hoog veiligheidsprofiel aan.
Sorbinezuur heeft een laag allergeen potentieel vanwege de kleine moleculaire grootte, waardoor antilichaamvorming en covalente eiwitbinding worden voorkomen, die doorgaans worden geassocieerd met onmiddellijke overgevoeligheid. Gevallen van pseudoallergische reacties op sorbinezuur als voedseladditief zijn zeldzaam.
Subchronische studies bij ratten laten een toegenomen groei en levergewicht zien bij hoge sorbinezuurdoses (10% in voer), wat werd geïnterpreteerd als hypertrofie door een toegenomen metabolische werklast in plaats van toxiciteit.
Langetermijnvoedingsstudies (twee jaar) bij ratten en muizen laten geen carcinogene effecten zien bij lage sorbinezuurconcentraties (1,5-10% in voer). Hogere doses (10%) leiden tot een verminderde gewichtstoename en een vergrote schildklier, lever en nieren.
Sorbinezuur is noch teratogeen, noch mutageen of genotoxisch, en het is niet-carcinogeen.
Metabool ondergaat sorbinezuur β-oxidatie, vergelijkbaar met andere vetzuren.
Zowel sorbinezuur als kaliumsorbaat vertonen een laag allergeen en fototoxisch potentieel. Er is één geval van type 4 allergische reactie gemeld, ondanks wijdverbreid gebruik gedurende meer dan 40 jaar. Het Cosmetic Ingredient Review (CIR) Expert Panel classificeert beide stoffen als “veilig” voor cosmetica.
Natriumsorbaat, dat niet vaak in voedingsmiddelen wordt gebruikt vanwege de gevoeligheid voor oxidatie, vertoont in vitro een lage genetische toxiciteit, in tegenstelling tot sorbinezuur en kaliumsorbaat.
Referenties
- Sorbic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_507.pub2
- https://pubmed.ncbi.nlm.nih.gov/2079232/
