Methacrylzuur: eigenschappen, productie en toepassingen
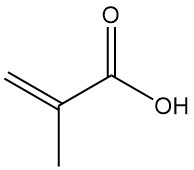
Methacrylzuur, ook bekend als α-methylacrylzuur of 2-methylpropeenzuur, is een organisch zuur met de formule CH2=C(CH3)COOH. Het is een kleurloze, matig vluchtige, corrosieve vloeistof met een sterk zure geur.
Methacrylzuur werd voor het eerst geproduceerd in 1865 uit ethylmethacrylaat, dat werd bereid door dehydratie van ethyl-α-hydroxyisobutyraat.
Inhoudsopgave
1. Geschiedenis van methacrylzuur en methacrylaten
De wetenschappelijke verkenning van acrylaten en methacrylaten voor commerciële toepassingen begon met het proefschrift van OTTO ROEHΜ in 1901. Hij onderzocht de polymerisatieproducten van acrylzuur-derivaten en voorzag hun potentiële industriële toepassing.
Roehml rapporteerde de synthese van transparante, rubberachtige materialen, maar miste destijds efficiënte productiemethoden. In 1907 ging hij een partnerschap aan met OTTO HAAS om een bedrijf op te richten dat zich richtte op enzymen voor leerbehandeling.
Aanzienlijke vooruitgang in de commerciële productie van acrylaten en methacrylaten vond plaats in de jaren 1920. Na de Eerste Wereldoorlog ontwikkelde Roehml een proces voor grootschalige acrylaatproductie met behulp van ethyleencyaanhydrine, een tussenproduct afgeleid van ethyleenchloorhydrine.
Later werkte hij samen met Walter Bauer om een soortgelijk proces voor methylmethacrylaat op te zetten met behulp van acetoncyaanhydrine. In 1931 had Bauer met succes een helder en transparant methylmethacrylaatpolymeer geproduceerd dat zacht werd boven 100 °C.
In de jaren 30 werd er intensief onderzoek gedaan naar het vervaardigen van gegoten platen uit methylmethacrylaat door Rohm and Haas en Du Pont (VS), Rohm and Haas AG (Duitsland) en ICI (Engeland).
De eerste commerciële productie van methylmethacrylaatmonomeer begon in Darmstadt, Duitsland (1933), via de acetoncyaanhydrineroute, waarbij de cyanohydrine werd omgezet in ethyl-α-hydroxyisobutyraat, gevolgd door dehydratie met P2O5.
ICI verkreeg in 1934 een patent voor een alternatieve methode die acetoncyaanhydrine omzette in methacrylamidesulfaat met behulp van geconcentreerd zwavelzuur. Methacrylzuur, verkregen door hydrolyse van methacrylamidesulfaat, kon vervolgens worden veresterd om methylmethacrylaat te vormen.
Rohm and Haas AG erkende de efficiëntie van het ICI-proces en sloot een kruislicentieovereenkomst voor de productie van gegoten acrylplaten. Vervolgens zijn zowel ICI als Rohm and Haas AG in 1937 begonnen met de commerciële productie van methylmethacrylaat via de methacrylamidesulfaatroute.
Rohm and Haas in de Verenigde Staten, destijds een onafhankelijk bedrijf sinds 1917, bleef het oorspronkelijke proces nog enkele jaren gebruiken vanwege licentiebeperkingen.
De methacrylamidesulfaatroute bleef het belangrijkste commerciële proces voor de productie van methylmethacrylaat en methacrylzuur tot de introductie van isobuteenoxidatieprocessen in 1983. Deze processen werden onafhankelijk ontwikkeld in Japan door Japan Catalytic Chemical en Mitsubishi Rayon.
Terwijl er in Japan extra capaciteit voor methacrylzuur op basis van isobuteen is gepland en er een nieuwe ethyleenfabriek wordt gebouwd door BASF, wordt de acetoncyaanhydrineroute nog steeds gebruikt voor een aanzienlijk deel van de wereldwijde vraag naar methylmethacrylaat.
Op aceton-cyaanhydrine gebaseerde activiteiten leveren voornamelijk methylmethacrylaat op, het belangrijkste methacrylaatderivaat. Methacrylzuur dat via andere routes wordt geproduceerd, wordt ook gebruikt als tussenproduct voor de synthese van methylmethacrylaat.
Kleinere hoeveelheden van andere methacrylaten, waaronder ethylmethacrylaat, n-butylmethacrylaat, isobutylmethacrylaat en hogere homologen zoals laurylmethacrylaat en stearylmethacrylaat, worden geproduceerd door directe verestering van methacrylzuur of transesterificatie van methylmethacrylaat.
Daarnaast zijn speciale monomeren zoals 2-hydroxyethylmethacrylaat, 2-hydroxypropylmethacrylaat, aminoalkylmethacrylaten (bijv. 2-dimethylaminoethylmethacrylaat) en methacrylamide commercieel verkrijgbaar. Het tussenproduct methacrylamidesulfaat is de voorloper voor de productie van methacrylamide.
2. Fysische eigenschappen van methacrylzuur
Methacrylzuur is een zwak organisch zuur met een pKa van 4,65. Het is een heldere, kleurloze vloeistof of kleurloze kristallen met een scherpe, afstotende geur. Het is oplosbaar in chloroform en mengbaar met water, ethanol en ether.
De belangrijkste fysieke eigenschappen van methacrylzuur staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht | 86,09 g/mol |
| Smeltpunt, °C | 15,8 |
| Kookpunt (101,3 kPa), °C | 162 |
| Dichtheid, g/cm3 | 1,015 |
| Breukindex | 1,4288 |
| Dampspanning, kPa |
bij 20 °C: 0,09 bij 60 °C: 1,33 |
| Viscositeit (24 °C), mPa·s | 1,38 |
| Oplosbaarheid in water | Mengbaar |
| Kritische temperatuur, °C | 370 |
| Kritische druk, Pa | 4,70 |
| Kritisch volume, cm3/mol | 270 |
| Verdampingswarmte (101,3 kPa), kJ/mol | 0,418 |
| Soortelijke warmtecapaciteit, J g-1 K-1 | 2,1 |
| Vlampunt, °C |
Open beker: 77 Gesloten beker: 67 |
| Zelfontbrandingstemperatuur, °C | 400 |
3. Chemische reacties van methacrylzuur
Methacrylzuur is zeer reactief en vertoont reacties die typerend zijn voor zowel het alkeen als het carbonzuur.
Het elektronenonttrekkende effect van het carbonzuur polariseert de dubbele binding en verbetert de reactiviteit ervan, maar deze reactiviteit is minder uitgesproken dan in acrylzuur vanwege de elektronendonerende methylgroep.
Als gevolg hiervan vinden nucleofiele Michael- en Michael-achtige addities aan de dubbele binding alleen plaats met elektronenrijke reagentia.
3.1. Additie aan de koolstof-koolstof dubbele binding
Methacrylzuur reageert met waterstofcyanide, waterstofhalogeniden, waterstofsulfide, mercaptanen, alkylaminen, alcoholen, fenolen of fosfines om β-gesubstitueerde α-methylpropionaten te produceren.
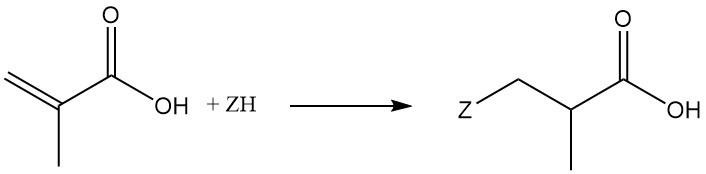
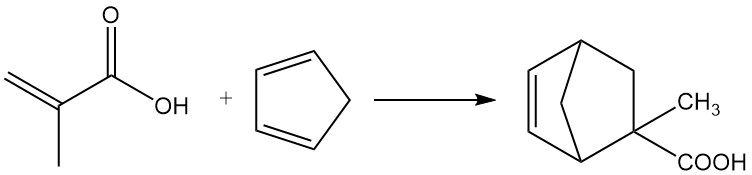
3.2. Diels-Alder-reacties
Methacrylzuur ondergaat Diels-Alder-reacties met diënen zoals butadieen en cyclopentadieen.
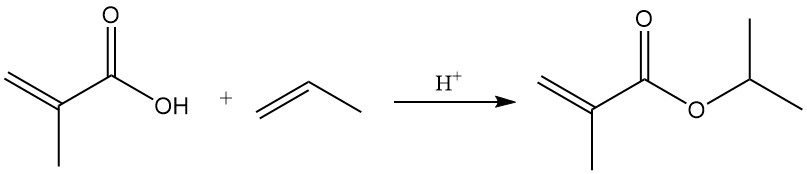
3.3. Reacties van de carbonzuurfunctie
Esters van methacrylzuur worden gevormd door reacties met alcoholen in aanwezigheid van katalytische hoeveelheden zwavelzuur of sulfonzuur. Zuurgekatalyseerde additie van olefinen produceert ook esters.
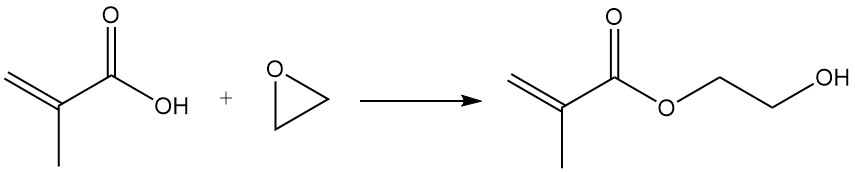
Reactie van de methacrylzuurgroep met epoxiden in aanwezigheid van katalysatoren zoals anionenwisselaarharsen, ijzerchloride of lithiumzouten levert hydroxyethyl- en hydroxypropylmethacrylaten op.
Methacryloylchloride wordt gesynthetiseerd door de reactie van methacrylzuur met thionylchloride of fosfortrichloride.
Methacrylzuur reageert met azijnzuuranhydride om methacrylzuuranhydride te produceren.
3.4. Polymerisatie
Polymeren van methacrylzuur en zijn derivaten worden gemakkelijk gevormd bij verhitting in aanwezigheid van vrije radicaleninitiatoren zoals peroxiden, UV-licht of ioniserende straling.
Veelgebruikte fenolische remmers richten zich op peroxyradicalen en remmen het geïnitieerde polymerisatieproces niet. Zuurstofuitsluiting is echter cruciaal tijdens polymerisatie om de omzetting van alkylradicalen in hydroperoxyradicalen te voorkomen.
4. Industriële productie van methacrylzuur
Deze sectie richt zich op commercieel haalbare methoden voor de productie van methacrylzuur. Voor deze processen worden verschillende grondstoffen gebruikt, gecategoriseerd op basis van hun koolstofketenlengte: ethyleen (C2-route), propeen of aceton (C3-route) en isobuteen (C4-route).
De economische haalbaarheid van elk proces hangt af van de regionale beschikbaarheid en prijs van grondstoffen. Momenteel overtreft geen enkel alternatief de gevestigde acetoncyaanhydrineroute in economische termen, wat de voortzetting van de exploitatie van bestaande op cyanohydrine gebaseerde fabrieken rechtvaardigt.
4.1. Productie van methacrylzuur via de acetoncyaanhydrineroute
De meest voorkomende methode voor de synthese van methacrylzuur omvat de hydrolyse van methacrylamidesulfaat, afgeleid van acetoncyaanhydrine.
Acetoncyaanhydrine wordt gevormd door droge aceton te laten reageren met waterstofcyanide in aanwezigheid van een basische katalysator. Dit tussenproduct reageert vervolgens met overtollig geconcentreerd zwavelzuur om methacrylamidesulfaat te verkrijgen.
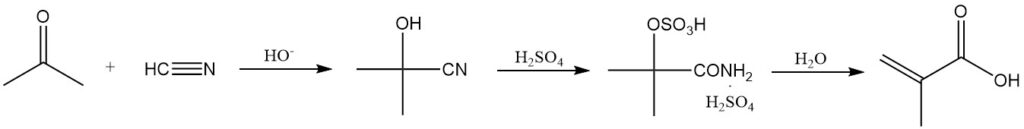
Het zwavelzuur dient een dubbel doel: als reactant en als reactieoplosmiddel. Onvoldoende zwavelzuur resulteert in een moeilijk te hanteren reactiemengsel. Zowel het zuur als acetoncyaanhydrine moeten watervrij zijn om de vorming van bijproducten te minimaliseren.
De eerste reactie, uitgevoerd in een reeks geroerde tankreactoren, vereist een goede warmteoverdracht om het exotherme proces te beheren. Grondig mengen is cruciaal om te voorkomen dat de cyanohydrine ontbindt in zijn uitgangsmaterialen, die ongewenste bijproducten kunnen vormen.
Na de eerste reactie (80–110 °C) ondergaat het mengsel een korte thermische kraak (125–160 °C) om het grootste deel van het a-hydroxyisobutyramide-bijproduct om te zetten in het gewenste methacrylamidesulfaat, samen met wat aceton, koolmonoxide en water.
De tweede fase omvat het hydrolyseren van de methacrylamidesulfaatstroom met overtollig water om methacrylzuur en ammoniumbisulfaat te produceren, of het behandelen ervan met waterige methanol in een gecombineerde hydrolyse-esterificatiestap om een mengsel van methylmethacrylaat en methacrylzuur te verkrijgen.
De totale opbrengst op basis van acetoncyaanhydrine ligt doorgaans binnen het bereik van 80-90%.
Voor de productie van methacrylzuur resulteert de hydrolyse in een tweefasenmengsel dat afzonderlijke zuivering van methacrylzuur uit de bovenste organische laag en verdund waterig methacrylzuur uit de onderste laag mogelijk maakt via respectievelijk destillatie en stoomstrippen.
De wens om regeneratie van zwavelzuur en de bijbehorende gevaren van het transport van waterstofcyanide te elimineren, zijn belangrijke drijfveren voor het verkennen van alternatieve productiemethoden.
De gevestigde acetoncyaanhydrineroute profiteert echter van het economische voordeel van het gebruik van aceton (een bijproduct van fenolproductie) en waterstofcyanide (een bijproduct van acrylonitrilproductie) als grondstoffen.
4.2. Productie van methacrylzuur uit isobuteen
In de afgelopen jaren hebben bedrijven als Nihon Methacryl Monomer (een joint venture van Sumitomo en Nippon Shokubai) en Mitsubishi Rayon een tweefasig katalytisch oxidatieproces ontwikkeld om methacrylzuur te produceren uit isobuteen of tert-butanol.
Het proces omvat de oxidatie van isobuteen tot methacroleïne, dat vervolgens verder wordt geoxideerd tot methacrylzuur.
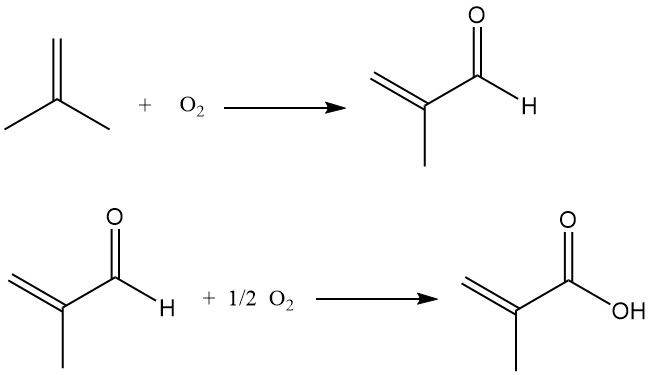
Gepubliceerde rapporten vergelijken dit proces voor de productie van methacrylzuur uit isobuteen met een soortgelijk proces voor de productie van acrylzuur uit propeen. De belangrijkste uitdaging ligt in het handhaven van een hoge katalysatorselectiviteit tijdens de tweede oxidatiefase, die doorgaans het beste presteert bij gematigde conversiepercentages (65–85%).
Het Sumitomo-Nippon Shokubai-proces (figuur 1) overwint deze uitdaging door de reactor van de eerste fase te laten werken bij een hoge conversie en zijn effluent rechtstreeks naar de tweede oxidatiereactor te voeren. De tweede fase werkt bij een lagere conversiesnelheid om de katalysatorselectiviteit en levensduur te optimaliseren.
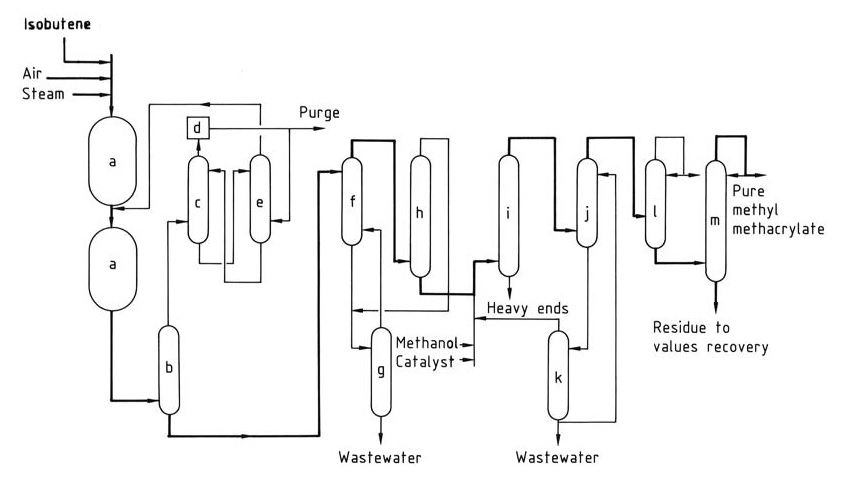
a) Oxidatiereactoren; b) Quencher; c) Absorber; d) Verbrandingseenheid; e) Methacroleïne-terugwinningstoren; f) Oplosmiddelextractie-eenheid; g) Oplosmiddelstriptoren; h) Oplosmiddelterugwinnings-/dehydratatietoren; i) Veresteringsreactor; j) Extractor; k) Destillatie-eenheid; l) Stripper voor lichte eindproducten; m) Productdestillatiekolom.
Niet-gereageerde methacroleïne uit de tweede fase wordt vervolgens gescheiden en gerecycled, waardoor een totale opbrengst van methacrylzuur uit isobuteen van ongeveer 65-70% wordt bereikt.
Katalysatoren in de eerste oxidatie zijn doorgaans metaaloxiden met meerdere componenten die bismut, molybdeen en andere metalen bevatten om de activiteit te verbeteren en de selectiviteit te regelen. Voor de tweede oxidatie worden katalysatoren op basis van fosfomolybdeenzuur gebruikt. Extra elementen zoals koper en vanadium kunnen ook aanwezig zijn.
Het effluent van de tweede fase-oxidatiereactor wordt geblust (b) om ruw waterig methacrylzuur te verkrijgen. De resterende gasstroom wordt door een absorber (c) geleid, waar niet-gereageerde methacroleïne wordt geabsorbeerd (meestal met behulp van waterig carbonzuur).
Afgassen van de absorber worden verbrand (d) voordat ze worden vrijgegeven. Een deel van de verbrande gassen kan worden gerecycled naar de eerste fase als een inert verdunningsmiddel. Het methacroleïne beladen absorbens wordt overgebracht naar een terugwinningstoren (e) voor recycling terug naar de tweede fase reactor. De teruggewonnen absorbensoplossing wordt teruggevoerd naar de absorber.
Ruw methacrylzuur ondergaat oplosmiddelextractie (f) gevolgd door dehydratie in een oplosmiddelterugwinnings-/dehydratietoren (h) om ruw methacrylzuur als bodemproduct te verkrijgen.
Het gerecyclede organische oplosmiddel wordt teruggevoerd naar de extractiestap, terwijl de waterige overhead wordt gecombineerd met het extractorraffinaat en wordt verzonden voor oplosmiddelstripping (g) vóór afvalwaterbehandeling.
Het droge, ruwe methacrylzuur kan verder worden gezuiverd of direct naar een veresteringsreactor (i) worden gestuurd met methanol en katalysator voor conversie naar methylmethacrylaat.
Verschillende bedrijven, waaronder Nippon Shokubai, Mitsubishi Rayon, Mitsui Toatsu, Kyowa Gas, Nippon Kayaku, Rohm and Haas en Oxirane, hebben geïnvesteerd in het onderzoek, de ontwikkeling en de commercialisering van dit proces.
4.3. Productie van methacrylzuur uit isoboterzuur
Een alternatieve methode voor de productie van methacrylzuur is de zuurgekatalyseerde carbonylering van propeen tot isoboterzuur, gevolgd door oxidatieve dehydrogenering. In tegenstelling tot het acetoncyaanhydrineproces gebruikt dit proces propeen als uitgangsmateriaal.
Hoewel het nog niet commercieel operationeel is, onderzoeken verschillende grote producenten van methylmethacrylaat actief het commercialiseringspotentieel ervan.
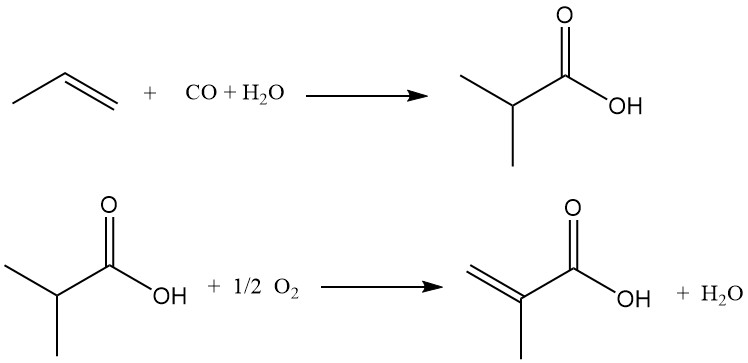
De eerste fase omvat het laten reageren van propeen, koolmonoxide en water in aanwezigheid van een sterke zure katalysator (zwavelzuur, waterstoffluoride of boorfluoride) om isoboterzuur te produceren. Gecontroleerde toevoeging van water tijdens carbonylering maakt directe synthese van isoboterzuur mogelijk.
Waterstoffluoride kan in dit proces zowel als oplosmiddel als katalysator fungeren. De reactie verliep van 30 °C bij 20 MPa tot 120 °C bij 14 MPa, met een licht watertekort ten opzichte van propeen. Na de reactie ondergaat de productstroom een gefaseerde flash-scheiding:
- Fase 1: Wint overtollig koolmonoxide terug voor recycling.
- Fase 2: Verwijdert inerte gassen en eventueel waterstoffluoride of isopropylfluoride door middel van scrubben met een bijtende oplossing.
Het grootste deel van het waterstoffluoride wordt vervolgens gescheiden en gerecycled, waarbij eventuele resterende fluorhoudende materialen in de onderste stroom worden gehydrolyseerd en het vrijgekomen waterstoffluoride wordt gerecycled.
Een laatste destillatiestap zuivert het isoboterzuur voor de volgende fase. Bijproducten van meerdere propeencondensaties voorafgaand aan carbonylering zijn aanwezig in de destillatiebodems, maar de algehele propeenselectiviteit is naar verluidt 95-97%.
In de tweede fase worden isoboterzuur, stoom en lucht over een vaste-bedkatalysator in een multitubulaire reactor geleid, waarbij oxidatieve dehydrogenatie tot methacrylzuur plaatsvindt.
Het reactoreffluent wordt geblust om een waterige methacrylzuurstroom te verkrijgen. Dit ruwe product bevat bijproducten zoals aceton en azijnzuur, samen met koolmonoxide, kooldioxide en niet-condenseerbare gassen die worden verbrand.
Methacrylzuur wordt geïsoleerd door oplosmiddelextractie en dehydratie, gevolgd door destillatie. Isoboterzuur en azijnzuur worden vervolgens gescheiden als lichte uiteinden vóór de uiteindelijke methacrylzuurdestillatie. Het scheiden van isoboterzuur van methacrylzuur is een uitdaging vanwege de dicht bij elkaar liggende kookpunten van de twee zuren.
Er worden twee hoofdtypen katalysatoren gebruikt voor de dehydrogenering van isoboterzuur tot methacrylzuur:
- Mo-P-V gemengde oxidekatalysatoren ontwikkeld door Mitsubishi Chemical Industries, R€ohm en anderen. Deze fosfomolybdaatzuurderivaten bereiken vaak conversies van 99,8% met selectiviteiten van meer dan 74%.
- IJzerfosfaatkatalysatoren van Ashland Oil. Deze katalysatoren bieden selectiviteiten van 84-85% bij conversies van 85-95%, maar vereisen werking bij hogere temperaturen (400 °C) vergeleken met fosfomolybdaatkatalysatoren.
4.4. Productie van methacrylzuur uit ethyleen
Naast de dominante processen die eerder zijn beschreven, bestaan er andere alternatieve methoden voor de productie van methacrylzuur. Methacrylzuur kan worden bereid door condensatie van formaldehyde met propionzuur of door condensatie van formaldehyde met propanal om methacroleïne te vormen, dat vervolgens wordt geoxideerd tot methacrylzuur.
BASF heeft een proces op de markt gebracht dat is gebaseerd op de condensatie van formaldehyde met propanal, waarbij ethyleen, synthesegas en formaldehyde als grondstoffen worden gebruikt. Hun fabriek, die sinds 1990 operationeel is, heeft een productiecapaciteit van 40.000 metrische ton per jaar.
In het BASF-proces wordt ethyleen gehydroformyleerd tot propanal, dat condenseert met formaldehyde om methacroleïne te vormen. Methacroleïne wordt katalytisch door lucht geoxideerd tot methacrylzuur.
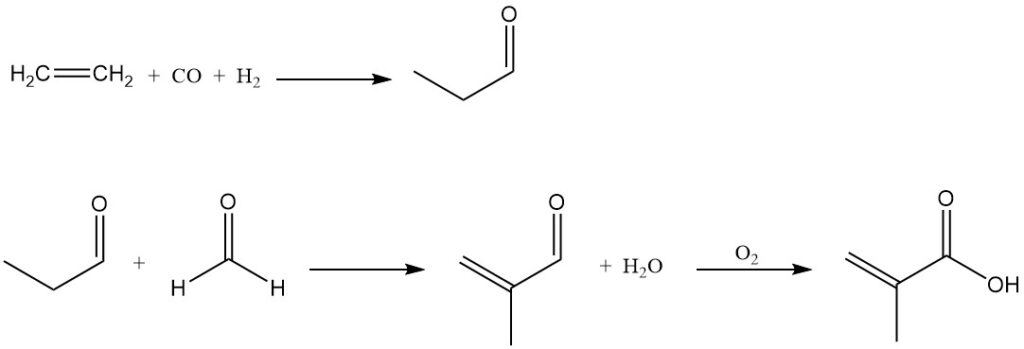
Er wordt een alternatief proces voorgesteld dat de oxidatie van propanal tot propionzuur omvat, gevolgd door de condensatie ervan met formaldehyde om direct methacrylzuur te produceren.
5. Toepassingen van methacrylzuur
Methacrylzuur wordt gebruikt om een breed scala aan polymeren te bereiden, waaronder methacrylaten, en om de esters ervan te produceren. Deze polymeren leveren waterheldere, taaie kunststoffen die in plaatvorm worden gebruikt in beglazing, borden, displays en verlichtingspanelen.
Door polymeerkorrels te vormen, kunnen autoverlichtingslenzen en soortgelijke producten worden bereid.
Hogere methacrylaatpolymeren worden gebruikt bij de productie van olieadditieven, oplosmiddelvrije inkten en coatings en bindmiddelen voor xerografie.
Methacrylzuur wordt gebruikt in verf, kleefstoffen, leerbehandelingsmiddelen en als grondstof bij de productie van ionenuitwisselingsharsen.
Zouten van poly(methacrylzuur) worden gebruikt als additieven in detergenten en als in water oplosbare verdikkers.
6. Toxicologie van methacrylzuur
Methacrylzuur wordt als licht tot matig gevaarlijk beschouwd op basis van orale en dermale blootstellingsstudies bij ratten en konijnen.
Slijmvliezen zijn zeer gevoelig voor methacrylzuur. Blootstelling kan irritatie veroorzaken, variërend van licht tot bijtend, wat mogelijk kan leiden tot permanente oogschade of blindheid. Volledige oogbescherming is verplicht tijdens het hanteren.
Direct contact kan roodheid en irritatie van de huid veroorzaken, variërend van mild tot ernstig, inclusief mogelijke corrosie. Methacrylzuur is corrosiever dan zijn esters. Handschoenen en beschermende kleding zijn vereist.
Overmatige blootstelling aan methacrylzuurdampen kan de neus en keel irriteren en kan duizeligheid, slaperigheid of depressie van het centrale zenuwstelsel veroorzaken.
Het inslikken van methacrylzuur kan de mond, keel, slokdarm en maag ernstig irriteren, wat ongemak, braken, diarree, duizeligheid en mogelijke collaps kan veroorzaken.
Herhaalde blootstelling aan de huid kan leiden tot allergische dermatitis (uitslag, jeuk en zwelling). Individuen kunnen gevoelig worden na blootstelling, wat leidt tot reacties van latere blootstelling aan dezelfde of andere acrylmonomeren.
Studies bij dieren die werden blootgesteld aan extreem hoge dampconcentraties methacrylzuur hebben ontstekingen van de luchtwegen en degeneratieve veranderingen in organen (lever, nieren en hart) aangetoond op niveaus die de irritatiedrempels ver overschrijden. Dergelijke effecten zijn niet gemeld bij mensen.
Referenties
- Methacrylic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_441.pub2
- https://www.m-chemical.co.jp/en/products/departments/mcc/mma_pmma/product/1201254_9386.html
- https://www.basf.com/global/documents/en/products-and-industries/acrylic-monomers/technical-information/TI_CP_1574_e_Methacrylic_acid_technical_190419_SCREEN_02.pdf
