Isopreen: eigenschappen, productie en toepassingen
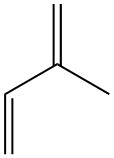
Wat is isopreen?
Isopreen, ook bekend als 2-methyl-1,3-butadieen, is een koolwaterstof met vijf koolstofatomen die in de natuur in sporen voorkomt. Het is een kleurloze, vluchtige vloeistof met de chemische formule C5H8.
Isopreen wordt gebruikt als een fundamenteel bouwsteen voor talloze natuurlijke producten. Deze omvatten terpenen (natuurlijk rubber, kamfer), vitamine A en steroïde geslachtshormonen (volgens de “isopreenregel” van Wallach en Ruzicka). Het werd voor het eerst gesynthetiseerd door pyrolyse van natuurlijk rubber in 1860 door Williams.
Inhoudsopgave
1. Fysieke eigenschappen van isopreen
Onder normale omstandigheden is isopreen een kleurloze, vluchtige vloeistof die onoplosbaar is in water bij 20 °C. Het is mengbaar met organische oplosmiddelen zoals ethanol, di-ethylether, aceton en benzeen.
Isopreen vormt binaire azeotrope mengsels met verschillende verbindingen zoals methanol, n-pentaan, koolstofdisulfide, methylformiaat, broomethaan, ethanol, dimethylsulfide, aceton, propyleenoxide, ethylformiaat, isopropylnitriet, methylal, di-ethylether, perfluorotriethylamine, acetonitril en isopropylamine.
Belangrijke fysieke eigenschappen van isopreen worden gedetailleerd beschreven in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht | 68,118 g/mol |
| Smeltpunt (101,3 kPa) | -145,95 °C |
| Kookpunt (101,3 kPa) | 34,059 °C |
| Kritische temperatuur | 483,3 K |
| Kritische druk | 3,74 MPa |
| Kritisch volume | 266 cm3/mol |
| Dichtheid (293 K) | 0,68095 g/cm3 |
| Viscositeit (293 K) | 0,216 mPa.s |
| Oppervlaktespanning (293 K) | 18,22 mN/m |
| Breukindex | 1,42194 |
| Dampspanning | |
| -20 °C | 9,8 kPa |
| 0 °C | 26,4 kPa |
| 20 °C | 60,7 kPa |
| 34,059 °C | 101,3 kPa |
| 40 °C | 123,8 kPa |
| 60 °C | 229,1 kPa |
| 80 °C | 392,1 kPa |
| 100 °C | 629,5 kPa |
| Soortelijke warmte | |
| Damp (298 K) | 102,69 J mol-1 K-1 |
| Vloeistof (298 K) | 151,07 J mol-1 K-1 |
| Explosiegrenzen in lucht (totale druk 13 kPa, 25 °C) | |
| Bovengrens | 7 – 9,7 vol% (200 – 275 g/m3) |
| Ondergrens | 1 – 1,5 vol% (28 – 40 g/m3) |
| Maximale explosiedruk | 0,66 MPa |
2. Chemische eigenschappen van isopreen
Spectroscopische analyse geeft aan dat bij 50 °C de meerderheid van de isopreenmoleculen in de s-trans-conformatie bestaat. Slechts 15% neemt de s-cis-vorm met hogere energie aan.
Als geconjugeerd dieen vertoont isopreen kenmerkend gedrag. De aanwezigheid van een methylgroep verbetert de reactiviteit met elektrofielen en Diels-Alder-diënofielen vergeleken met butadieen.
Isopreen is reactiever dan butadieen vanwege de vier unieke waterstofatomen vergeleken met de twee van butadieen. Isopreen neemt deel aan een breed scala aan reacties, waaronder substitutie, additie, ringvorming, complexvorming en telomerisatie.
De reactie met hydroxylradicalen is het dominante pad voor isopreenafbraak in de atmosfeer. Hydroxylradicalen, zeer reactieve moleculen, initiëren een complexe kettingreactie die isopreen afbreekt in verschillende producten. Het kan ook worden afgebroken door ozon.
Onder hoge temperaturen en specifieke omstandigheden vormt isopreen peroxiden en vrije radicalen, wat uiteindelijk leidt tot de afbraak van isopreen in verschillende producten zoals dimethoxymethaan en naftaleen.
Isopreen kan additiereacties ondergaan die vergelijkbaar zijn met alkenen, maar is niet selectief en resulteert in een mengsel van producten.
De enige belangrijke chemische reactie van isopreen is de omzetting in terpenen. Isopreen wordt voornamelijk gebruikt bij de synthese van polymeren.
3. Productie van isopreen
3.1. Productie van isopreen uit olefinen
Isopreen wordt voornamelijk geproduceerd door de zuurgekatalyseerde Prins-reactie van formaldehyde met isobuteen, waarbij 4,4-dimethyl-1,3-dioxaan wordt geproduceerd, dat vervolgens in de gasfase (bij 200 – 300 °C) wordt gesplitst om isopreen te verkrijgen en de helft van de formaldehyde terug te winnen.
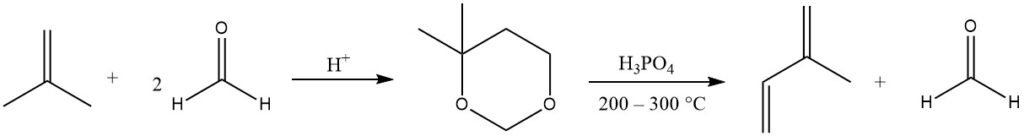
Verschillende bedrijven hebben dit proces verfijnd vanwege de gemakkelijk verkrijgbare grondstoffen. Huidige productiefaciliteiten van dit type bestaan in Japan.
Inspanningen zijn gericht op het vereenvoudigen en verbeteren van de kosteneffectiviteit van isopreensynthese uit isobuteen en formaldehyde. Takeda Chemical in Japan stelde een eenstaps gasfaseproces voor met behulp van oxidekatalysatoren.
Formaldehydebijproducten vormen een uitdaging. Bedrijven zoals Idemitsu en Sun Oil gebruiken formaldehydederivaten (methylal, dimethoxymethaan) om harsvorming te voorkomen. Alternatieve methoden omvatten het direct integreren van formaldehydeproductie in het proces met behulp van methanol en zuurstof of methyl-tert-butylether (MTBE) en zuurstof.
Japanse patenten onderzochten tert-butylalcohol als een C4-bron, terwijl eerdere Sovjetpublicaties methoden beschreven op basis van 1,3-dioxaansplitsing.
Het eenstaps gasfaseproces wordt beperkt door de lage katalysatorruimte-tijdopbrengst en snelle deactivering. Het is onduidelijk of een van deze variaties commerciële productie heeft bereikt.
2-Methylbutanal is een andere grondstof voor de productie van isopreen. Het wordt geproduceerd door hydroformylering van 2-buteen met behulp van een rhodiumkatalysator.
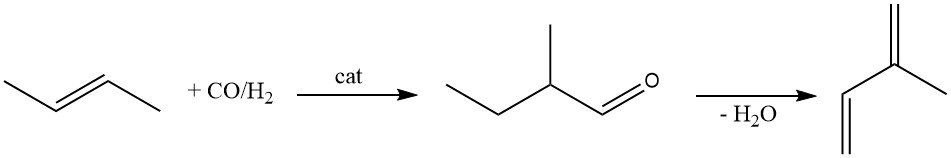
De katalytische dehydratie van 2-methylbutanal tot isopreen is uitgebreid bestudeerd. Hoewel er talloze katalysatoren zijn voorgesteld (β-fosfaat, magnesiumammoniumfosfaat, moleculaire zeven en zeolieten), lijden ze allemaal aan snel activiteitsverlies.
Zeolieten die zijn gemodificeerd met silaan of cesium vertonen echter een verbeterde levensduur. Splitsing van 3-methylbutanal leverde slechtere resultaten op. Momenteel gebruikt geen enkele industriële faciliteit de synthese van isopreen uit 2-methylbutanal.
Codimerisatie van ethyleen en propeen leidt tot 2-methyl-1-buteen, dat kan worden gedehydrogeneerd tot isopreen, maar deze methode bevindt zich nog in het experimentele stadium.
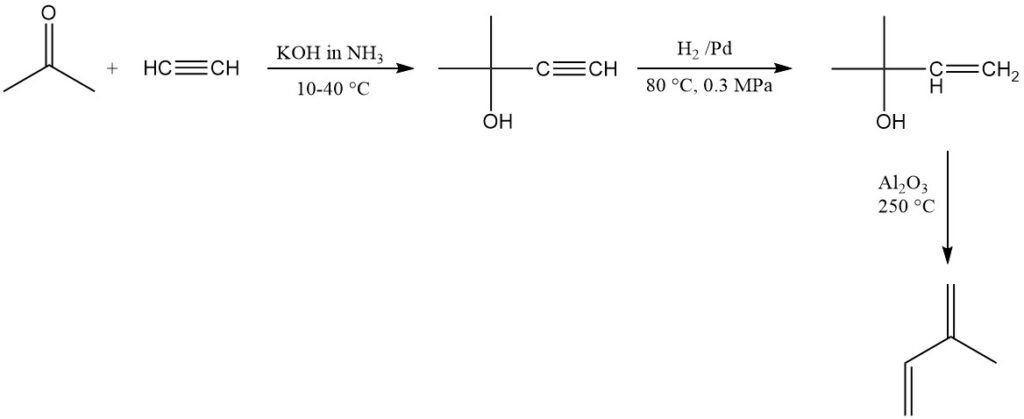
SNAM in Italië produceert commercieel isopreen met behulp van acetyleen en aceton, maar de fabriek is niet langer operationeel. Een soortgelijke fabriek bestaat in Zuid-Afrika. Deze methode produceert isopreen met een hoge zuiverheid, maar is relatief duur.
Het Goodyear-Scientific Design-proces produceerde isopreen door propeendimerisatie tot 2-methyl-1-penteen, gevolgd door isomerisatie tot 2-methyl-2-penteen en vervolgens kraken. De eerste commerciële isopreensynthese gebruikte deze aanpak (Beaumont, Texas), maar de productie stopte in 1975 vanwege stijgende propeenkosten.
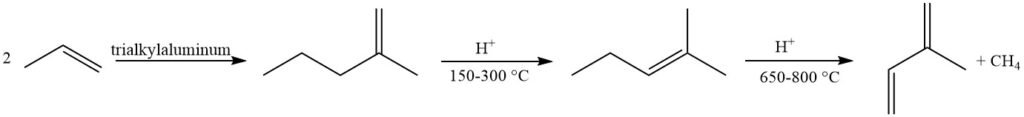
Olefinmetathese biedt een aantrekkelijke aanpak met behulp van gemakkelijk verkrijgbare petrochemicaliën. Een buteenfractie wordt omgezet in 2-methyl-2-buteen en propeen, met daaropvolgende dehydrogenering van 2-methyl-2-buteen tot isopreen. Deze methode lijdt echter aan de vorming van bijproducten als gevolg van reacties tussen verschillende olefinen in de reactor.
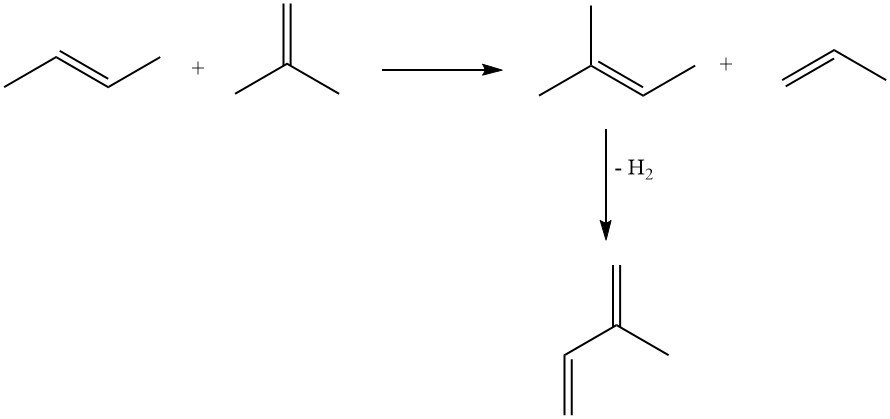
3.2. Productie van isopreen door dehydrogenering van isopentaan of methylbutenen
Isopreen kan worden geproduceerd door dehydrogenering van isopentaan of methylbutenen (isopentenen). Deze reacties zijn vergelijkbaar met de dehydrogenering van n-butaan en n-butenen tot butadieen.
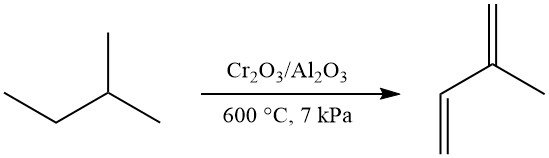
Eenstaps dehydrogenering van isopentaan tot isopreen kan worden bereikt met behulp van het Houdry-Catadieenproces (Cr2O3/Al2O3-katalysator, ~600 °C, ~7 kPa), wat 52% isopreen oplevert. Deze methode werd commercieel gebruikt in de voormalige Sovjet-Unie.
Isopreenproductie-installaties op basis van methylbuteendehydrogenering bestonden in de Verenigde Staten en Nederland, maar zijn momenteel niet operationeel.
Het uitgangsmateriaal wordt doorgaans gewonnen uit cat-cracker-afgassen met behulp van de Sinclair-procedure (extractie van zwavelzuur gevolgd door terugextractie met paraffines).
Dehydrogenering wordt gedaan met een Shell-katalysator (Fe2O3-K2CO3-Cr2O3) bij 600 °C met stoomverdunning en bereikt een opbrengst van 85% isopreen.
Oxidatieve dehydrogenering van zowel isopentaan als methylbutenen is onderzocht. Opbrengsten en selectiviteiten van 60% en 95% voor isopreen zijn gerapporteerd. Silicaatkatalysatoren gedoteerd met aardalkalioxiden of oxiden van nikkel, ijzer of kobalt worden gebruikt voor de oxidatieve dehydrogenering van methylbutenen tot isopreen.
3.3. Terugwinning van isopreen uit C5-kraakfracties
Isopreen kan worden teruggewonnen uit C5-bijproducten van koolwaterstofpyrolyse bij de productie van ethyleen. Naftakraken levert “kraakbenzine” op met weinig isopreen en andere C5-koolwaterstoffen, voornamelijk C6-C8-aromaten.
Destillatie scheidt dit mengsel in C5- en aromatische fracties. De opbrengst aan isopreen bedraagt doorgaans 2-5 gew.% op basis van ethyleen, en neemt toe met zwaardere grondstoffen zoals gasolie. De opbrengst van isopreen neemt af bij een hogere kraakintensiteit (temperatuur/verblijftijd), maar de concentratie in de C5-fractie neemt toe. Het terugwinnen van isopreen uit kraakfracties is energiezuiniger dan chemische synthese.
Zwaardere cracker-grondstoffen voor de productie van etheen leiden tot meer isopreen-bijproducten. Sommige krakers winnen alleen een aromatische fractie terug uit kraakbenzine, terwijl het C5-residu vaak wordt gerecycled met de C4-fractie in de cracker-feed.
Zuivere isopreen-isolatie uit de C5-fractie is niet haalbaar door eenvoudige destillatie vanwege de vergelijkbare kookpunten van de componenten en de vorming van een azeotroop met n-pentaan. Destillatieve verrijking tot 25-50% wordt commercieel gebruikt om transport- en scheidingskosten te verlagen.
Scheidingstechnieken voor het produceren van zuiver isopreen zijn azeotropische destillatie, chemische isolatie en extractieve destillatie met behulp van oplosmiddelen zoals N-methylpyrrolidon, dimethylformamide en acetonitril.
Een eenvoudig isopreenisolatieproces wordt geïllustreerd in Figuur 1.
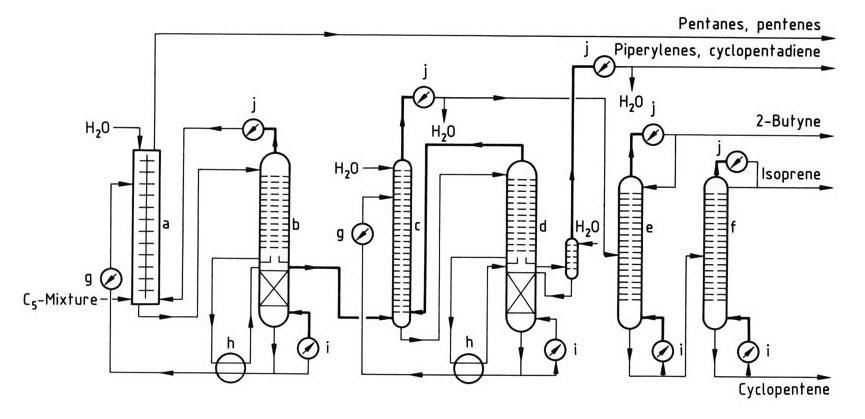
a) Vloeistof-vloeistofextractiekolom; b) – d) Kolommen voor extractieve destillatie; e) Butynkolom; f) Isopreenkolom; g) Koeler; h) Warmtewisselaar; i) Herverdamper; j) Condensor
De eerste stap is een combinatie van vloeistof-vloeistofextractie en extractieve destillatie, met name geschikt voor C5-fracties met een laag isopreengehalte. Preconcentratie van isopreen vindt plaats in de extractor, gevolgd door verwijdering van ruwe isopreen uit de extractieve destillatiekolom.
Vervolgens extractieve destillatie verwijdert piperylenen en cyclopentadieen. De uiteindelijke zuivering voor polymerisatiekwaliteit isopreen wordt bereikt in extra destillatiekolommen. Dit proces maakt de verwerking mogelijk van C5-fracties die cyclopentadieen bevatten, dat wordt verwijderd met piperylenen.
Het proces kan worden aangepast om cyclopentadieen of cyclopenteen te isoleren met extra apparatuur, en zuivere piperylenen kunnen worden gewonnen met een extra kolom.
4. Toepassingen van Isopreen
4.1. Toepassing van Isopreen bij Polymeersynthese
Poly(cis-1,4-isopreen) (isopreenrubber, IR), met name het titaniumgekatalyseerde type, is de primaire toepassing van isopreen. Dit synthetische rubber lijkt qua structuur en eigenschappen sterk op natuurlijk rubber. Isopreenrubber wordt voornamelijk gebruikt bij de productie van autobanden.
Poly(trans-1,4-isopreen) heeft eigenschappen die vergelijkbaar zijn met guttapercha of balata, waardoor de commerciële toepassingen ervan voornamelijk beperkt zijn tot kabelisolatie en golfballen.
De op één na grootste markt voor isopreen is de productie van styreen-isopreen-styreen (SIS) blokcopolymeren, een type thermoplastisch elastomeer. Ongeveer 0,79–0,88 ton isopreen wordt verbruikt per ton SIS-polymeer. Deze copolymeren worden gebruikt als thermoplastische rubbers en drukgevoelige of thermohardende kleefstoffen.
Kleinere hoeveelheden isopreen worden gebruikt bij de productie van butylrubber (isobuteen-isopreenrubber, IIR), een copolymeer met isobuteen. Het isopreengehalte in butylrubber varieert van 0,5 tot 3,0 mol%. IIR staat bekend om zijn lage gasdoorlaatbaarheid, waardoor het geschikt is voor slangen en voeringen in tubeless banden.
Tot slot kunnen koolwaterstofharsen (petroleumharsen) worden geproduceerd door isopreen te copolymeriseren uit cyclopentadieenvrije C5-kraakfracties met andere onverzadigde C5-verbindingen.
4.2. Gebruik van isopreen bij terpeensynthese
Hoewel isopreen verschillende chemische reacties ondergaat, is alleen terpeensynthese van industrieel belang en wordt er actief onderzoek naar gedaan.
In 1972 begon Rhodia met de ontwikkeling van een proces voor C10-terpeen en derivaatsynthese uit isopreen, aceton en acetyleen. Isopreen reageert met zoutzuur om prenylchloride te vormen, dat vervolgens in twee stappen wordt omgezet in dehydrolinalool.
Rhodia gebruikte dehydrolinalool voor verschillende syntheses, maar stopte met de productie. Kuraray in Japan blijft deze verbindingen, squalaan en andere echter produceren uit isopreen.
Rhodia gebruikte eerder een Grignard-synthese om de C10-terpeenalcohol lavandulol te produceren uit twee isopreenmoleculen.
Isopreen reageert via oligomerisatie of telomerisatie om terpenen te vormen. Voorbeelden zijn de wetenschappelijk en industrieel relevante lineaire oligomerisatie van isopreen tot myrceen en de telomerisatie met N,N-diethylnerylamine (beide C10-terpenen).
Natuurlijk voorkomende terpenen bestaan uit “kop-staart” gerangschikte isopreen-eenheden met specifieke dubbele bindingsposities. Het produceren van terpenen uit isopreen vereist het repliceren van deze structuur, waardoor C10-terpeensynthese uit isopreen over het algemeen minder gunstig is dan alternatieve routes. De samenstelling van de katalysator kan de structuur van dimethyloctadienen die uit isopreen worden gesynthetiseerd, beïnvloeden.
Takabe et al. rapporteerden myrceensynthese door oligomerisatie van isopreen met behulp van een natrium/dialkylamine-katalysator. Nissan Chemical Industries ontwikkelde en kondigde de industriële productie van myrceen aan met behulp van deze methode.
Isopreentelomerisatie vindt plaats met verschillende verbindingen, waaronder ammoniak of aminen. De regioselectiviteit kan worden gemanipuleerd door de hoeveelheid en concentratie van Brønsted- en Lewis-zuren in de katalysator te variëren.
Isopreen reageert met di-ethylamine om N,N-di-ethylnerylamine te vormen via een door butyllithium gekatalyseerde telomerisatiereactie. Verdere reacties van N,N-di-ethylnerylamine leveren linalool, geraniol, nerol, hydroxycitronellal, citronellal en menthol op (Figuur 2).
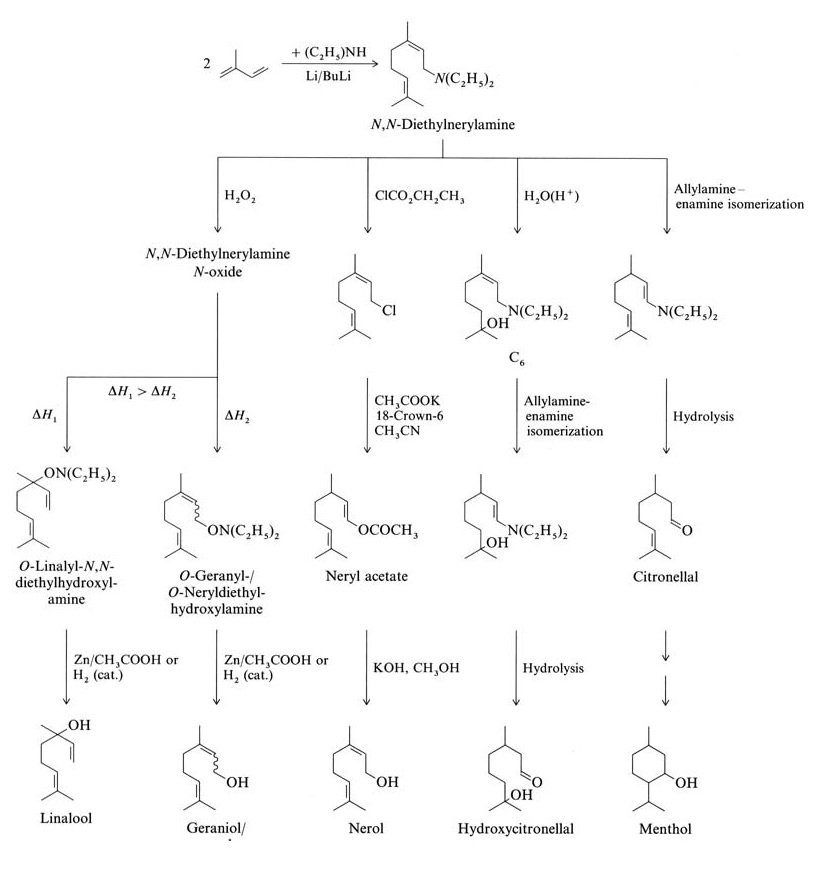
De Takasago Perfumery Company in Japan gebruikt een industriële synthese voor enantiomeer zuivere L-menthol uit optisch actieve citronellal. Dit proces omvat de asymmetrische allylamine-enamine-isomerisatie van N,N-diethylgeranylamine of N,N-diethylnerylamine met een Rh-BINAP-katalysator.
5. Toxicologie van isopreen
Acute toxiciteit
Blootstelling aan isopreen op hoog niveau veroorzaakt verdovende effecten bij dieren, wat leidt tot verlamming en de dood. Enkele inhalatieblootstellingen van 2 uur bij muizen (56.000 mg/m³) vertoonden geen nadelige effecten. Niveaus van 98.000–126.000 mg/m³ veroorzaakten diepe narcose, en blootstelling aan 140.000 mg/m³ gedurende 2 uur veroorzaakte mortaliteit (LC50 = 180.000 mg/m³ voor ratten).
De drempelconcentratie voor irritatie bij katten wordt gerapporteerd als 800 mg/m³. Orale en intraperitoneale LD50-waarden bij mannelijke ratten werden bepaald op respectievelijk 2100 mg/kg en 1400 mg/kg voor vloeibare isopreen. Enkelvoudige blootstelling van de huid (1 ml/kg) bij ratten veroorzaakte geen sterfte of nadelige symptomen.
Herhaalde blootstellingstoxiciteit
Ratten en muizen werden twee weken lang blootgesteld aan 0, 438, 875, 1750, 3500 en 7000 ppm isopreen via inhalatie. Ratten vertoonden geen blootstellingsgerelateerde veranderingen.
Muizen die werden blootgesteld aan 7000 ppm vertoonden een lagere toename van het lichaamsgewicht, terwijl alle groepen bloedarmoede, testiculaire atrofie, degeneratie van het reukepitheel en hyperplastische veranderingen van het epitheel in de maag vertoonden. Net als 1,3-butadieen lijken muizen gevoeliger te zijn dan ratten.
Herhaalde blootstelling via de huid (500 mg x 2 toepassingen/dag gedurende 5 dagen) op konijnenoren veroorzaakte slechts milde, omkeerbare irritatie. Gegevens over blootstelling via inademing op lange termijn zijn niet beschikbaar.
Mutageniciteit
Isopreen en zijn mono-epoxiden zijn niet mutageen in de Ames-test. Isopreendioxide (2-methyl-1,2,3,4-diepoxybutaan) vertoonde echter mutageniteit in dit testsysteem.
Vanwege mogelijke overeenkomsten met 1,3-butadieen bij het genereren van mutagene metabolieten, is verdere evaluatie van de carcinogeniteit van isopreen gerechtvaardigd.
Inhalatieblootstelling van muizen aan 438–7000 ppm isopreen gedurende 6 uur/dag gedurende 12 dagen resulteerde in verhoogde zusterchromatide-uitwisselingsfrequenties, wat duidt op cytogenetische effecten.
Gegevens over reproductieve of teratogene effecten zijn niet beschikbaar.
Metabolisme
Mitochtonenfracties van knaagdieren zetten isopreen om in zijn mono-epoxiden (3,4-epoxy-3-methyl-1-buteen en 3,4-epoxy-2-methyl-1-buteen), wat leidt tot overeenkomstige diolen. Er is melding gemaakt van een kleine oxidatie van de stabielere metaboliet (3,4-epoxy-2-methyl-1-buteen) tot een diepoxide.
Isopreen ondergaat een significant metabolisme in de luchtwegen. Blootstelling aan atmosferische isopreen tot 300 ppm vertoont een directe evenredigheid tussen blootstellingsconcentratie en metabolisme. Verzadigingseffecten treden op boven 300–500 ppm. Muizen metaboliseren isopreen sneller dan ratten.
Endogene isopreensynthese is waargenomen. De synthesesnelheden bij niet-blootgestelde muizen en ratten worden geschat op respectievelijk 0,4 mmol h⁻¹ kg⁻¹ en 1,9 mmol h⁻¹ kg⁻¹.
Menselijke effecten
Bij zeer hoge blootstellingsniveaus werkt isopreen als een verdovend middel bij mensen. Het kan ook de huid, ogen, slijmvliezen en luchtwegen irriteren.
Hygiënische normen
Er is geen drempelwaarde (TLV) of maximaal toegestane concentratie (MAK) vastgesteld voor isopreen. De voormalige Sovjet-Unie stelde een drempelwaarde van 40 mg/m³ in.
Referenties
- Isoprene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_627
- https://www.nature.com/articles/s42004-019-0120-9
- https://bmcchem.biomedcentral.com/articles/10.1186/s13065-023-01016-y
- https://www.sciencedirect.com/science/article/abs/pii/S0045653519319812
