Chlooraminen: Eigenschappen, Reacties en Voorbeelden

Chlooramines zijn stikstofhoudende verbindingen, anorganisch of organisch, waarbij een of meer chlooratomen direct aan een stikstofatoom zijn gebonden. Monochlooramine (NH2Cl), ontdekt in het begin van de 19e eeuw, is een bekend voorbeeld.
Chlooramines zijn chlorerende en oxiderende stoffen die worden gebruikt in synthetische reacties en als bleekmiddelen, ontsmettingsmiddelen en bactericiden. Vergeleken met chloorgas of metaalhypochlorieten bieden ze een veiligere verwerking en een grotere stabiliteit.
Daarom worden ze gebruikt bij de zuivering van drinkwater en de reiniging van zwembaden. N-chloorisocyanuurzuren en 1-broom-3-chloor-5,5-dimethylhydantoïne worden belangrijker op de markt voor ontsmetting en desinfectie dan calciumhypochloriet, 1,3-dichloor-5,5-dimethylhydantoïne en chlooramine-T.
Inhoudsopgave
1. Chemische eigenschappen van N-chlooramines
N-chlooramines bezitten oxiderende eigenschappen, waarbij ze twee elektronen accepteren om om te zetten in chloride-ionen. Deze eigenschap stelt ze in staat om waterstofjodide te oxideren, waarbij jodium vrijkomt, in een reactie die wordt gebruikt voor kwantitatieve analyse:
2 HI + RR’NCl → HCl + RR’NH + I2
Het theoretische chloorgehalte in een N-chlooramine wordt berekend als tweemaal de chloormassafractie. In praktische toepassingen wordt het echter uitgedrukt als het equivalent van elementair chloor op basis van het werkelijke oxiderende vermogen.
N-chlooramines ondergaan hydrolyse in water, waarbij hypochloorzuur (HOCl) vrijkomt. De kwantitatieve hydrolyseconstante (K-waarde), variërend tussen 10-4 en 10-10 (Tabel 1), weerspiegelt deze reactie:
RR’NCl + H2O ⇌ RR’NH + HOCl
K = [RR’NH][HOCl] / [RR’NCl]
| N-chlooramine | K-waarde |
|---|---|
| Trichloorisocyanuurzuur | 6,7 × 10-4 |
| 1,3-Dichloor-5,5-dimethylhydantoïne | 2,5 × 10-4 |
| N-chloorsuccinimide | 6,6 × 10-5 |
| Dichlooramine-T | 8,0 × 10-7 |
| Chlooramine-T | 4,9 × 10-8 |
| Monochlooramine | 2,8 × 10-10 |
Deze K-waarde heeft betrekking op de bacteriedodende kracht van N-chlooramines, omdat hun effectiviteit afhankelijk is van het genereren van hypochloorzuur in water.
N-Cl-bindingen in N-chlooramines zijn covalent en hydrolyseren gemakkelijk, waarbij hypochloorzuur vrijkomt. Ze vertonen thermische instabiliteit, smelten vaak niet congruent en exploderen mogelijk bij hoge temperaturen. Trichlooramine (NCl3) is een bijzonder onstabiele verbinding en kan zelfs als onzuiverheid explosies veroorzaken.
De juiste opslag van N-chlooramines vereist koele temperaturen en bescherming tegen licht, water, aminen en ammoniumverbindingen, sterke zuren en basen en gemakkelijk oxiderend organisch materiaal.
2. Reacties van chlooramines
Veel N-chlooramines spelen een waardevolle rol als reagentia of tussenproducten in diverse organische reacties.
Hofmann-afbraak: N-chlooramides afgeleid van organische carbonzuren ondergaan reductie met alkali om overeenkomstige aminen met hoge efficiëntie te verkrijgen. Deze reactie, bekend als Hofmann-afbraak, wordt gebruikt voor de synthese van aromatische aminen, heterocyclische aminen en alicyclische aminen.
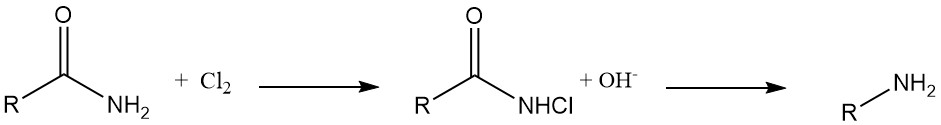
Hydrazinesynthese: N-chloorureumverbindingen transformeren in hydrazines bij behandeling met een base in alcohol- of wateroplossingen.
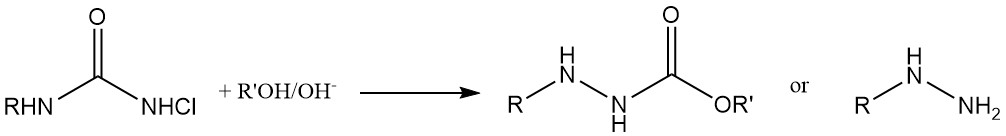
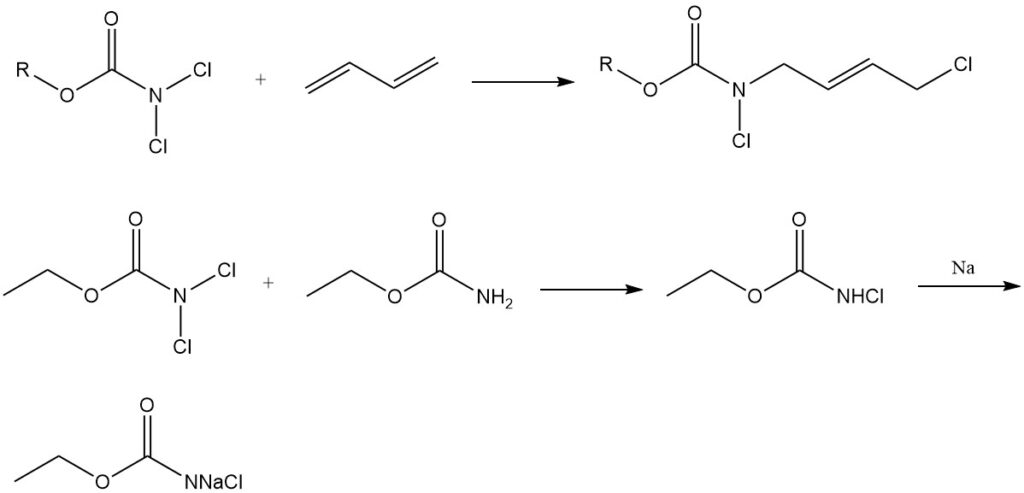
N,N-Dichlorocarbamaten (Cl2NCOOR) worden gebruikt als chloreringsmiddelen en nemen ook deel aan additiereacties met diënen. Ze fungeren verder als uitgangsmaterialen voor de synthese van N-halo-N-metallocarbamidaten, belangrijke tussenproducten bij de productie van carbamaatderivaten van fysiologisch actieve verbindingen.
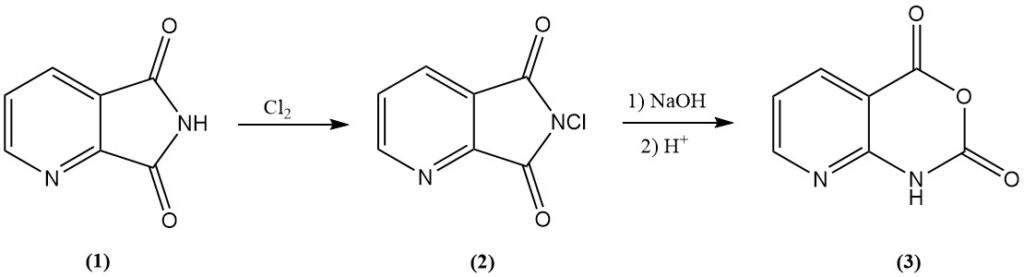
8-Azaisatoic Anhydride (3), een tussenproduct in diverse landbouwchemicaliën, wordt efficiënt verkregen door 2,3-pyridinedicarboximide (1) te chloreren tot N-chloor-2,3-pyridinedicarboximide (2), gevolgd door alkalische behandeling.
N-chlooramidinen en N-chloorguanidinen worden gebruikt als grondstoffen voor de productie van heterocyclische ringsystemen zoals imidazolen, thiazolen en oxadiazolen.
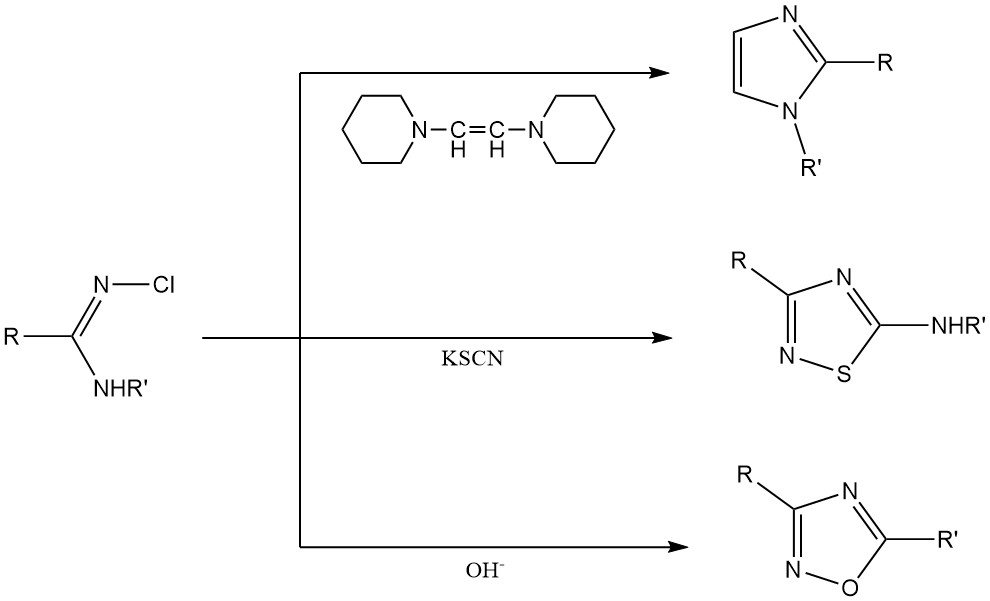
3. Anorganische N-chlooramines
Monochlooramine (NH2Cl) is een kleurloze, sterk ruikende vloeistof die stabieler is in waterige oplossingen dan andere N-chlooramines zoals dichlooramine (NHCl2) en trichlooramine (NCl3). De primaire toepassing is de desinfectie van drinkwater. Het wordt ook gebruikt als oxidatiemiddel bij organische synthese, met name voor trigesubstitueerde fosfines.
N-chlooramines worden gesynthetiseerd door gecontroleerde pH-reacties tussen ammoniumzouten en hypochloorzuur, of chloor.
Extreme voorzichtigheid is belangrijk bij het hanteren van pure N-chlooramines vanwege hun inherente instabiliteit en explosiviteit, zelfs bij kamertemperatuur.
N-chloorsulfaminezuur (ClSO2NH2), (N,N-dichloorsulfaminezuur en natrium-N-chloorimidodisulfonaat (ClSO2NNaSO2) worden gebruikt als ontsmettingsmiddelen en bleekmiddelen voor papier of stoffen. Ze worden geproduceerd uit sulfaminezuur en hypochloorzuur.
4. N-chloorisocyanuurzuren
N-chloorisocyanuurzuren (chloorisocyanuraten), zoals trichloorisocyanuurzuur (Symclosene of TCC) en natrium dichloroisocyanurate (DCC-Na) zien een opmerkelijke stijging in hun gebruik als ontsmettingsmiddelen. Deze toenemende populariteit is te danken aan hun superieure stabiliteit en gebruiksvriendelijkheid vergeleken met traditionele metaalhypochlorieten.
Tabel 2 somt enkele belangrijke fysieke eigenschappen van TCC en DCC-Na op.
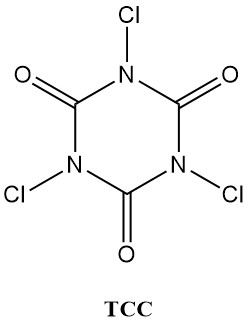
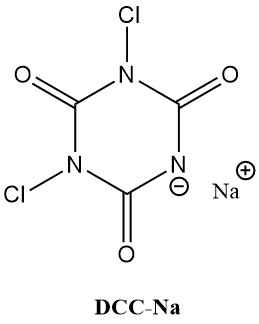
| Eigenschap | TCC | DCC-Na |
|---|---|---|
| CAS-nummer | [87-90-1] | [2893-78-9] |
| Fysische vorm | Wit poeder | Wit poeder |
| Formule | (ClNCO)3 | Cl2Na(NCO)3 |
| Moleculaire massa | 232,44 | 219,98 |
| smeltpunt | 234 °C (ontleding) | 225 °C (ontleding) |
| Beschikbaar chloor Theoretisch (%) | 91,5 | 64,5 |
| Beschikbaar chloor Typische waarde | 90,0 | 62,0 |
| pH (1% waterige oplossing) | 2,7 – 3,3 | 6,2 – 6,8 |
| Oplosbaarheid in water (25 °C) (g/100 g) | 1,0 | 30,0 |
| Oplosbaarheid in aceton (30 °C) | 35,0 | 0,5 |
TCC en DCC-Na hebben een aanzienlijk marktaandeel veroverd dat historisch gezien werd gedomineerd door calciumhypochloriet, pijnboomoliën, quaternaire ammoniumzouten en fenolen.
N-chloorisocyanuurzuren worden geproduceerd door een continue chloreringsreactie van isocyanuurzuur in waterig natriumhydroxide bij lage temperaturen (0–15 °C). Nauwkeurige controle over zowel de pH als de reactietemperatuur is belangrijk om de vorming van het zeer explosieve trichlooramine (NCl3) te voorkomen.
Trichloorisocyanuurzuur (TCC) ontleedt geleidelijk in een alkalisch medium en genereert bijproducten zoals trichlooramine (NCl3), dichlooramine (NHCl2) en monochlooramine (NH2Cl).
Zowel natriumdichloorisocyanuraat (DCC-Na) als het dihydraat ervan hebben een hogere wateroplosbaarheid vergeleken met TCC. DCC-Na-dihydraat wordt verkregen door een verzadigde waterige oplossing van DCC-Na (45 °C) af te koelen tot 10 °C; deze vorm biedt een verbeterde thermische stabiliteit vergeleken met de watervrije vorm.
De desinfecterende en reinigende kracht van N-chloorisocyanuurzuren is te danken aan hun geleidelijke afgifte van hypochloorzuur (HOCl) in water, dat zowel oxiderende als biocide eigenschappen vertoont.
Deze verbindingen worden voor veel doeleinden gebruikt, waaronder:
- Niet-krimpende behandeling van wol: Ze beschermen wolvezels tegen krimp tijdens de verwerking.
- Zwembaddesinfectie: N-chloorisocyanuurzuren elimineren effectief schadelijke micro-organismen in zwembaden, waardoor de waterhygiëne behouden blijft.
- Schoonmaken en ontsmetten van badkamers.
- Bleekmiddel voor wasgoed: ze worden gebruikt als effectief bleekmiddel voor wasgoed om vlekken te verwijderen en de witheid.
Op N-chloorisocyanuurzuur gebaseerde reinigingsmiddelen en ontsmettingsmiddelen bevatten vaak extra componenten zoals fosfaten, natriummetasilicaten, oppervlakteactieve stoffen en neutrale zouten (natriumsulfaat, natriumcarbonaat).
Deze combinatie verbetert hun olie- en eiwitverwijderingscapaciteiten, waardoor ze ideaal zijn voor verschillende schoonmaaktaken. Ze worden aanbevolen voor het afwassen in hotels, ziekenhuizen, restaurants en voedselverwerkende faciliteiten vanwege hun werkzaamheid tegen verschillende micro-organismen.
5. Organische N-chlooramines
Verschillende organische N-chlooramineverbindingen en hun toepassingen worden hieronder vermeld:
1,3-Dichloor-5,5-dimethylhydantoïne (Dactine) (4)
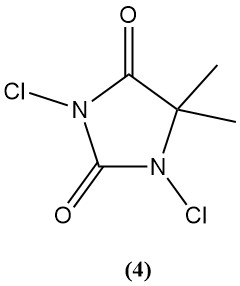
- Moleculair gewicht: 197,03 g/mol
- Smeltpunt: 132 °C
- Theoretisch chloorgehalte: 77,6%
- Oplosbaarheid in water: 2,1 g/L
- Het wordt bereid door chlorering van waterige 5,5-dimethylhydantoïne.
- Het werd historisch gebruikt als bactericide en ontsmettingsmiddel, maar het gebruik ervan nam af vanwege concurrentie van TCC en Di-Halo.
1-Broom-3-chloor-5,5-dimethylhydantoïne (Di-Halo) (5)
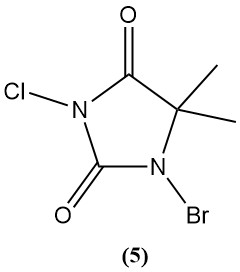
- Moleculair gewicht: 241,48 g/mol
- Smeltpunt: 130°C (ontleding)
- pH: 2,88 (0,1% oplossing)
- Oplosbaarheid in water (20 °C): 2 g/L
- Het wordt bereid door opeenvolgende bromering en chlorering van 5,5-dimethylhydantoïne.
- Het is een stabiel wit poeder zonder chloroaminevorming in zwak basische oplossingen.
- Het wordt veel gebruikt als zwembaddesinfectiemiddel (0,5–3 mg/L actieve halogeen) vanwege de stabiliteit, breedspectrumactiviteit en lange houdbaarheid.
1-Chloor-2,5-pyrrolidinedione (N-chlorosuccinimide) (6)
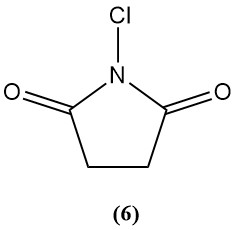
- Moleculair gewicht: 133,54 g/mol
- Smeltpunt: 150–151 °C
- Het is matig oplosbaar in verschillende organische oplosmiddelen.
- Beschikbaar chloor: 50–54%
- Het wordt voornamelijk gebruikt als een chloormiddel voor organische synthese.
N-chloorglycolurilen
- Ze worden bestudeerd als beschermende middelen tegen gifgas.
- Ze worden bereid door 1,2-diketoncondensatie met ureum, gevolgd door chlorering.
- 2,4,6,8-tetrachloor-2,4,6,8-tetrazabi-cyclo[3.3.0]octaan-3,7-dion (7) is een belangrijk voorbeeld van deze klasse.
![2,4,6,8-tetrachloro-2,4,6,8-tetrazabi-cyclo[3.3.0]octane-3,7-dione structure](https://chemcess.com/wp-content/uploads/2024/02/2468-tetrachloro-2468-tetrazabi-cyclo3.3.0octane-37-dione-structure.jpg)
1,3,4,6-Tetrachloor-3α,6α-difenylglycoluril (jodogeen) (8)
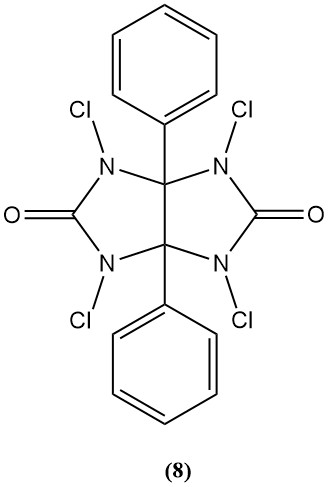
- Moleculair gewicht: 431,94 g/mol
- Het wordt gebruikt als bactericide en oxidatiemiddel bij peptidesynthese.
3-Chloor-4,4-dimethyl-2-oxazolidinon (9)
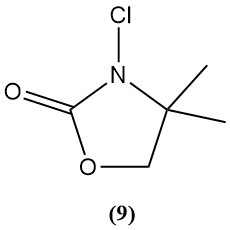
- Moleculair gewicht: 149,50 g/mol
- Het is een voorbeeld van een nieuwe klasse N-chlooramines die wordt onderzocht als ontsmettingsmiddelen.
Natrium-N-chloor-p-tolueensulfonamide (chlooramine-T) (10)
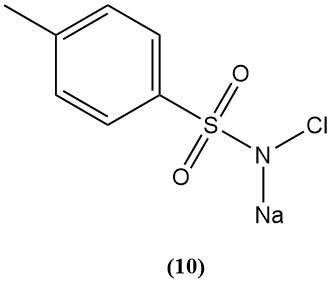
- Moleculair gewicht: 227,67 g/mol (hydraat)
- Smeltpunt: 175 °C; explosief
- Beschikbaar chloor: 25%
- Het wordt bereid door p-tolueensulfonamide te chloreren in natriumhydroxide.
- Het is een sterke elektrolyt in zuur, een goed oxidatiemiddel in base en redelijk oplosbaar in water en onoplosbaar in benzeen.
- Het reageert met mosterdgas om onschadelijke sulfimidekristallen te vormen.
- Hun derivaten worden bestudeerd voor bescherming tegen gifgas.
N,N’,N”-Trichloromelamine (11)
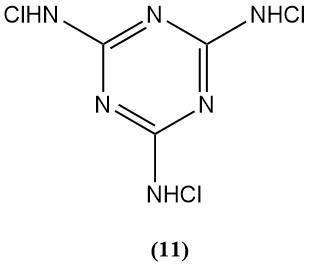
- Moleculair gewicht: 229,46 g/mol
- Smeltpunt: 175 °C (ontleding),
- Theoretisch chloorgehalte: 92,8%
- Het wordt gebruikt als sterilisatiemiddel, beperkt door de lage oplosbaarheid in water.
N-gechloreerde aminozuurderivaten worden onderzocht op hun potentieel als bleekmiddelen en bacteriedodende middelen.
6. Toxicologie van N-chlooramines
N-chlooramines worden veel gebruikt in drinkwater, zwembaden en voedselverwerking, wat zorgvuldige overweging van hun potentiële toxicologische effecten vereist.
Bij gebruik in organisch rijk water is bijzondere waakzaamheid vereist om de vorming van zwak carcinogene halomethanen te voorkomen. Hun aanwezigheid wordt vaak gekwantificeerd via headspace-, purge trap- of oplosmiddelextractiemethoden, gevolgd door GC-analyse met elektronenvangstdetectoren of GC-MS.
De meeste N-chlooramines vertonen lokale irriterende effecten op de ogen, vochtige huid en de bovenste luchtwegen. Verdunde oplossingen (tot 100 ppm beschikbaar chloor) van N-chloorisocyanuurzuren leveren doorgaans geen toxiciteit, irritatie of sensibilisatieproblemen op.
Het innemen van zuivere vaste stoffen of geconcentreerde suspensies kan echter de maagwand beschadigen. Bovendien heeft isocyanuurzuur, gevormd bij hydrolyse, een lage inherente toxiciteit. Een samenvatting van acute toxiciteitswaarden voor geselecteerde N-chlooramines is te vinden in Tabel 3.
| Verbinding | LD50 (mg/kg, rat, oraal) |
|---|---|
| TCC | 1300 |
| DCC-Na | 1420 |
| 1,3-Dichloor-5,5-dimethylhydantoïne | 542 |
| N-chloorsuccinimide | 2700 |
- Chlooramine-T: Hoewel het een huidirriterend middel is, vertoont deze verbinding aanzienlijke toxiciteit bij opname in de bloedbaan, waardoor het alleen in verdunde oplossingen gebruikt mag worden.
- Monochlooramine: Hoewel het een lager risico op halomethaanvorming oplevert, roept het wijdverbreide gebruik ervan bij desinfectie van drinkwater zorgen op vanwege mogelijke mutagene en aquatische toxiciteit. De Amerikaanse Environmental Protection Agency heeft zelfs een verbod op het gebruik ervan in drinkwater voorgesteld.
Studies suggereren dat 1-broom-3-chloor-5,5-dimethylhydantoïne een lagere toxiciteit vertoont voor specifieke vissoorten vergeleken met 1,3-dichloor-5,5-dimethylhydantoïne.
Referentie
- Chloroamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_553
