Dichlooraceetaldehyde: eigenschappen, productie en toepassingen

Dichlooraceetaldehyde [79-02-7], of 2,2-dichloorethanal, is een gechloreerde aceetaldehyde met de chemische formule Cl2CHCHO. Het is een kleurloze vloeistof met een scherpe, irriterende geur die voor het eerst in 1868 werd geproduceerd door F. Paterno door destillatie van dichloordiethylacetaal, CHCl2CH(OC2H5)2, met zwavelzuur.
Inhoudsopgave
1. Fysieke eigenschappen van dichlooraceetaldehyde
Dichlooraceetaldehyde, ook bekend als 2,2-dichloorethanal, is een kleurloze vloeistof met een karakteristieke scherpe geur. Het heeft verschillende belangrijke fysieke eigenschappen:
- Moleculair gewicht: 112,94 g/mol
- Smeltpunt: -37,6 tot -37,4 °C
- Kookpunt: 89,2 °C
- Dichtheid (25 °C): 1,4113 g/cm³
- Dipoolmoment (30 °C): 2,36 D
- Oplosbaarheid: mengbaar in water, vormt een hydraat en is gemakkelijk oplosbaar in gangbare organische oplosmiddelen.
Dichlooraceetaldehyde reageert gemakkelijk met water om een monohydraat (CAS: 16086-14-9) te vormen, bekend als 2,2-dichloor-1,1-ethaandiol. Deze kristallijne vaste stof vertoont verschillende eigenschappen:
- Moleculair gewicht: 130,96 g/mol
- Smeltpunt: 35–50 °C
- Kookpunt: 85–95 °C bij 101,3 kPa
- Dichtheid (20 °C): 1,53–1,54 g/cm³
- Dampspanning: 6,5 kPa bij 20 °C, 25 kPa bij 50 °C
- Oplosbaarheid: oplosbaar in polaire organische oplosmiddelen, onoplosbaar in niet-polaire.
- Vlampunt: Ongeveer 95 °C
- Ontstekingstemperatuur: Ongeveer 605 °C
2. Chemische reacties van dichlooraceetaldehyde
Dichlooraceetaldehyde ondergaat spontane polymerisatie bij opslag, waarbij een vast, kleurloos polymeer ontstaat. Dit polymeer wordt bij verhitting tot 120 °C weer omgezet in zijn monomere vorm.
Dichlooraceetaldehyde vertoont de karakteristieke reacties van aldehyden, zoals oxidatie, reductie en condensatie.
De oxidatiereactie met chroomzuur produceert dichloorazijnzuur.
Reductie van dichlooraceetaldehyde met ethylaluminium levert 2,2-dichloorethanol op.

De zelfcondensatie leidt tot de vorming van 2,2,4,4-tetrachlooracetaldol.
De condensatiereactie van dichlooraceetaldehyde met ethylbenzeen geeft p,p’-diethyl-1,1-difenyl-2,2-dichloorethaan, een insecticide dat bekend staat als Perthane.

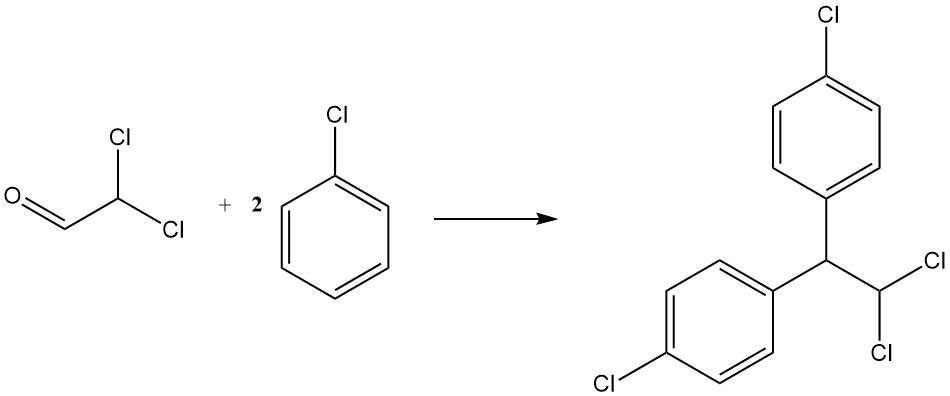
Condensatie met chloorbenzeen levert p,p’-dichloor-1,1-difenyl-2,2-dichloorethaan op, een ander insecticide dat bekend staat als TDE of DDD. Het wordt weergegeven door de volgende vergelijking:
CHCl2CHO + 2 C6H5Cl → CHCl2CH(C6H4Cl)2 + H2O
3. Productie van dichlooraceetaldehyde
Het belangrijkste industriële productieproces voor dichlooraceetaldehyde is de chlorering van aceetaldehyde of paraldehyde. Een andere methode voor de productie van zuivere dichlooraceetaldehyde is de hypochlorering van 1,2-dichloorethyleen.
3.1. Chlorering van aceetaldehyde of paraldehyde
Deze methode genereert dichlooraceetaldehyde samen met chlooraceetaldehyde en trichlooraceetaldehyde. Hoge opbrengsten zijn haalbaar met katalysatoren zoals antimoontrichloride (83%) of fosforzuur (>90%). Oxychlorering tijdens het Wacker-proces voor aceetaldehydeproductie kan ook dichlooraceetaldehyde als bijproduct opleveren.
3.2. Hypochlorering van 1,2-dichloorethyleen
Dit proces levert zuivere dichlooraceetaldehyde op, vrij van onzuiverheden zoals chloraal en monochlooraceetaldehyde. Het omvat het behandelen van 1,2-dichloorethyleen met één mol chloor onder specifieke temperatuur- en oplosmiddelomstandigheden.
3.3. Chlorering van Ethanol
Gecontroleerde chlorering van ethanol in aanwezigheid van nikkel(II)chloride kan voornamelijk dichlooraceetaldehyde opleveren, samen met wat chloraal en monochlooraceetaldehyde. Het resulterende hemiacetal kan direct worden gebruikt zonder zuivere dichlooraceetaldehyde of zijn hydraat te isoleren.

4. Toepassingen van dichlooraceetaldehyde
Dichlooraceetaldehyde en de acetalen ervan worden in de farmaceutische industrie gebruikt voor de productie van trichloormethiazide, een diureticum dat wordt gebruikt voor de behandeling van aandoeningen zoals hoge bloeddruk en oedeem, en mitotaan (1,1-dichloor-2-(o-chloorfenyl)-2-(p-chloorfenyl)ethaan), een cytostatisch middel dat wordt gebruikt bij de behandeling van specifieke bijnierkankers.
Het wordt ook gebruikt bij de productie van insecticiden zoals perthane en TDE of DDD.
5. Toxicologie van dichlooraceetaldehyde
Dichlooraceetaldehyde veroorzaakt mogelijke irritatie van de luchtwegen, hoewel formele toxiciteitstestgegevens ontbreken. Als voorzorgsmaatregel moet er voorzichtig mee worden omgegaan.
6. Dichlooraceetaldehyde polymeren
6.1. Hexachloroparaldehyde
- Formule: C6H6Cl6O3
- Molaire massa: 338,83 g/mol
- Uiterlijk: Kleurloze kristallen
- Smeltpunt: 131-132 °C
- Kookpunt: 210–220 °C (ontleding)
Hexachloroparaldehyde wordt geproduceerd door de reactie van dichlooraceetaldehyde met Lewis-zuren zoals antimoontrichloride, ijzer(III)chloride of boortrifluoride of door directe chlorering van paraldehyde met 6–7 mol chloor bij 35 °C onder watervrije omstandigheden.
Het vormt dichlooraceetaldehydehydraat in aanwezigheid van waterige zuren en ontleedt bij verhoogde temperaturen tot dichlooraceetaldehyde.
6.2. Polydichlooraceetaldehyden
- Formule: (C2H2Cl2O)n
- Oplosbaarheid: variabel afhankelijk van polymerisatiegraad, over het algemeen oplosbaar in gangbare organische oplosmiddelen.
De kristallijne vormen van polydichlooraceetaldehyden worden geproduceerd door dichlooraceetaldehyde bij -78 °C te behandelen met organometaalverbindingen zoals triethylaluminium, en de amorfe vormen worden bereid met behulp van Lewis-zuren bij temperaturen onder 0 °C.
Deze polymeren zijn oplosbaar in geconcentreerd zwavelzuur bij 100 °C met verkleuring en in dimethylformamide. Ze kunnen copolymeren vormen met andere aldehyden.
Referentie
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
