Butadieen: eigenschappen, reacties, productie en toepassingen
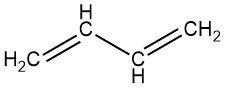
1,3-Butadieen is een kleurloos gas met een benzine-achtige geur. Het is het eenvoudigste lid van de reeks geconjugeerde diënen, die de structuur C=C-C=C bevatten, waarbij C koolstof is.
Butadieen verwijst doorgaans naar 1,3-butadieen [106-99-0], een zeer significante onverzadigde C4-koolwaterstof. Zijn thermodynamisch minder stabiele tegenhanger, 1,2-butadieen [590-19-2], heeft een verwaarloosbare industriële relevantie.
1,3-Butadieen: CH2=CH–CH=CH2
1,2-Butadieen: CH2=C=CH–CH3
Butadieen staat hoog aangeschreven als een cruciale petrochemische stof, met een wereldwijde productie van meer dan 10 miljoen ton per jaar.
Inhoudsopgave
1. Fysieke eigenschappen van butadieen
Butadieen is een kleurloos gas onder normale omstandigheden. Enkele fysieke eigenschappen worden samengevat in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| Chemische formule | C4H6 |
| Molaire massa | 54,09 g/mol |
| Kookpunt | -4,4 °C |
| Smeltpunt | -108,9 °C |
| Kritische temperatuur | 425 K |
| Kritische druk | 4,32 MPa |
| Kritisch molair volume | 221 cm³/mol |
| Dichtheid (vloeistof, 0 °C) | 0,646 g/cm³ |
| Dichtheid (vloeistof, 25 °C) | 0,616 g/cm³ |
| Dichtheid (vloeistof, 50 °C) | 0,582 g/cm³ |
| Gasdichtheid (relatief ten opzichte van lucht) | 1,87 |
| Dampspanning (-4,4°C) | 101,3 kPa |
| Dampspanning (0 °C) | 120,0 kPa |
| Dampspanning (25 °C) | 273,6 kPa |
| Dampspanning (50 °C) | 537,9 kPa |
| Dampspanning (75 °C) | 986,7 kPa |
| Dampspanning (100 °C) | 1733 kPa |
| Viscositeit (vloeistof, 0 °C) | 0,25 mPa·s |
| Viscositeit (vloeistof, 50 °C) | 0,20 mPa·s |
| Enthalpie van verdamping (25 °C) | 20,86 kJ/mol |
| Enthalpie van verdamping (-4,4 °C) | 22,47 kJ/mol |
| Enthalpie van vorming (gasvormig, 298 K, 101,3 kPa) | 110,0 kJ/mol |
| Vrije enthalpie van vorming (gasvormig, 298 K, 101,3 kPa) | 151,5 kJ/mol |
| Enthalpie van verbranding (gasvormig, 298 K, 101,3 kPa) | 2541,5 kJ/mol |
| Enthalpie van hydrogenering tot butaan (gasvormig, 298 K, 101,3 kPa) | 235,7 kJ/mol |
| Entropie van vorming (vloeistof, 298 K, 101,3 kPa) | 199,0 J·mol⁻¹·K⁻¹ |
| Enthalpie van smelten (164,2 K, 101,3 kPa) | 7,988 kJ/mol |
Butadieen heeft een beperkte oplosbaarheid in water. Het is oplosbaar in methanol en ethanol, en zeer oplosbaar in hoogkokende polaire oplosmiddelen zoals methylpyrrolidon.
Er zijn verschillende technische eigenschappen belangrijk voor het veilig hanteren van butadieen. Deze omvatten:
- Vlampunt: -85 °C
- Ontstekingstemperatuur: 415 °C
Niet-gestabiliseerd of onvoldoende gestabiliseerd butadieen kan reageren met atmosferische zuurstof om explosieve peroxiden te vormen.
2. Chemische reacties van butadieen
Butadieen, dat twee geconjugeerde dubbele bindingen bezit, neemt deel aan diverse reacties, waaronder 1,2- en 1,4-addities met zichzelf (polymerisatie) en andere reagentia, lineaire dimerisatie, trimerisatie en ringvorming.
Polymerisatie
De belangrijkste reactie voor butadieen betreft polymerisatie door middel van 1,2- en 1,4-additie, wat leidt tot een verscheidenheid aan polymeren. De aard van deze polymeren is afhankelijk van de bereidingsmethoden en het gebruikte katalysatorsysteem, wat resulteert in industrieel belangrijke synthetische rubbers en polymeerharsen.
Andere additiereacties
Butadieen ondergaat 1,2- of 1,4-additie met verschillende reagentia, waarbij de verhoudingen van additieproducten afhankelijk zijn van de reactieomstandigheden. Deze additieproducten dienen als cruciale tussenproducten bij de productie van stoffen zoals chloropreen en hexamethyleendiamine.
Specifieke reacties
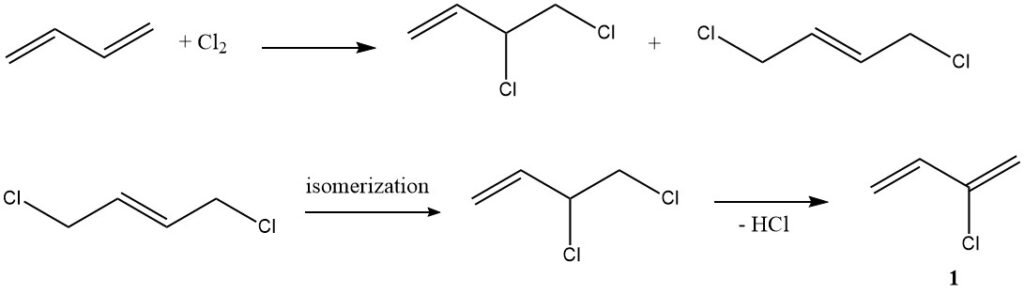
1. Chlorering (productie van chloropreen): in een typisch voorbeeld van elektrofiele additie reageert butadieen met chloor om chloropreen (1) te produceren, een verbinding met meerdere industriële toepassingen.
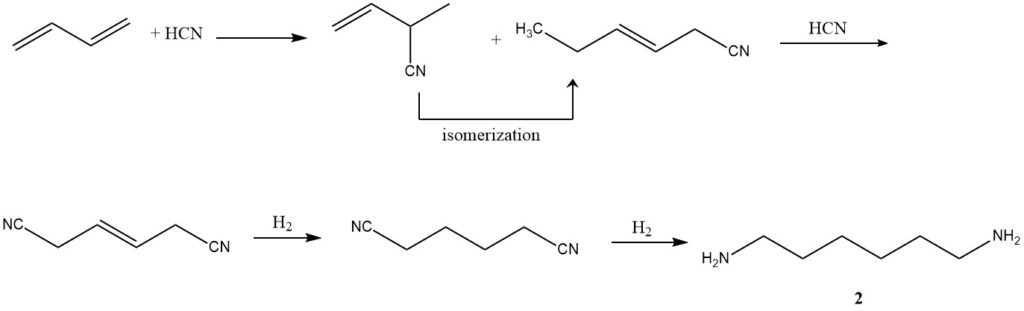
2. Hydrocyanering (Adiponitrilproductie): Met behulp van een driestappenproces ontwikkeld door Du Pont, ondergaat butadieen hydrocyanering om een mengsel van isomere lineaire en vertakte penteennitrillen te vormen. Daaropvolgende isomerisatie en verdere hydrocyanering resulteren in adiponitril (2).
3. Carboalkoxylering (ε-caprolactamproductie): DSM en Du Pont hebben een alternatief proces voor ε-caprolactamproductie uit butadieen onderzocht. Dit meerstapsproces omvat carboalkoxylering, hydroformylering en reductieve aminering. Hoewel het nog niet op industriële schaal is geïmplementeerd, biedt het een veelbelovende weg voor toekomstige ontwikkeling.
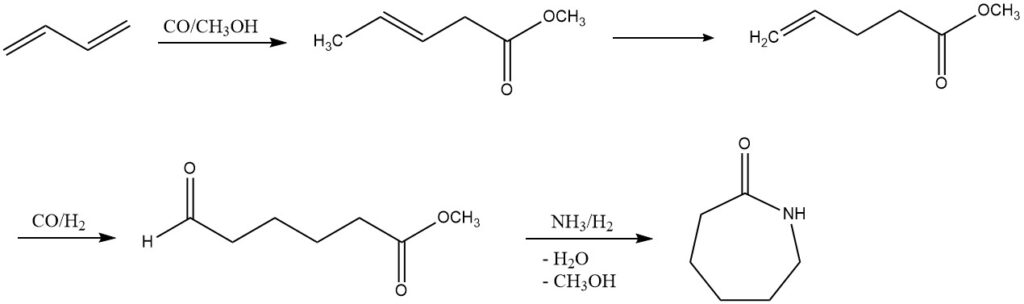
4. Acetoxylering (1,4-butaandiol of tetrahydrofuraanproductie): Door acetoxylering leidt butadieen tot de synthese van 1,4-diacetoxy-2-buteen, dat in een meerstaps Mitsubishi-proces wordt omgezet in 1,4-butaandiol of tetrahydrofuraan. Deze processen, onder invloed van specifieke katalysatoren, tonen het potentieel voor diverse chemische transformaties.
5. Andere oxidatiereacties: Innovatieve processen, zoals het Toyo Soda-proces en directe oxidatie met lucht of zuurstof, vertegenwoordigen economische methoden voor de productie van verschillende C4-derivaten. De introductie van 3,4-epoxy-1-buteen door oxidatie opent mogelijkheden voor de creatie van waardevolle chemische tussenproducten.
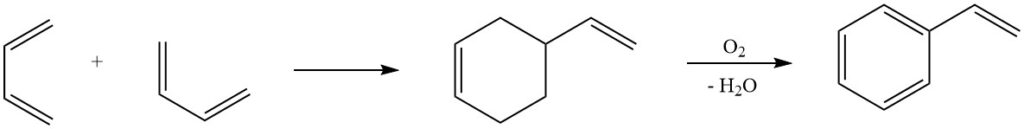
6. Diels-Alder-reactie: Een van de bekendste reacties van butadieen, de Diels-Alder-reactie, speelt een cruciale rol in industriële processen voor de productie van styreen. Dimerisatie van butadieen en daaropvolgende omzetting in styreen benadrukt de veelzijdigheid van deze reactie bij het synthetiseren van waardevolle chemische verbindingen.
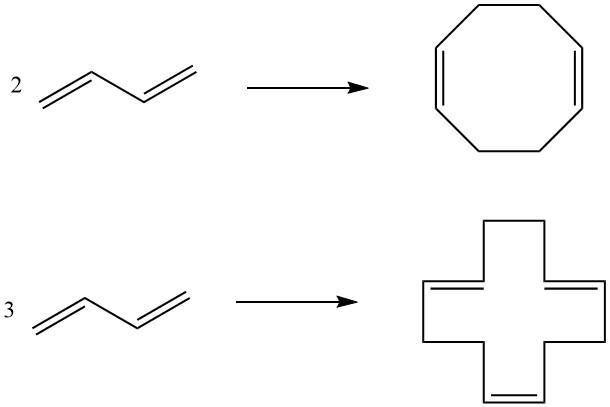
7. Cyclodimerisatie, Cyclotrimerisatie: Twee moleculen butadieen kunnen cyclodimerisatie ondergaan om 1,5-cyclooctadieen te produceren, terwijl drie moleculen resulteren in 1,5,9-cyclododecatrieen. Deze cyclische verbindingen, gefaciliteerd door specifieke katalysatoren, dienen als tussenproducten bij de productie van hogere polyamiden.
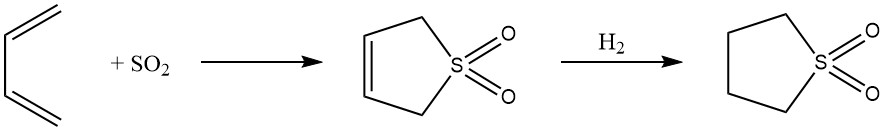
8. 1,4-cycloadditie: Omkeerbare 1,4-additie van butadieen met zwaveldioxide leidt tot de vorming van het cyclische sulfon 2,5-dihydrothiofeen-1,1-dioxide, dat verder wordt omgezet in sulfolaan. Dit proces toont de aanpasbaarheid van butadieen in de synthese van zeer polaire oplosmiddelen.
9. Lineaire dimerisatie en trimerisatie; Telomerisatie: Onder invloed van Ni-, Co-, Pd- of Fe-katalysatoren ondergaat butadieen lineaire dimerisatie of trimerisatie. De resulterende lineaire oligomeren, gescheiden door ketenlengte, bieden diverse verbindingen, zoals 1,3,7-octatrieen.
Telomerisatiereactie is de di- en oligomerisatie van een 1,3-dieen onder toevoeging van een nucleofiele verbinding. Het wordt gekatalyseerd door Pd, Ni of Pt en levert een breed spectrum aan producten op, afhankelijk van de gebruikte nucleofiel.
10. Hydrogenering: Selectieve hydrogenering van butadieen genereert 1-buteen of 2-buteen, en zorgvuldige aanpassing van de reactieomstandigheden zorgt voor voldoende omzetting zonder overhydrogenering tot n-butaan. Commerciële processen van bedrijven als Axens, UOP en Lummus bieden op maat gemaakte benaderingen om de opbrengst van specifieke buteenisomeren te maximaliseren.
11. Vorming van complexen: Butadieen vormt complexen met verschillende metaalverbindingen, zoals Cu(I)-zouten. Hoewel het historisch gezien werd gebruikt bij de extractie van butadieen, hebben moderne extractieve destillatietechnieken deze methode grotendeels vervangen. Complexen met andere overgangsmetalen zoals Fe, Ni, Co, Pd en Pt zijn goed ingeburgerd en dragen bij aan mechanistische studies in alfa-olefinepolymerisatiekatalyse.
3. Productie van butadieen
Historisch gezien bestonden er diverse methoden voor de productie van butadieen. Tegenwoordig zijn er nog vier hoofdroutes:
- Nafta kraken: Deze dominante route vangt butadieen op als een bijproduct van de ethyleenproductie.
- Butaan/Buteen dehydrogenering: Dit proces speelt een kleine, campagne-gebaseerde rol, afhankelijk van de grondstof- en butadieenprijzen.
- Ethanolproductie: Deze methode is in belang afgenomen.
- Acetyleenproductie: Deze route is niet langer commercieel levensvatbaar.
Opkomende biogebaseerde benaderingen worden onderzocht.
De economie van butadieenproductie wordt sterk beïnvloed door de gekoppelde productie van etheen en propeen. Wanneer deze C2- en C3-olefinen goedkoop zijn, wordt specifieke butadieenproductie uit butenen en butaan aantrekkelijker.
3.1. Productie van butadieen uit acetyleen
Historisch gezien werden twee routes gebruikt om butadieen uit acetyleen te produceren. Beide zijn nu verouderd vanwege de energie-intensieve en dure aard van acetyleenproductie. Alleen de eerste stappen van het Reppe-proces, die leiden tot 1,4-butaandiol en tetrahydrofuraan, zijn nog commercieel relevant.
3.2. Productie van butadieen uit ethanol
Het IPATJEW- en OSTROMISLENSKY-proces, later aangepast door LEBEDEW, diende ooit als een belangrijke bron van butadieen, vooral in Duitsland en Oost-Europa tijdens de Tweede Wereldoorlog. Dit proces wordt geïllustreerd door de reactie:
2 CH3CH2OH → CH2=CHCH=CH2 + 2 H2O + H2
en werkt bij temperaturen van 370 tot 450 °C met behulp van MgO – SiO2 of SiO2 – Al2O3 katalysatoren, het bereikt selectiviteiten tot 70 %.
Hoewel het niet langer concurrerend is voor grootschalige productie, kan het nog steeds levensvatbaar zijn in regio’s met goedkope ethanol of overtollige landbouwalcohol.
3.3. Productie van butadieen door dehydrogenering van butaan en butenen
De dehydrogenering van butaan en butenen om butadieen te produceren, brengt unieke uitdagingen met zich mee vanwege de endotherme aard ervan. Om de opbrengst en selectiviteit te maximaliseren, moeten verschillende belangrijke overwegingen worden aangepakt:
Le Chatelier’s Principle: Het verlagen van de partiële druk van de gewenste producten, butadieen en waterstof, drijft de reactie vooruit. Dit kan worden bereikt door vacuümwerking of door stoom toe te voegen aan het reactiemengsel.
Voordelen van stoom:
- Stoom helpt de deactivering van de katalysator te beperken door cokesvorming op het katalysatoroppervlak te voorkomen.
- De endotherme aard van de dehydrogeneringsreactie vereist externe warmte-invoer. Stoom condenseert gemakkelijk en geeft aanzienlijke warmte af om de reactie aan te drijven.
- De gecondenseerde stoom kan eenvoudig worden gescheiden van de productstroom, wat minimale verontreiniging garandeert.
Hoewel hogere temperaturen de vorming van butadieen bevorderen, verhogen ze ook het risico op ongewenste nevenreacties zoals kraken, isomerisatie en polymerisatie. Het vinden van de optimale temperatuurbalans tussen opbrengst en selectiviteit is cruciaal.
Verbindingen die gevoelig zijn voor de bovengenoemde nevenreacties worden verwijderd vóór het dehydrogeneringsproces om hun invloed te minimaliseren.
Omdat de dehydrogeneringreactie niet volledig is, moet de productstroom worden gescheiden om butadieen te isoleren. Niet-gereageerde startmaterialen worden terug in het proces gerecycled om de efficiëntie te maximaliseren.
Door deze aspecten zorgvuldig te controleren, kan de dehydrogenering van butaan en butenen worden geoptimaliseerd voor efficiënte en selectieve butadieenproductie.
3.3.1. Dehydrogenering van n-butaan
Er bestaan twee prominente methoden voor het dehydrogeneren van n-butaan tot butadieen:
1. Houdry-Catadiene-proces:
Dit gevestigde eenstapsproces wordt sinds 1943 commercieel uitgevoerd. Meerdere gepakte bedreactoren, parallel opgesteld, worden gecycled tussen reactie- en regeneratiefasen. Een aluminiumoxidekatalysator met 20% chroomoxide vergemakkelijkt de dehydrogenering van zuivere n-butaan of het mengsel ervan met n-butenen bij 550-650 °C en 10-25 kPa.
Hoge temperaturen bevorderen de productie van butadieen, maar genereren ook ongewenste bijproducten zoals C1-C3-koolwaterstoffen, waterstof en katalysatorvervuilende cokes.
Na elke reactiecyclus (5-15 minuten) ondergaat de reactor een regeneratie: het verbranden van de cokesafzetting geeft warmte vrij, opgeslagen in de katalysator en inert materiaal, voor de volgende reactiefase.
Dit proces levert een butadieenconcentratie van 15-18% op bij de uitlaat van de reactor. Vervolgende herstelstappen, waaronder blussen, compressie, strippen en scheiden, verhogen de butadieenconcentratie tot 30-50%. Van 1000 ton n-butaan wordt ongeveer 550 ton butadieen verkregen. Zuiver butadieen kan worden geïsoleerd door extractieve destillatie.
2. Phillips Petroleum Process:
Dit tweestapsproces biedt voordelen zoals een langere levensduur van de katalysator en hogere butadieenopbrengsten.
- Dehydrogenering tot buteen: n-butaan ondergaat katalytische dehydrogenering tot buteen bij 600 °C en 1 bar op een Cr2O3-Na2O-Al2O3-katalysator.
- Buteenscheiding: n-butenen worden geëxtraheerd met behulp van hulpmiddelen zoals aceton, acetonitril of furfural.
- Butadieenvorming: Gescheiden n-butenen worden gedehydrogeneerd tot butadieen in een isotherme buisreactor. De reactor wordt door rookgas verhit tot 600 °C en werkt bij 1 bar druk met oververhitte stoomtoevoeging over een Fe2O3-K2O-Al2O3-katalysator.
- Butadieenwinning en -zuivering: Extractieve destillatie met de bovengenoemde hulpmiddelen wint butadieen terug en zuivert het.
Het Phillips-proces heeft langere looptijden (geen katalysatorregeneratie) en een butadieenopbrengst van 65% op basis van n-butaan, wat de efficiëntie en verbeterde selectiviteit aantoont in vergelijking met het Houdry-Catadieen-proces.
3.3.2. Dehydrogenering van n-butenen
n-butenen, die vaak worden aangetroffen in gekraakte benzine, olefinenproductie en LPG-dehydrogenering, zijn vaak aanwezig als onderdeel van een C4-koolwaterstofmengsel. Hoewel C4-paraffines van C4-olefinen kunnen worden gescheiden via extractieve destillatie (zoals bij butadieenwinning), vormt het scheiden van isobuteen en n-buteen een unieke uitdaging vanwege hun dicht bij elkaar liggende kookpunten.
Verschillende methoden pakken dit scheidingsprobleem aan:
1. BASF-proces: Gebruikt 40-45% H2SO4 om isobuteen selectief om te zetten in tert-butanol, wat een eenvoudigere scheiding mogelijk maakt.
2. Isobuteen kan worden omgezet in methyl-tert-butylether of isobuteenoligomeren voor verdere verwerking en scheiding.
3. Destillatie met hydroisomerisatie: Processen zoals Axens’ Isopure en CD-Tech’s CD DeIB combineren destillatie met hydroisomerisatie van 1-buteen tot 2-buteen. Omdat 2-buteen een ander kookpunt heeft dan isobuteen, wordt destillatie haalbaar.
4. Dow-proces: Gebruikt dehydrogenering van n-butenen met stoom over een Ca/Ni-fosfaatkatalysator gestabiliseerd met Cr2O3. Oververhitte stoom levert de benodigde warmte voor de reactie, waardoor 50% buteenconversie en tot 90% butadieenselectiviteit wordt bereikt.
5. Parallelle reactorbenadering: Omdat het Dow-proces na 15 minuten katalysatorregeneratie vereist, worden parallelle reactoren gebruikt, waardoor continue werking mogelijk is.
Soortgelijke processen zijn ook ontwikkeld door Shell en Phillips Petroleum, die de verschillende benaderingen laten zien die beschikbaar zijn voor dehydrogenering van n-buteen en de productie van butadieen.
3.3.3. Oxidatieve dehydrogenering van n-butenen
Oxidatieve dehydrogenering (ODH) biedt verschillende voordelen ten opzichte van conventionele dehydrogeneringsprocessen voor butadieenproductie. Door waterstof uit het evenwicht te verwijderen door oxidatie, verbetert ODH de conversie en selectiviteit aanzienlijk:
2 C4H8 + O2 → 2 C4H6 + 2 H2O
Deze exotherme reactie levert warmte voor de endotherme dehydrogenering, waardoor de energiebehoefte verder wordt verlaagd. Bovendien helpt de aanwezigheid van zuurstof en stoom om katalysatorverkooksing te minimaliseren.
Historische ODH-processen:
Oxo-D-proces (Petro-Tex): Dit proces, dat sinds 1965 wordt gebruikt, maakt gebruik van een ferrietkatalysator en werkt onder milde druk. De voordelen zijn onder meer een laag stoom- en verwarmingsenergieverbruik, hoge conversie/selectiviteit, lange levensduur van de katalysator en geen regeneratievereiste.
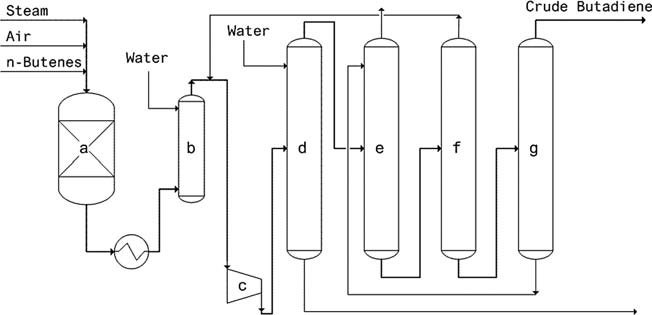
a) Reactor, b) Blustoren, c) Compressor, d) Scrubber, e) Absorber, f) Ontgasser, g) Stripper
O-X-D-proces (Phillips): Dit proces is sinds 1976 in bedrijf en maakt gebruik van een Li-Sn-P-O-katalysator. Het bereikt een buteenconversie van 75-80% met een butadieenselectiviteit van 88-92%.
Nieuwere ontwikkelingen in ODH:
- Nippon-Zeon-proces: Dit proces gebruikt gemengd n-buteen/butaan en lucht/afgas als voeding, wat flexibiliteit biedt in de samenstelling van de voeding. Een gemengde metaaloxidekatalysator bereikt een butadieenopbrengst van 85% op basis van de butenen.
- Mitsubishi Chemical Process: Dit proces maakt gebruik van een Mo/Bi/Co-katalysator en zet een C4-mengsel met 70% n-buteen om met lucht, stoom en stikstof. De toevoeging van stikstof zorgt voor een hoge zuurstof/butaanverhouding, waardoor verkooksing tot een minimum wordt beperkt. Butadieenconversie overschrijdt 80% met een selectiviteit boven 90%.
- Andere ontwikkelingen: Asahi Kasai en Mitsui Chemicals hebben ook ODH-processen ontwikkeld met veelbelovende resultaten, waaronder wervelbedreactoren en strategieën voor de conversie van etheen naar butadieen.
Algemene voordelen van ODH:
- Hogere conversie en selectiviteit vergeleken met conventionele dehydrogeneringsprocessen.
- Verminderde energievereisten vanwege de exotherme oxidatiereactie.
- Lagere katalysatorcoking.
- Potentieel voor het gebruik van gemengde C4-stromen als grondstof.
Beperkingen:
- ODH-processen zijn over het algemeen complexer dan conventionele dehydrogenering.
- De vereiste hoge temperaturen kunnen leiden tot ongewenste vorming van bijproducten als zuurstof wordt gebruikt met butaan
3.4. Isolatie van butadieen uit C4-stoomkrakerfracties
Butadieen wordt voornamelijk geïsoleerd uit C4-fracties die ontstaan tijdens het stoomkraken van koolwaterstoffen. De keuze van de grondstof, zoals nafta in West-Europa en LPG in de Verenigde Staten, speelt een belangrijke rol in het proces, terwijl de ernst van het kraken voornamelijk de samenstelling van de C4-fractie beïnvloedt.
Het scheiden van butadieen uit dit mengsel vormt een uitdaging vanwege het azeotrope gedrag met butaan. Daarom zijn gespecialiseerde technieken nodig.
Het koper(II)ammoniumacetaatproces, dat gebruikmaakt van het vermogen om een complex te vormen met butadieen, pakt dit probleem aan voor fracties met een laag butadieen- en C4-acetyleengehalte. Hogere niveaus van acetylenen vereisen echter voorbehandeling via selectieve hydrogenering.
Extractieve destillatie komt naar voren als de voorkeursmethode voor butadieenisolatie. Deze techniek maakt gebruik van de verschillende affiniteiten van verschillende componenten voor specifieke organische oplosmiddelen op basis van hun mate van onverzadiging.
Populaire oplosmiddelen zijn onder meer acetonitril (door Shell/KBR en LyondellBasell), N-methylpyrrolidon (door BASF), dimethylformamide (door Nippon Zeon Chemicals) en furfural (door ConocoPhillips).
Deze processen, waarbij één of twee extractieve destillatiestappen worden gecombineerd met conventionele destillatie, scheiden butadieen en andere componenten met een hoge affiniteit van minder oplosbare butanen en butenen. Verdere zuiveringsstappen verwijderen resterende onzuiverheden om butadieenzuiverheid te bereiken.
Het BASF-proces, waarbij NMP als oplosmiddel wordt gebruikt, heeft een niet-corrosieve werking en hoge butadieenopbrengsten, terwijl het Nippon Zeon DMF-proces vergelijkbare voordelen vertoont. Recente ontwikkelingen op dit gebied omvatten scheidingswandtechnologie, het combineren van twee destillatiestappen in één eenheid om de efficiëntie te verbeteren, en verbeterde distillatie-interne onderdelen en procescontrole om de capaciteit en prestaties van bestaande eenheden te vergroten.
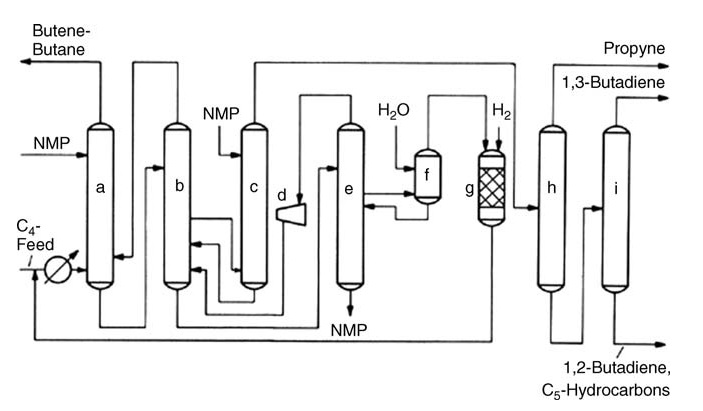
a) Hoofdwasser; b) Gelijkrichter; c) Nawasser; d) Centrifugaalcompressor; e) Ontgassingstoren; f) Waterwasser; g) Hydrogeneringsreactor; h) Eerste destillatie; i) Tweede destillatie
Alternatieve benaderingen zoals selectieve hydrogenering van C4-acetylenen bieden verschillende voordelen. Het KLP-proces van UOP verwijdert acetylenen vóór extractie, wat het proces vereenvoudigt en de butadieenopbrengst verhoogt. Het CDHYDRO-proces van CDTECH biedt flexibiliteit door verschillende niveaus van acetyleenconversie toe te staan, waardoor butadieenverlies wordt geminimaliseerd.
3.5. Butadieen uit biogebaseerde bronnen
De groeiende trend om hernieuwbare bronnen te gebruiken voor petrochemische productie strekt zich uit tot butadieen. Hoewel er verschillende routes bestaan, zijn routes met behulp van bioalcoholen het meest veelbelovend.
De productie van bio-ethanol, tot stand gebracht door het fermenteren van suikerriet, maïs of lignocellulosemateriaal, bereikte in 2011 wereldwijd 68 miljoen ton. Bestaande technologieën kunnen bio-ethanol omzetten in butadieen.
Hoewel er momenteel geen grootschalige productie van bio-butadieen bestaat, stimuleert de toenemende interesse van biobutanol als brandstofadditief de voortdurende procesontwikkeling. Dehydratie en dehydrogenering van biobutanol tot n-buteen.
Een andere mogelijke route betreft gasfermentatie van koolmonoxide, verkregen uit vergassing van organisch materiaal of industriële afvalgassen. Dit bacteriële proces produceert 2,3-butaandiol, een voorloper van butadieen. Deze technologie bevindt zich echter nog in een vroeg stadium.
Momenteel is de productie van biobased butadieen economisch niet concurrerend in vergelijking met de petrochemische route. De stijgende olie- en aardgasprijzen, in combinatie met verdere technologische vooruitgang, zouden echter in de toekomst biotransformatieroutes kunnen begunstigen.
4. Toepassingen en economisch belang van butadieen
Butadieen wordt voornamelijk gebruikt als monomeer of comonomeer bij de productie van synthetisch rubber. Het draagt bij aan styreen-butadieenrubber, polybutadieenrubber, acrylonitril-butadieenrubber en chloropreenrubber.
Naast de productie van rubber speelt butadieen een cruciale rol in verschillende kunststoffen. Het vormt de ruggengraat van slagvast polystyreen, een tweefasensysteem dat polystyreen en polybutadieen combineert. Bovendien draagt butadieen bij aan ABS-polymeren, een mengsel van acrylonitril, butadieen en styreen, en MBS-copolymeren, die worden gebruikt als modificatoren voor polyvinylchloride.
Bovendien dient butadieen als tussenproduct in verschillende chemische syntheses.
In de Verenigde Staten, Japan en West-Europa is de auto-industrie de belangrijkste consument van butadieenrubber.
De butadieenprijzen daalden begin jaren negentig aanzienlijk vanwege het overaanbod door de toegenomen kraakcapaciteit. Dit leidde tot butadieenhydrogenering en gebruik als grondstof voor krakers.
Sinds eind jaren negentig zorgde de stijgende vraag naar rubberproducten en polymeren, met name in Azië, voor een exponentiële toename van de vraag naar butadieen en een gestage prijsstijging.
De wereldwijde economische recessie van 2008 veroorzaakte een dramatische daling van de vraag naar butadieen, gevolgd door een herstel. Butadieenprijzen overtroffen de ethyleenprijzen, een zeldzame gebeurtenis, totdat de volatiliteit leidde tot pieken van meer dan 2.000 euro per ton.
Deze prijsschommelingen kunnen worden toegeschreven aan de komst van op ethaan gebaseerde krakers in het Midden-Oosten en de verschuiving van Amerikaanse krakers naar lichtere gasgrondstoffen. Deze veranderingen resulteren in een lagere butadieenopbrengst ondanks de toenemende wereldwijde vraag.
5. Toxicologie van butadieen
Blootstelling en toxiciteit:
- Beroepsmatige blootstelling aan butadieen is het hoogst in de petrochemische, butadieenzuiverings- en verwerkingsindustrie en bij de productie van rubber- en kunststofproducten.
- Butadieen komt voornamelijk via inademing in het lichaam terecht, waarbij huidcontact minder vaak voorkomt.
- Niet-beroepsmatige blootstelling kan plaatsvinden in de buurt van puntbronnen zoals branden, sigarettenrook en voertuigemissies, hoewel op veel lagere niveaus dan in beroepsmatige omgevingen.
Dierstudies:
- Butadieen vertoont een lage acute toxiciteit, waarbij hoge doses narcose veroorzaken, voorafgegaan door opwinding en hyperventilatie.
- Herhaalde blootstelling op korte termijn aan hoge concentraties (4000-8000 ppm) veroorzaakt speekselvloed bij ratten, maar heeft geen invloed op groei, voedselconsumptie of andere parameters.
- Muizen die aan vergelijkbare niveaus worden blootgesteld, vertonen een lager lichaamsgewicht en een hogere sterfte, met een hogere gevoeligheid voor butadieen vergeleken met ratten.
- Langdurige blootstelling bij ratten (tot 111 weken) leidt tot voorbijgaande neusafscheiding, ataxie en vroege sterfte bij de hoogste concentratie (8000 ppm). Het verhoogt ook het levergewicht en suggereert een potentieel voor metaplasie in de longen en een hogere incidentie van sommige tumoren.
- Muizen die gedurende 60-61 weken aan lagere concentraties (625-1250 ppm) worden blootgesteld, vertonen toxische en proliferatieve laesies in de neusholte, levernecrose en atrofie van de voortplantingsorganen. Opvallend is dat ze verschillende tumoren, waaronder kwaadaardige tumoren, eerder en in hogere mate ontwikkelen dan controles.
- Een tweejarig onderzoek met nog lagere concentraties (6,25-625 ppm) onthult de vroege ontwikkeling van uitgebreide lymfomen, ongebruikelijke harttumoren en longtumoren bij muizen.
Metabolisme en mutageniteit:
- Butadieen wordt in de lever gemetaboliseerd tot epoxide-intermediairen, waarvan wordt vermoed dat ze de belangrijkste bijdragers zijn aan de toxiciteit en carcinogeniteit ervan.
- De vorming van deze metabolieten is uitgesprokener bij muizen dan bij ratten en mensen.
- Butadieen vertoont mutageniteit in de Ames-test alleen in aanwezigheid van enzymen, wat duidt op de vorming van een mutageen intermediair.
Menselijke gegevens:
- Er zijn beperkte menselijke gegevens beschikbaar over de effecten van blootstelling aan butadieen.
- Vrijwilligers die werden blootgesteld aan een zeer hoge concentratie (8000 ppm) ondervonden tijdelijke irritatie, wazig zicht en ademhalingssymptomen, maar er werden geen cumulatieve effecten waargenomen.
- Hematologische studies van werknemers die werden blootgesteld aan gemiddelde niveaus van 20 ppm butadieen vertoonden geen significante afwijkingen.
- Vroegtijdige sterftestudies van werknemers in de styreen-butadieenrubberindustrie wezen niet op een verhoogd risico op kanker.
- Recente beoordelingen van epidemiologische studies leveren bewijs voor een verhoogd risico op hematolymfatische maligniteiten, met name leukemie, bij verhoogde blootstelling aan butadieen.
Classificatie en blootstellingslimieten op de werkplek:
- Op basis van gegevens van dieren en mensen wordt butadieen door het Internationaal Agentschap voor Kankeronderzoek (IARC) geclassificeerd als een kankerverwekkende stof uit groep 1.
- De grenswaarden voor beroepsmatige blootstelling variëren licht tussen verschillende regelgevende instanties, met grenswaarden variërend van 0,5 tot 4,4 mg/m³.
- Er worden voortdurend inspanningen geleverd om de blootstellingsniveaus op werkplekken waar butadieen wordt gehanteerd te verlagen.
Referentie
- Butadieen; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_431.pub2
