Hydroxylamine: Eigenschappen, Reacties, Productie en Toepassingen

Wat is Hydroxylamine?
Hydroxylamine is een anorganische verbinding met de chemische formule NH2OH. Het is een witte kristallijne vaste stof, maar vanwege zijn hygroscopische aard wordt het bijna altijd aangetroffen en gebruikt in waterige oplossing.
Hydroxylamine, oorspronkelijk gerapporteerd door LOSSEN in 1865, werd later geïsoleerd als zijn vrije base in 1891 door LOBRY DE BRUYN. RASCHIG verkreeg een patent voor de eerste industriële methode voor het produceren van hydroxylammoniumsulfaat in Duitsland (1908) en de Verenigde Staten (1911).
Het belang van hydroxylaminezouten en hun oplossingen ligt in hun substantiële rol als tussenproducten in verschillende industriële processen, met name bij de productie van caprolactam. De wereldwijde jaarlijkse capaciteit voor de productie van hydroxylamine wordt geschat op 800.000 metrische ton.
Inhoudsopgave
| Eigenschap | Waarde |
|---|---|
| Molaire massa | 33,03 g/mol |
| Smeltpunt | 32,05 °C |
| Kookpunt bij 29 kPa | 56 °C |
| Dampspanning bij 0 °C | 0,36 kPa |
| Dampspanning bij 32 °C | 7,1 kPa |
| Enthalpie van Vorming | -114 kJ/mol |
1.1. Hydroxylammoniumsulfaat
De hydroxylammoniumsulfaatverbinding, ook bekend als (NH3OH)2SO4 of (NH2OH)2·H2SO4, bestaat in een kristallijne vorm die gemakkelijk oplost in water, maar slechts een geringe oplosbaarheid vertoont in organische oplosmiddelen.
De vaste vorm van deze verbinding heeft een dichtheid van 1,883 g/cm³, terwijl de bulkdichtheid ongeveer 1,10 g/cm³ is.
Het is belangrijk om op te merken dat hydroxylammoniumsulfaat ontleding ondergaat bij blootstelling aan temperaturen boven 120 °C.
Waterige oplossingen van hydroxylammoniumsulfaat zijn helder en kleurloos. In een 1 gew.% waterige oplossing bij 20 °C bedraagt de pH 3,6.
1.2. Hydroxylammoniumchloride
Kristallijn hydroxylammoniumchloride, ook wel (NH3OH)Cl of NH2OH·HCl genoemd, is een hygroscopisch zout dat kristallen vormt. Het vertoont een hoge oplosbaarheid in zowel water als methanol.
De toevoeging van 0,5 gew.% pyrogene silica voorkomt effectief klontering, waarbij de silicagel fungeert als een onoplosbaar en inert bestanddeel.
Hydroxylammoniumchloride heeft een dichtheid van 1,676 g/cm³ en een bulkdichtheid van ongeveer 0,780 g/cm³.
De ontleding ervan vindt plaats bij temperaturen boven 120 °C. Wanneer opgelost in water, heeft een 1 gew.% waterige oplossing van hydroxylammoniumchloride bij 20 °C een pH-waarde van 3,2.
2. Chemische reacties van hydroxylamine
Bij verhitting ondergaan hydroxylammoniumzouten ontleding en als er lokale verhitting optreedt, kan dit leiden tot een exotherme ontleding die niet meer te stoppen is. De aanwezigheid van zware metalen, met name koper, koperhoudende legeringen en koperzouten, bevordert de ontleding.
Ontleding van hydroxylammoniumsulfaat produceert zwaveldioxide, distikstofmonoxide (lachgas), water en ammoniumsulfaat. Aan de andere kant ontleedt hydroxylammoniumchloride in waterstofchloride, stikstof, water en ammoniumchloride.
Wanneer hydroxylammoniumzouten reageren met alkali, leveren ze hydroxylamine op, dat gemakkelijk wordt ontbonden. Reactie met nitrieten resulteert in ontleding tot distikstofmonoxide.
Waterige oplossingen van hydroxylammoniumzouten vertonen zuurgraad. Langdurige blootstelling aan 80 °C leidt tot langzame ontleding. Hydroxylamine en zijn zouten fungeren als radicalenvangers in oplossing, wat leidt tot de vorming van ammoniak en stikstof.
Oxidatie van hydroxylamine produceert, afhankelijk van de oxidant en reactieomstandigheden, stikstofverbindingen in verschillende oxidatietoestanden.
Sterke reductiemiddelen zoals zink of ijzerpoeder leveren ammoniak op. Veel metaalionen vormen complexen met hydroxylamine.
Hydroxylammoniumzouten kunnen worden omgezet in hydroxylamine-O-sulfonzuur wanneer ze reageren met oleum of chloorsulfonzuur. Dit zuur dient als een geschikt reagens voor processen zoals aminering, reductieve deaminering, hydroxymethylering en de vorming van heterocyclische verbindingen.
Hydroxylamine kan reageren op zowel stikstof- als zuurstofatomen. Bij het streven naar het bereiden van O-gesubstitueerde hydroxylaminen is bescherming van het stikstofatoom noodzakelijk om N-alkylering te voorkomen.
Hydroxylammoniumverbindingen reageren met aldehyden en ketonen om oximen te vormen. β-diketonen en β-dialdehyden leveren hydroxylamine-isoxazolen op.
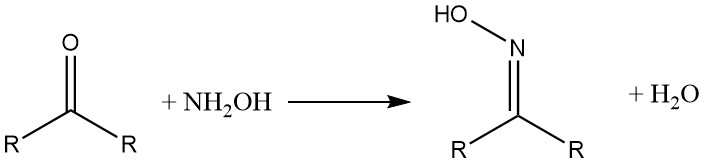
Met carbonzuren en hun derivaten vormt hydroxylamine de overeenkomstige hydroxaminezuren.

Reactie met isocyanaten en nitrillen leidt respectievelijk tot de vorming van N-hydroxyureums en amidoximen.

Hydroxylamine reageert ook met olefinische dubbele bindingen:
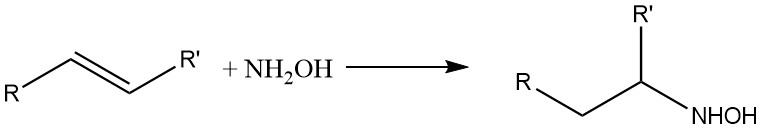
3. Productie van hydroxylamine
De industriële productie van hydroxylamine omvat de reductie van de hogere oxidatietoestanden van stikstof. Zo kan stikstofoxide of salpeterzuur katalytische hydrogenering ondergaan om hydroxylamine te verkrijgen.
De reductie van salpeterigzuur tot hydroxylamine omvat het gebruik van zwaveligzuur. In al deze processen is het resulterende product een waterige oplossing van een zout, NH2OH·HX (waarbij HX een zuur vertegenwoordigt, zoals zwavelzuur of fosforzuur), of (NH3OH)X, in plaats van vrij hydroxylamine.
De zure hydrolyse van primaire nitroalkanen, die gelijktijdig het overeenkomstige carbonzuur produceert, speelt een kleine rol in de algehele productie van hydroxylamine.
3.1. Productie van hydroxylamine door katalytische hydrogenering van stikstofoxide
Om stikstofoxide met een hoge zuiverheid te verkrijgen, wordt een proces in twee stappen gebruikt. In eerste instantie reageren ammoniak en zuurstof over een platina-rhodiumkatalysator bij temperaturen boven de 900 °C.
Om de veiligheid te garanderen, wordt het reactiegas verdund met voldoende water of waterdamp, waardoor het mengsel onder de onderste explosiegrens komt. Deze reactie levert stikstofoxide op, samen met stikstofdioxide en overtollige zuurstof als bijproducten.
De tweede stap omvat de hydrogenering van stikstofdioxide en overtollige zuurstof over een zilverkatalysator. Het stikstofdioxide wordt omgezet in stikstofoxide, terwijl de overtollige zuurstof wordt omgezet in water.
Na condensatie en gelijktijdige terugwinning van waterdamp wordt het stikstofoxide gezuiverd met behulp van een wasser.
Het wordt vervolgens omgezet in hydroxylamine door het te laten reageren met waterstof onder 50 °C over een gedeeltelijk vergiftigde platinakatalysatorsuspensie in zwavelzuur. Als bijproducten worden kleine hoeveelheden ammoniumsulfaat en distikstofmonoxide geproduceerd.
Het industriële proces volgt een continue meerstapsbenadering, met uitgebreide recirculatie van uitlaatgassen.
Het restgas, dat waterstof, stikstof, stikstofoxide en distikstofmonoxide bevat, kan worden verbrand om stoom terug te winnen. Door de gassamenstelling zorgvuldig te selecteren, kunnen explosieve gasmengsels worden vermeden tijdens de synthese van hydroxylamine.
Bovendien omvat een aangepast proces de katalytische hydrogenering van stikstofmonoxide, wat leidt tot de productie van zowel cyclohexanonoxime als hydroxylamine. Deze methode staat bekend als zure oximatie.
3.2. Productie van hydroxylamine door katalytische hydrogenering van nitraten
Hydroxylamine wordt gewoonlijk geproduceerd door het hydroxylamine-fosfaat-oxime (HPO)-proces. Dit proces omvat de hydrogenering van een ammoniumnitraatoplossing in aanwezigheid van fosforzuur.
Het HPO-proces wordt doorgaans uitgevoerd naast de synthese van cyclohexanonoxime, dat wordt gebruikt bij de productie van caprolactam.
3.3. Productie van hydroxylamine door het Raschig-proces
Het Raschig-proces, dat vaak wordt aangepast, blijft een belangrijke methode voor de industriële productie van hydroxylamine.
In het Raschig-proces ondergaan water, ammoniak en koolstofdioxide een reactie in een absorptiekolom. Deze reactie leidt tot de vorming van een ammoniumcarbonaatoplossing, die bij lage temperaturen reageert met stikstofoxiden om een alkalische oplossing van ammoniumnitriet te produceren:
NH3 + H2O + CO2 → (NH4)2CO3
(NH4)2CO3 + NO + NO2 → 2 NH4NO2 + CO2
In de volgende stap wordt het ammoniumnitriet omgezet in ammoniumhydroxylaminedisulfonaat door het te laten reageren met zwaveldioxide:
NH4NO2 + 2 SO2 + NH3 + H2O → HO–N(SO3NH4)2
In dit proces wordt overtollig ammoniumhydroxylaminedisulfonaat gerecycled. De oplossing met ammoniumhydroxylaminedisulfonaat wordt afgetapt en het zout wordt gehydrolyseerd en geneutraliseerd, wat resulteert in de productie van hydroxylammoniumsulfaat en ammoniumsulfaat als eindproducten.
HO–N(SO3NH4)2 + H2O → (NH3OH)2SO4 + (NH4)2SO4
3.4. Productie van hydroxylamine door zuursplitsing van nitroalkanen
De splitsing van mengsels die nitropropaan en nitromethaan bevatten, kan worden bereikt door ze te behandelen met zwavelzuur bij verhoogde temperaturen. Deze reactie levert hydroxylammoniumsulfaat en het overeenkomstige carbonzuur op:
Nitropropaan + nitromethaan + zwavelzuur → hydroxylammoniumsulfaat + carbonzuur
Dit proces is echter in beperkte mate toegepast vanwege de hoge kosten en de beperkte beschikbaarheid van de vereiste grondstoffen.
4. Toepassingen van hydroxylamine
Meer dan 95% van de hydroxylamineproductie is bestemd voor de productie van cyclohexanonoxime of caprolactam.
Verschillende producenten maken gebruik van hydrogenering of het Raschig-proces, waarbij voornamelijk variaties worden waargenomen in de hoeveelheid ammoniumsulfaat die tijdens oximatie wordt gegenereerd.
Hydroxylammoniumzouten dienen als een stabiele vorm van hydroxylamine en vinden toepassingen in verschillende sectoren in de chemische industrie. Enkele opvallende toepassingen zijn:
- Chemische industrie: Werkt als een reactant voor de productie van oximen als tussenproducten, en functioneert ook als een oxidatie- of reductiemiddel, afhankelijk van de pH.
- Verf en coatings: Wordt gebruikt bij de productie van gespecialiseerde oximen die worden gebruikt als anti-crèmemiddelen.
- Farmaceutica: Wordt gebruikt bij de productie van antibiotica, steroïden, kalmeringsmiddelen, spasmolytica en antituberculosemiddelen.
- Fotografie: Wordt gebruikt als stabilisator voor ontwikkelaars en als additief in kleuremulsies.
- Rubberindustrie: Werkt als een regulator bij de polymerisatie van synthetisch rubber, een antioxidant voor natuurlijk rubber en een versneller bij de vulkanisatie van synthetisch rubber.
- Zeep: Werkt als een hulpmiddel bij het raffineren van vetten voor de productie van zeep.
- Kunststoffen: fungeert als regulator en remmer in verschillende polymerisatieprocessen.
- Metallurgie: wordt gebruikt als additief voor de oppervlaktebehandeling van staal, als hulpmiddel bij de extractie van metaal uit elektrolyseafvalvloeistof en voor het terugwinnen van stortplaatsen. Dient ook als flotatiemiddel voor koperertsen.
- Kernindustrie: fungeert als hulpmiddel bij de scheiding van uranium en plutonium.
- Textiel: fungeert als hulpmiddel bij specifieke verfprocessen, als fixeermiddel voor textielverfstoffen en als uitgangsmateriaal voor textielverfstoffen op basis van isatine en isoxazool.
- Gewasbescherming: fungeert als uitgangsmateriaal voor de productie van insecticiden, herbiciden en plantengroeiregulatoren.
- Voedsel: fungeert als tussenproduct bij de productie van zoetstoffen.
Deze toepassingen benadrukken de veelzijdigheid en het belang van hydroxylammoniumzouten in een breed scala aan industrieën.
5. Toxicologie en gezondheid op het werk
Hydroxylammoniumverbindingen worden als schadelijk voor de gezondheid beschouwd en kunnen irritatie veroorzaken. De LD50 (oraal, rat) voor hydroxylammoniumverbindingen bedraagt ongeveer 600-640 mg/kg. Wat betreft aquatische toxiciteit varieert de LC50 (goudwinde, 48 uur) voor hydroxylammoniumsulfaat van 1 tot 10 mg/l.
Bij contact met de huid kan hydroxylamine lichte tot matige irritatie veroorzaken en is sensibilisatie mogelijk. Het heeft ook een matig tot sterk irriterend effect op slijmvliezen, zoals de ogen.
Hydroxylamine kan door de huid worden opgenomen en heeft het potentieel om methemoglobine te vormen.
Studies naar de teratogene effecten van hydroxylamine (bij ratten) hebben geen schadelijke effecten op nakomelingen aangetoond. Hoewel hydroxylamine en zijn zouten op basis van de huidige gegevens niet als kankerverwekkend worden beschouwd, is gebleken dat ze mutageen zijn voor lagere organismen.
Het is belangrijk om contact met hydroxylammoniumzouten te vermijden vanwege hun irriterende effecten en de mogelijkheid dat stof de huid, ogen en keel aantast. In geval van contact met de huid of ogen, moeten de aangetaste gebieden grondig met water worden gespoeld.
Het inslikken van hydroxylammoniumzouten moet ten strengste worden vermeden en indien nodig moet een arts worden geraadpleegd. Hydroxylammoniumzouten moeten worden geëtiketteerd als gevaarlijke stoffen.
Referentie
- Hydroxylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a13_527
