Salzsäure: Eigenschaften, Herstellung und Verwendung
Salzsäure, auch Salzsäure genannt, ist eine wasserbasierte Lösung aus Chlorwasserstoff (HCl).
Geschichte der Entdeckung
Im 15. Jahrhundert erhitzte ein deutscher Alchemist namens VALENTIN eine Substanz namens grünes Vitriol (FeSO4·7 H2O) zusammen mit Kochsalz. Dadurch erhielt er eine Substanz, die als Salzgeist bezeichnet wird.
Im 17. Jahrhundert synthetisierte GLAUBER Salzsäure durch die Verbindung von Kochsalz mit Schwefelsäure. Es war im Jahr 1790, als DAVY die Zusammensetzung von Chlorwasserstoff durch die Synthese von Wasserstoff und Chlor festlegte.
Im selben Jahr entdeckte LEBLANC ein nach ihm benanntes Verfahren zur Herstellung von Soda. Bei diesem Prozess wurde Kochsalz mit Schwefelsäure umgesetzt, wodurch Chlorwasserstoff freigesetzt wurde. Ursprünglich als unerwünschtes Nebenprodukt betrachtet, wurde es in erheblichen Mengen in die Atmosphäre freigesetzt.
Im Jahr 1863 verpflichtete das Alkali Act die englischen Sodahersteller jedoch dazu, den Chlorwasserstoff in Wasser aufzulösen, was zu einer weit verbreiteten industriellen Verwendung der produzierten Säure führte. Überschüssiger Chlorwasserstoff, der nicht als Salzsäure genutzt werden konnte, wurde zu Chlor oxidiert.
Die industrielle Synthese von Chlorwasserstoff entstand parallel zur Entwicklung des Chlor-Alkali-Elektrolyseverfahrens zu Beginn des 20. Jahrhunderts. Diese Methode lieferte zusätzlich zu der auf der Reaktion zwischen Chloriden und Schwefelsäure oder Natriumhydrogensulfat basierenden Methode ein reineres Produkt.
Aufgrund der erheblichen Mengen an Chlorwasserstoff, die als Nebenprodukte bei Chlorierungsprozessen wie der Herstellung von Vinylchlorid aus Ethylen entstehen, verlieren diese Prozesse zunehmend an Bedeutung. Darüber hinaus kann Salzsäure aus Gasen gewonnen werden, die bei der Verbrennung chlorhaltiger Abfälle entstehen, was dem wachsenden Fokus auf Umweltschutz entspricht.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Salzsäure
Chlorwasserstoff (HCl) liegt unter normalen Bedingungen als transparentes Gas vor, das sich durch seinen starken Geruch und seine stark ätzende Wirkung auf die Schleimhäute der Atemwege auszeichnet.
Einige physikalische Eigenschaften von Chlorwasserstoff sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| Molmasse | 36,461 g/mol |
| Schmelzpunkt (mp) | -114,22 °C |
| Siedepunkt (BP) | -85,05 °C |
| Dampfdichte | 1,639 g/L |
| Flüssigkeitsdichte | 1,18 g/ml |
| Kritische Temperatur | 51 °C |
| Kritischer Druck | 81,6 bar |
2. Chemische Eigenschaften von Salzsäure
Chlorwasserstoff weist eine thermische Stabilität bis etwa 1500 °C auf und unterliegt darüber hinaus einer erheblichen Dissoziation. In seiner vollständig trockenen Form zeigt Chlorwasserstoff eine begrenzte Reaktivität und zeigt einen vernachlässigbaren Angriff auf Weichstahl.
Darüber hinaus erfordern Reaktionen mit wasserfreiem Chlorwasserstoff typischerweise die Anwesenheit von Katalysatoren. Umgekehrt verwandelt sich Chlorwasserstoff, wenn er in einem polaren Lösungsmittel wie Wasser gelöst wird, in eine starke Säure und wird dadurch zu einem hochreaktiven Reagens.
Die Löslichkeit von Chlorwasserstoff in Wasser ist beträchtlich, begleitet von der Freisetzung einer erheblichen Wärmemenge. Dabei entsteht Salzsäure, die einen äußerst aggressiven Charakter besitzt.
Es weist die Fähigkeit auf, die meisten kommerziell erhältlichen Metalle und Legierungen in unterschiedlichem Ausmaß zu korrodieren. Daher müssen Metalle durch den Einsatz geeigneter nichtmetallischer Auskleidungen oder nichtmetallischer Baumaterialien geschützt werden.
Unter genau definierten Bedingungen können Tantal oder hochbeständige Nickellegierungen wie Hastelloy B eingesetzt werden. Unedlere Metalle lösen sich jedoch auf, was zur Freisetzung von Wasserstoffgas führt.
3. Herstellung von Salzsäure
Das Vorkommen von freiem Chlorwasserstoff ist in der Natur begrenzt und kommt nur in geringen Konzentrationen vor. Es wurde in der Stratosphäre in Konzentrationen von etwa 10–11 Volumenprozent nachgewiesen.
Andererseits sind anorganische Chloride weit verbreitet, wobei Chlor das elfthäufigste chemische Element ist. Alkali- und Erdalkalichloride, insbesondere Steinsalz, dienen als primäre Rohstoffe für verschiedene Verfahren zur Herstellung von Chlorwasserstoff oder Salzsäure.
Zu diesen Methoden gehören Prozesse mit Zwischenstoffen wie Chlor oder chlorierten organischen Verbindungen.
In natürlichen Vorkommen wird Chlorwasserstoff bei Vulkanausbrüchen oder anderen Freisetzungen unterirdischer Gase freigesetzt. Die erzeugte Menge an Chlorwasserstoff kann mit der von Schwefeldioxid vergleichbar sein.
Salzsäure kommt natürlicherweise im Magensaft von Säugetieren vor, mit einer Konzentration von etwa 0,1 mol/L im menschlichen Magen.
3.1. Methoden zur Herstellung von Salzsäure
Chlorwasserstoff kann durch mehrere Reaktionen erzeugt werden:
1. Synthese aus Elementen:
Die Kombination von Wasserstoffgas (H2) und Chlorgas (Cl2) führt zur Bildung von Chlorwasserstoffgas (HCl):
H2 + Cl2 → 2 HCl
2. Reaktion von Metallchloriden mit Schwefelsäure:
Metallchloride, insbesondere Natriumchlorid, können mit Schwefelsäure (H2SO4) oder Hydrogensulfat zu Chlorwasserstoff reagieren:
Metallchlorid + H2SO4 → HCl + Metallsulfat
3. Nebenprodukt der Chlorierung:
Bei der Herstellung verschiedener chlorierter organischer Verbindungen wie Dichlormethan, Trichlorethylen, Perchlorethylen oder Vinylchlorid entsteht durch eine Reihe von Reaktionen Chlorwasserstoff als Nebenprodukt:
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
4. Thermische Zersetzung hydratisierter Schwermetallchloride:
Chlorwasserstoff kann aus der thermischen Zersetzung hydratisierter Schwermetallchloride gewonnen werden, die in der für die Metallbehandlung verwendeten Beizlauge vorhanden sind.
5. Verbrennung chlorierter organischer Abfälle:
Bei der Verbrennung chlorierter organischer Abfälle entsteht als Folge Chlorwasserstoff:
C4H6Cl2 + 5 O2 → 4 CO2 + 2 H2O + 2 HCl
Die Hauptquelle für Chlorwasserstoff ist heutzutage das Nebenprodukt, das bei Chlorierungsprozessen anfällt. Der erforderliche Reinigungsgrad hängt von der beabsichtigten Anwendung ab. Derzeit nimmt die Rückgewinnung von Chlorwasserstoff aus Abfallstoffen zu.
Darüber hinaus kann bei unerwünschten Reaktionen wie der Hydrolyse von Friedel-Crafts-Katalysatoren Chlorwasserstoff entstehen:
AlCl3 + 3 H2O → Al(OH)3 + 3 HCl
3.2. Industrielle Produktion von Salzsäure
3.2.1. Aus Wasserstoff und Chlor
Die einfachste Methode zur Herstellung von Chlorwasserstoff besteht in der direkten Synthese seiner elementaren Komponenten, was zu einem hochreinen Produkt führt. Diese Reaktion ist stark exotherm mit einer Standardreaktionsenthalpie (ΔH) von -184 kJ.
Es ist wichtig zu beachten, dass Gemische aus Wasserstoff und Chlor in einem breiten Zusammensetzungsbereich äußerst explosiv sein können. Licht kann als Auslöser einer Explosion dienen. Daher müssen Vorkehrungen getroffen werden, um die Bildung reaktiver Gemische aus Chlor und Wasserstoff in industriellen Prozessen zu verhindern.
In der industriellen Produktion wird ein Brenner eingesetzt, bei dem Chlor und Wasserstoff getrennt durch konzentrische Rohre in die Brennkammer geleitet werden. Einmal entzündet, verbrennt Chlor in Gegenwart von Wasserstoff und erzeugt eine heiße und ruhige Flamme bei Temperaturen über 2000 °C.
Kieselsäure hat sich als geeignetes Baumaterial für den Brenner bewährt. Es wurden auch Gusseisen oder Stahl, manchmal wassergekühlt, oder Graphit verwendet.
Typischerweise ist der Brenner am Boden einer zylindrischen Brennkammer positioniert, wobei die Flamme vertikal nach oben gerichtet ist. Die Brennkammer selbst besteht aus Stahl und ist mit feuerfesten Steinen ausgekleidet. An die Brennkammer ist ein entsprechend dimensionierter und geformter Kühlabschnitt angeschlossen.
Bei sehr feuchten oder verunreinigten Reaktionspartnern müssen korrosionsbeständige Baumaterialien wie Kieselsäure oder Graphit eingesetzt werden.
Bestehende Produktionsanlagen werden überwiegend aus Kohlenstoffstahl gebaut und der erzeugte Chlorwasserstoff wird nur auf eine Temperatur wassergekühlt, bei der wässrige Salzsäure nicht kondensieren kann.
Die Hauptverunreinigungen sind Feuchtigkeit in Wasserstoff und Sauerstoff in Chlor, obwohl auch Sauerstoffverbindungen wie Dichloroxid (Cl2O) oder Kohlendioxid durch die Bildung von Wasser Probleme verursachen können.
Das Mischungsverhältnis der Rohstoffe wird je nach Verwendungszweck des erzeugten Chlorwasserstoffs angepasst. Es kann ein leichter Überschuss an Wasserstoff oder Chlor eingesetzt werden.
Das Arbeiten mit genau äquimolaren Gemischen wird nicht empfohlen, da die Reaktion nicht vollständig quantitativ verläuft und es schwieriger wird, explosive Gemische zu verhindern.
Abweichungen in der Regelung können zu intermittierenden Verschiebungen zwischen überschüssigem Wasserstoff und überschüssigem Chlor führen, was gelegentlich zum Auftreten explosiver Gemische führt.
Typischerweise stellt Wasserstoff in Chlorwasserstoff weniger Herausforderungen dar als Chlor, daher wird üblicherweise ein leichter Überschuss von 1–2 % Wasserstoff verwendet. Abhängig von der Reinheit der Rohstoffe ist es möglich, völlig chlorfreien Chlorwasserstoff zu gewinnen, wobei überschüssiger Wasserstoff die einzige Verunreinigung darstellt.
Dieser hochreine Chlorwasserstoff kann zur Herstellung von außergewöhnlich reiner Salzsäure genutzt oder verflüssigt oder als trockenes Gas über Stahlrohrleitungen direkt an die Verbraucher geliefert werden.
Die Verwendung von Stahl für Syntheseöfen und Kühler ist eine attraktive Option. Dies ermöglicht den Betrieb unter erhöhtem Druck, der durch den Druck von Chlor und Wasserstoff sowie die Temperatur und den Druck in der Rohrleitung bestimmt wird.
Es ist wichtig, einen ausreichend niedrigen Druck bzw. eine ausreichend hohe Temperatur aufrechtzuerhalten, um die Kondensation wässriger Salzsäure zu verhindern. Die in Häüls betriebenen Stahlöfen können beispielsweise jeweils 30–40 Tonnen Chlorwasserstoff pro Tag produzieren.
Das erzeugte Chlorwasserstoffgas hat einen Druck von bis zu 0,7 MPa und einen Wassergehalt von weniger als 50 ppm (Volumen), was den Einsatz von Stahlrohren für den Transport aus der Anlage erforderlich macht.
Zu den chemisch verwandten Prozessen gehört die Reaktion von Chlor mit Kohlenstoff (in Form von Koks) und Wasserdampf:
C + 2 H2O + 2 Cl2 → 4 HCl + CO2
Ein weiterer verwandter Prozess beinhaltet die Reaktion von Chlor mit Schwefeldioxid und Wasser:
SO2 + 2 H2O + Cl2 → 2 HCl + H2SO4
3.2.2. Reaktion von Metallchloriden mit Schwefelsäure
Der Sulfatprozess zeichnet sich durch einen hohen Energieverbrauch aus. Infolgedessen hat seine Bedeutung im Vergleich zu anderen Verfahren, insbesondere der organischen Chlorierung, bei der erhebliche Mengen Chlorwasserstoff als Nebenprodukt entstehen, allmählich abgenommen.
Darüber hinaus ist das Argument, dass Sulfat-Salzsäure ein Produkt mit höherer Reinheit ergibt, nicht mehr gültig. Nebenproduktsäure kann nun ausreichend gereinigt werden, um den Anforderungen hoher Qualitätsstandards gerecht zu werden. Daher wird hier nur auf den wichtigsten Sulfat-Salzsäure-Prozess eingegangen.
Die Reaktion zwischen Kochsalz und konzentrierter Schwefelsäure erfolgt bei relativ niedrigen Temperaturen (150–300 °C) und führt zur Bildung von Chlorwasserstoff und Natriumhydrogensulfat.
Letzteres reagiert mit überschüssigem Natriumchlorid bei einer Mindesttemperatur von 550–600 °C und erzeugt neutrales Natriumsulfat. Obwohl die Verwendung von Natriumhydrogensulfat als Ausgangsmaterial technisch machbar ist, wurde die Verwendung aufgrund der Unwirtschaftlichkeit des Verfahrens aufgrund der hohen Temperaturen (600–800 °C) und des damit verbundenen Energieverbrauchs eingestellt.
Derzeit ist Schwefelsäure der ausschließliche Ausgangsstoff. Beim Mannheimer Verfahren wird Natriumsulfat hergestellt, während beim Berliner Salzsäureverfahren Natriumhydrogensulfat genutzt wird.
Beim Mannheimer Verfahren werden außenbefeuerte, mit Ziegeln ausgekleidete Muffelöfen eingesetzt. Um die Bildung von Klumpen in der pastösen Masse zu verhindern und das entstehende Natriumsulfat zu entfernen, verfügen diese Öfen über ein Rührwerk mit Schabewirkung.
Chlorwasserstoff wird durch die Seite der Muffel abgelassen und von einem Ventilator in die nächste Stufe gefördert, wobei der Ofen auf einem leicht reduzierten Druck gehalten wird.
Das Abgasgemisch des Ofens enthält bis zu 85 % Chlorwasserstoff sowie Luft, Schwefelsäurenebel und feine Salzpartikel. Typischerweise durchläuft das Gas mehrere Reinigungsstufen, darunter die Filtration durch Koks und Aktivkohle, die Nasswäsche oder chemische Reaktionen.
Das Berliner Salzsäureverfahren liefert Chlorwasserstoffgas mit deutlich höherer Reinheit als das Mannheimer Verfahren. Die Reaktion zwischen Kochsalz und Schwefelsäure findet in geschmolzenem Natriumhydrogensulfat bei etwa 300 °C in gusseisernen Retorten statt.
Alternativ kann Kaliumchlorid verwendet werden, wodurch Chlorwasserstoff und Kaliumhydrogensulfat entstehen. Dieser Prozess behält eine gewisse kommerzielle Bedeutung, da die Primärprodukte die gebildeten Kaliumsalze sind (d. h. KHSO4 und K2S2O7), wobei Chlorwasserstoff als Nebenprodukt gilt.
Das Gas aus den Retorten ist aufgrund der verbesserten Lecksicherheit der Ausrüstung konzentrierter, was aufgrund der niedrigeren Arbeitstemperatur zu geringeren Mengen an Schwefelsäurenebel führt.
3.2.3. Rückgewinnung als Nebenprodukt der Chlorierung
Die Hauptquelle für Chlorwasserstoff und Salzsäure ist das Nebenprodukt von Chlorierungsprozessen. Das Cracken von 1,2-Dichlorethan zur Herstellung von Vinylchlorid ist der Hauptbestandteil der Chlorwasserstoffproduktion.
Die erzeugten und verbrauchten Mengen an Chlorwasserstoff können erheblich sein, wobei viele Anlagen etwa 10.000 m3/h (16 t/h oder 140.000 t/a) oder mehr produzieren.
Daher wird Chlorwasserstoff oft direkt an Chemiefabriken geliefert, die ihn als Rohstoff nutzen. Die Speicherkapazitäten für Chlorwasserstoff sind typischerweise relativ gering. Daher ist es von entscheidender Bedeutung, ein ausgewogenes Verhältnis von Produktion und Verbrauch aufrechtzuerhalten.
Im Falle von Produktionsproblemen oder Marktschwankungen, die ein Werk oder Produkt betreffen, kann das andere Werk nur dann weiterarbeiten, wenn Reserveproduktionskapazitäten vorhanden sind (die in der Regel nicht vollständig ausgelastet sind).
Pufferspeicher für flüssigen Chlorwasserstoff werden eingesetzt, um kurzfristige Ungleichgewichte zwischen Produktion und Verbrauch auszugleichen.
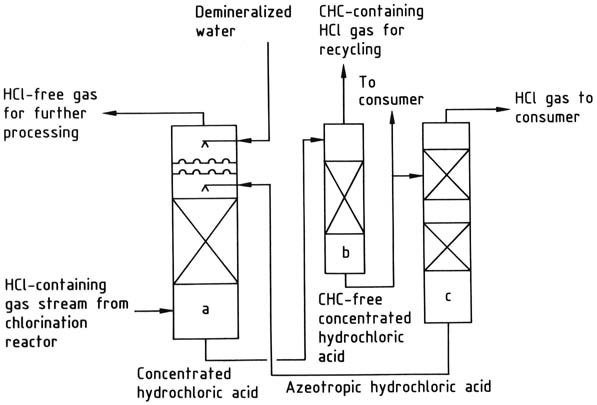
a) Chlorwasserstoff-Absorptionskolonne; b) Strippkolonne für chlorierte Kohlenwasserstoffe; c) Chlorwasserstoff-Desorptionskolonne
Durch organische Chlorierung erzeugter Chlorwasserstoff kann verschiedenen Behandlungsmethoden unterzogen werden:
1. Einfache Kondensation von chlorierten Kohlenwasserstoffen: Dieser Ansatz wird verwendet, wenn das Vorhandensein von restlichen chlorierten Kohlenwasserstoffen oder anderen Nebenprodukten aus dem Chlorierungsprozess keine Probleme für den als Gas zugeführten Chlorwasserstoff darstellt.
Der erzielte Reinigungsgrad hängt vom Kondensationsdruck und der Kondensationstemperatur ab. Beispielsweise wird bei der Chlorierung von Chlormethan zu Dichlormethan der entstehende Chlorwasserstoff ausschließlich zur Umwandlung von Methanol in Chlormethan verwendet, das anschließend zur Herstellung von Dichlormethan verwendet wird.
2. Isolierung und Reinigung von Chlorwasserstoff durch Destillation: Eine fraktionierte Destillation des Flüssiggases kann eingesetzt werden, wenn ein reineres Produkt erforderlich ist. Beispielsweise werden die gasförmigen Produkte, die beim Cracken von 1,2-Dichlorethan entstehen, verflüssigt und dann durch Destillation in Vinylchlorid und Chlorwasserstoff getrennt.
Die Verflüssigung dieser Gase bei extrem niedrigen Temperaturen ist wirtschaftlich nicht praktikabel, daher werden Kondensation und Destillation unter erhöhtem Druck durchgeführt. Ein Vorteil dieser Methode besteht darin, dass Chlorwasserstoffgas bei einem ausreichend hohen Druck (typischerweise 1–2 MPa) für die anschließende Verarbeitung erzeugt wird, wodurch eine zusätzliche mechanische Kompression entfällt.
3. Wässrige Absorption von Chlorwasserstoff: Bei dieser Methode entsteht als Zwischenprodukt Salzsäure, es bestehen jedoch Herausforderungen hinsichtlich der Baumaterialien.
Durch die Einführung von Fluorpolymeren konnten diese Probleme jedoch weitgehend gemildert werden. Dennoch haben viele Anlagen die wässrige Behandlung durch nichtwässrige Methoden wie die fraktionierte Destillation ersetzt.
Chlorwasserstoff kann mit Wasser oder einer 20 Gew.-%igen Salzsäurelösung absorbiert werden. Wasser ist geeignet, wenn das primäre Ziel darin besteht, als Endprodukt 30-35 Gew.-%ige Salzsäure herzustellen.
Wenn der Bedarf an dieser Säure nicht ausreicht, wird das 20 %ige Azeotrop zur Absorption von Chlorwasserstoff genutzt, wodurch die Säure auf eine Konzentration von 30–35 Gew.-% konzentriert wird.
Die konzentrierte Salzsäure wird bei Bedarf gereinigt und anschließend destilliert, um gasförmigen Chlorwasserstoff und azeotrope Salzsäure zu ergeben. Der Chlorwasserstoff wird getrocknet und an den Verbraucher abgegeben, während das Azeotrop in die Absorptionsstufe zurückgeführt wird.
Wenn das Vorhandensein chlorierter Kohlenwasserstoffe in der Salzsäure unerwünscht ist, kann ein Strippschritt zur Entfernung dieser eingesetzt werden.
Um Chlorwasserstoff aus einem Gasstrom zu entfernen, wird eine kleine Menge Wasser in die Absorptionskolonne eingeleitet. Diese Wasserzugabe sorgt dafür, dass der Gasstrom frei von Chlorwasserstoff wird. Allerdings muss eine entsprechende Menge Säure für andere Zwecke abgetrennt werden.
Für die Bewertung der Wirtschaftlichkeit der wässrigen Absorption von Chlorwasserstoff aus einem Produktionsgasstrom sind mehrere Prozess- und Anlagenparameter von entscheidender Bedeutung:
- Die Konzentration von Chlorwasserstoff im Gasstrom bestimmt den Druck und die Temperatur, die in der Absorptionskolonne aufrechterhalten werden.
- Die zur Freisetzung von reinem Chlorwasserstoffgas erforderliche Energie nimmt mit zunehmender Konzentration der gebildeten konzentrierten Säure ab.
- Die Herstellung konzentrierter Salzsäure aus einem Gasstrom mit geringer Chlorwasserstoffkonzentration erfordert einen erheblichen Aufwand. Dies kann eine Erhöhung des Drucks, eine Verringerung der Temperatur oder beides umfassen.
- Das Vorhandensein einer hohen Wasserdampfkonzentration im Produktionsgasstrom kann unter bestimmten Umständen die Produktion von konzentrierter Salzsäure unmöglich machen.
Ein vorgeschlagener Ansatz zur Absorption geringer Mengen Chlorwasserstoff aus Gas mit hohem Wasserdampfgehalt ist die Verwendung einer Magnesiumchloridlösung.
Die Auswahl an Baumaterialien für Chlorwasserstoff-Absorptionsanlagen ist aufgrund des potenziellen Angriffs sowohl durch konzentrierte Salzsäure als auch durch chlorierte Kohlenwasserstoffe begrenzt. Zur Kühlung der Säure werden Graphitwärmetauscher eingesetzt.
Für Pumpen ist traditionell ein spezieller Keramikwerkstoff die wirtschaftlich sinnvolle Wahl. Die Destillationskolonne ist mit säurebeständigen Ziegeln oder Graphitblöcken ausgekleidet, wobei die Ziegel mit Phenolharz verkittet sind.
Um den Säureangriff durch Poren und Risse zu verhindern, wird häufig eine säurebeständige Gummiauskleidung zwischen Stahlgehäuse und Ziegelwand angebracht.
Geräte, die vollständig aus Phenolharz bestehen, weisen eine hervorragende chemische Beständigkeit auf, sind jedoch spröde und mechanisch zerbrechlich und erfordern typischerweise Unterstützung, beispielsweise eine Außenhülle aus glasfaserverstärktem Polyesterharz. Diese Art von Ausrüstung ist für den Betrieb bei atmosphärischem oder etwas höherem Druck geeignet.
Ähnliche Überlegungen gelten für die Strippkolonne für chlorierte Kohlenwasserstoffe. Wenn die Konzentration an chlorierten Kohlenwasserstoffen niedrig ist oder diese effektiv aus der Säure entfernt wurden, können andere Materialien wie Poly(vinylchlorid) für Lagerbehälter verwendet werden.
Aufgrund der hohen Betriebstemperatur besteht die Desorptionskolonne jedoch aus Graphit. Alternativ können gummierte Stützen mit Innenausmauerung eingesetzt werden.
Mit Perfluorpolymer, insbesondere Polytetrafluorethylen (PTFE), ausgekleidete Stahlsäulen haben hervorragende Ergebnisse gezeigt, obwohl Produktunterschiede zwischen verschiedenen Herstellern hinsichtlich Mikroporosität, Reißfestigkeit und Fließeigenschaften bestehen können.
Beschichtete Stahlsäulen bieten Vorteile gegenüber Graphitsäulen, da sie bei erhöhtem Druck betrieben werden können, ein Versagen der PTFE-Auskleidung würde jedoch zu einer schnellen Zerstörung des Stahlgehäuses führen. Diese Säulen können aus kleinen Einzelelementen aufgebaut werden, die schnell ausgetauscht werden können, wodurch Wartungsausfallzeiten minimiert werden.
Wärmetauscher bestehen in allen Fällen aus Graphit. Auch Tantal-Auskleidungen und Verdampfer sind möglich, allerdings müssen Vorkehrungen getroffen werden, um eine Versprödung durch Wasserstoffaufnahme zu vermeiden. Darüber hinaus darf kein Fluorwasserstoff vorhanden sein.
Vollständig trockener Chlorwasserstoff korrodiert weder Stahlrohre noch Kompressoren. Früher wurde zur Trocknung von Chlorwasserstoffgas konzentrierte Schwefelsäure verwendet. Ein anderer Ansatz nutzt die Eigenschaften des HCl-H2O-Systems.
Bei niedrigen Temperaturen ist der Partialdampfdruck von Wasser gegenüber hochkonzentrierter Salzsäure sehr niedrig, sodass Chlorwasserstoff durch Abkühlen auf ausreichend tiefe Temperaturen unter Null getrocknet werden kann.
Bei leicht erhöhtem Druck (p ≈ 0,3 MPa) reicht normalerweise eine Temperatur von -10 °C aus, um zufriedenstellende Ergebnisse zu erzielen. Salzsäurenebel müssen jedoch vollständig entfernt werden, um starke Korrosion zu verhindern.
3.2.4. Rückgewinnung aus der Müllverbrennung
Bei allen Chlorierungsprozessen entstehen neben den gewünschten Produkten zwangsläufig unerwünschte chlorierte Kohlenwasserstoffe. Diese unbrauchbaren und oft gesundheitsschädlichen Stoffe müssen aus Umweltschutzgründen entsorgt werden.
Eine mögliche Methode ist die Verbrennung, bei der die chlorierten Kohlenwasserstoffe in Chlorwasserstoff, Wasser und Kohlendioxid umgewandelt werden. Die Rückgewinnung des Chlorwasserstoffs ist sowohl aus wirtschaftlichen als auch aus ökologischen Gründen von wesentlicher Bedeutung.
Auch wenn die spezifischen eingesetzten Techniken variieren können, bleibt das zugrunde liegende Prinzip dasselbe. Die Verbrennung erfolgt in einem mit feuerfesten Materialien ausgekleideten Ofen bei Temperaturen über 1000 °C.
Chlorierte Kohlenwasserstoffabfälle, die typischerweise bis zu 70 Gew.-% Chlor enthalten, weisen tendenziell gute Verbrennungseigenschaften auf. Bei einer weiteren Erhöhung des Chlorgehalts verringert sich jedoch der Heizwert so stark, dass der Verbrennungsprozess die Zugabe von Heizöl oder Gas zur Unterstützung erfordert.
Optimale Reaktionsbedingungen liegen im folgenden Bereich:
1. Um eine vollständige Zersetzung der Chlorkohlenwasserstoffe zu gewährleisten, muss ein Überschuss an Sauerstoff vorhanden sein. Das entstehende Chlorwasserstoffgas kann dann mit diesem Sauerstoff gemäß der Deacon-Gleichung reagieren:
2 HCl + 0,5 O2 ↔ Cl2 + H2O
Eine Erhöhung der Temperatur verschiebt das Gleichgewicht nach links und begünstigt die Bildung von Chlorwasserstoff. Die Temperatur wird so hoch gehalten, wie es für Baumaterialien zulässig ist, um die Bildung von Chlor zu verhindern.
Auch bei hohem Wasserpartialdruck und geringem Sauerstoffüberschuss ist eine Temperatur über 1000 °C notwendig, um die gewünschte Gleichgewichtsverschiebung zu erreichen. Dieser Ansatz trägt dazu bei, den Chlorgehalt in einem akzeptablen Bereich zu halten und eine vollständige Verbrennung sicherzustellen.
2. Die Reaktionstemperatur sollte 1200 °C nicht überschreiten, um die Bildung von Stickoxiden zu verhindern. Diese Oxide würden das Salzsäureprodukt verunreinigen und eine Herausforderung für die Abgasreinigung darstellen. Die Verwendung von reinem Sauerstoff anstelle von Luft kann eine mögliche Lösung sein.
Aus diesen Gründen erfolgt die Verbrennung von chlorierten Kohlenwasserstoffabfällen typischerweise bei 1000 bis 1200 °C. Die Kühlung der Rauchgase und die Dampferzeugung können Herausforderungen in Bezug auf Baumaterialien mit sich bringen. Es ist darauf zu achten, dass keine korrosiven Verbrennungsprodukte entstehen.
Die behandelten Abfälle sollten eine bekannte Zusammensetzung einschließlich Spurenverunreinigungen aufweisen, um die erwarteten Verbrennungsprodukte, ihre Konzentrationen und ihr Verhalten genau vorhersagen zu können. Eine schnelle Abkühlung wird bevorzugt, um eine Neubildung von Chlor zu verhindern, da eine langsame Abkühlung zu einer Neubildung von Chlor führen kann.
Durch Absorption wird Chlorwasserstoff aus den Verbrennungsgasen zurückgewonnen. Der Rückgewinnungsprozess ähnelt dem bei Chlorierungsprozessen, mit einigen Ausnahmen:
- Ein Trockenprozess ist nicht möglich, da immer Wasserdampf vorhanden ist.
- Die Gase sollten so kondensiert werden, dass eine möglichst konzentrierte Salzsäure entsteht. Dies ermöglicht die Rückgewinnung von gasförmigem Chlorwasserstoff oder konzentrierter Salzsäure. Verdünnte Salzsäure hat einen begrenzten kommerziellen Wert.
- Besondere Korrosionsherausforderungen müssen an potenziellen Säurekondensationspunkten angegangen werden, die möglicherweise nicht regelmäßig auftreten, aber dennoch Risiken darstellen können.
- Bei direkter Nutzung der gasförmigen Verbrennungsprodukte muss die Betriebstemperatur stets oberhalb der Kondensationstemperatur der Salzsäure gehalten werden.
Eine der ältesten Anlagen, die kommerzielle Mengen an 33 Gew.-%iger Salzsäure durch Verbrennung von chlorierten Kohlenwasserstoffen produziert, befindet sich in St. Auban, Frankreich, und wird von Atochem betrieben. Diese 1975 gegründete Anlage verbraucht jährlich etwa 16.000 Tonnen chloriertes Kohlenwasserstoffmaterial.
3.3. Reinigung von Salzsäure
Aktivkohle kann durch Adsorption verschiedene Verunreinigungen im Chlorwasserstoffgas, einschließlich SO2, As und Cl2, wirksam entfernen. Mit abnehmender Bedeutung des Sulfatprozesses gewinnt die Entfernung chlorierter Kohlenwasserstoffe aus Chlorwasserstoffgas oder Salzsäure zunehmend an praktischer Relevanz.
Gasförmiger Chlorwasserstoff kann durch Niedertemperaturwäsche mit einem hochsiedenden Lösungsmittel gereinigt werden, bei dem es sich um einen anderen chlorierten Kohlenwasserstoff (z. B. Hexachlorbutadien oder Tetrachlorethan) oder bestimmte Ölfraktionen handeln kann. Nach einer solchen Behandlung ist der Einsatz von Aktivkohle oft unnötig.
Chlor kann durch den Einsatz von Tetrachlorkohlenstoff eliminiert werden, da es in Tetrachlorkohlenstoff deutlich löslicher ist als Chlorwasserstoffgas.
Salzsäure enthält, unabhängig davon, ob sie direkt oder zur Chlorwasserstofferzeugung verwendet wird, hauptsächlich flüchtige Verunreinigungen wie chlorierte Kohlenwasserstoffe. In solchen Fällen können diese Verunreinigungen durch Strippen aus der Säure entfernt werden.
Das Strippen mit einem Inertgasstrom ist eine praktikable Option, die zu einem geringeren Energieverbrauch führt. In den meisten Fällen wird jedoch aus Umweltgründen das Erhitzen des Gases bevorzugt. Anorganische Verunreinigungen, insbesondere Eisen, können durch Ionenaustausch entfernt werden.
4. Verwendung von Salzsäure
Salzsäure und Chlorwasserstoff sind lebenswichtige Chemikalien in verschiedenen industriellen Prozessen.
Der Großteil des Chlorwasserstoffs wird vom Hersteller in der Regel sofort verwertet, da das Nebenprodukt organischer Chlorierungsverfahren vollständig verwertet werden muss. Dies wird durch Oxychlorierungs- oder Hydrochlorierungstechniken oder in einigen Fällen durch Chlorrückgewinnungsmethoden wie das KEL-Verfahren, das modifizierte Deacon-Verfahren oder die Elektrolyse von Salzsäure erreicht.
Wässrige Salzsäure findet als starke anorganische Säure umfangreiche Anwendungen. Es wird bei der Herstellung von Chloriden, der Auflösung von Mineralien, dem Beizen und Ätzen von Metallen, der Regenerierung von Ionenaustauschharzen zur Wasseraufbereitung, der Neutralisierung alkalischer Produkte oder Abfallstoffe, der Ansäuerung von Sole bei der Chlor-Alkali-Elektrolyse und vielen anderen industriellen Anwendungen eingesetzt Prozesse.
5. Toxikologie und Arbeitsmedizin
Es ist bekannt, dass Chlorwasserstoff, wenn auch in geringerem Ausmaß, schwere Reizungen an Augen, Atemwegen und Haut verursacht. Der Kontakt mit seinen Dämpfen kann zu einer Keratokonjunktivitis führen, und das Einatmen kann zu Reizungen und Schäden an den Schleimhäuten führen. Der Geruch von Chlorwasserstoff ist typischerweise bei Konzentrationen von 1–5 ppm wahrnehmbar und wird bei 5–10 ppm unangenehm.
Eine längere berufsbedingte Exposition gegenüber hohen Konzentrationen von Chlorwasserstoff kann das Risiko für chronische Bronchitis, Magen- und Darmbeschwerden sowie Karies erhöhen, selbst bei scheinbar tolerierbaren Konzentrationen. Konzentrationen über 10 ppm können auch bei Akklimatisierung starke Reizungen hervorrufen.
Personal, das mit Salzsäure arbeitet, sollte geeignete Schutzbrillen, Kleidung, Gummihandschuhe und Stiefel tragen. Das Einatmen des Dampfes sollte vermieden werden und es werden Atemschutzfilter für anorganische Gase empfohlen.
In der Bundesrepublik Deutschland gelten für Chlorwasserstoff und Salzsäure (>10 Gew.-%) Vorschriften zur Überwachung gefährlicher Stoffe gemäß EWG-Richtlinien. Diese Vorschriften legen Gefahrensymbole, Sicherheitshinweise und Vorsichtsmaßnahmen für den Umgang mit diesen Stoffen fest.
Bei Haut- oder Augenkontakt ist eine sofortige und gründliche Spülung mit Wasser unbedingt erforderlich. Kontaminierte Kleidung sollte ebenfalls behandelt werden und es können alkalische Reinigungslösungen verwendet werden.
Beim Arbeiten mit Chlorwasserstoff, insbesondere bei erhöhtem Druck, ist es wichtig, für den Fall eines Unfalls über ein Atemschutzgerät mit unabhängiger Luftversorgung und vollständige Schutzkleidung zu verfügen.
In Deutschland beträgt die maximal zulässige Konzentration (MAK) für Chlorwasserstoff 5 Vol.-ppm, entsprechend 7 mg/m3. Die gleichen Werte gelten in den Vereinigten Staaten als Schwellenwert (TLV). In der Sowjetunion liegt der festgelegte Grenzwert bei 3 ppm (5 mg/m3).
Luftreinhaltevorschriften legen Konzentrationsgrenzwerte für Chlorwasserstoff in der Atmosphäre fest, beispielsweise 0,1 mg/m3 im Jahresdurchschnitt und 0,2 mg/m3 für kurze Zeiträume. Verschiedene Pflanzenarten weisen unterschiedliche Toleranzen gegenüber Chlorwasserstoff auf.
Bei Industrieabgasen sollte die Chlorwasserstoffkonzentration nach deutschen Vorschriften grundsätzlich 30 mg/m3 nicht überschreiten, bei Müllverbrennungsanlagen liegt der Grenzwert bei 50 mg/m3. Die Kosten für die Gasreinigung können daher erheblich variieren.
Für die Entfernung von Chlorwasserstoff ist oft eine Wasserwäsche ausreichend, es können jedoch mehrere Stufen erforderlich sein, einschließlich einer abschließenden Wäsche mit einer alkalischen Lösung.
In einigen Fällen kann keine kommerzielle Salzsäure hergestellt werden und die verdünnte Säure wird vor der Entsorgung im Abwasser neutralisiert. Durch die Neutralisierung mit Natronlauge kann gelegentlich eine Salzlösung entstehen, die rein genug ist, um einer Chloranlage zugeführt zu werden.
Referenz
- Hydrochloric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_283
FAQ: Salzsäure
Salzsäure (HCl) ist eine starke, stark ätzende Säure, die aus Wasserstoff und Chlor besteht. Es ist eine farblose Flüssigkeit mit stechendem Geruch.
Ja, Salzsäure gilt als starke Säure. Es ionisiert vollständig in Wasser und setzt Wasserstoffionen (H+) und Chloridionen (Cl-) frei, um eine saure Lösung zu erzeugen.
Salzsäure wird in Industrie und Labor in verschiedenen Bereichen eingesetzt. Es wird häufig in der chemischen Synthese, der Metallreinigung, der pH-Wert-Regulierung, der Erzverarbeitung und der Herstellung von Düngemitteln, Farbstoffen und Arzneimitteln verwendet. Es wird auch in der Lebensmittelindustrie zur Lebensmittelverarbeitung und in Magensäurepräparaten verwendet.
Salzsäure ist nicht brennbar. Allerdings kann es mit bestimmten Substanzen, wie etwa organischen Materialien oder reaktiven Metallen, reagieren und dabei brennbares Wasserstoffgas freisetzen.
Ja, Salzsäure ist stark ätzend und kann schwere Verätzungen der Haut, Augen und Atemwege verursachen. Das Einatmen oder Verschlucken von konzentrierter Salzsäure kann äußerst gefährlich sein. Es müssen die entsprechenden Sicherheitsvorkehrungen und Handhabungsverfahren befolgt werden.
Salzsäure wird üblicherweise durch Auflösen von Chlorwasserstoffgas in Wasser hergestellt. Bei der industriellen Produktion kommt es häufig zur Reaktion von Chlorgas mit Wasserstoffgas. Aufgrund der Gefährlichkeit der beteiligten Chemikalien sollten diese Prozesse nur in kontrollierten industriellen Umgebungen durchgeführt werden.
Die Stärke von Salzsäure wird typischerweise durch ihre Konzentration ausgedrückt. Übliche Konzentrationen reichen von verdünnt (z. B. 10 % oder weniger) bis konzentriert (z. B. 37 % oder höher). Konzentrierte Salzsäure ist stark ätzend und erfordert besondere Vorsichtsmaßnahmen bei der Handhabung.
Falls eine kleine Menge Salzsäure verschüttet wird, dämmen Sie die verschüttete Flüssigkeit sofort ein und tragen Sie dabei geeignete Schutzausrüstung. Neutralisieren Sie die Säure mit einer geeigneten Base, z. B. Natriumbicarbonat oder Calciumcarbonat, und reinigen Sie den Bereich sorgfältig. Vermeiden Sie dabei den Kontakt mit der Haut oder den Augen. Entsorgen Sie den Abfall gemäß den örtlichen Vorschriften.
Salzsäure ist ein starkes Lösungsmittel und kann viele Metalle, Metalloxide, Carbonate und bestimmte organische Verbindungen lösen. Es ist besonders wirksam beim Lösen von Rost oder Zunder von Metalloberflächen.
Kontakt mit Salzsäure kann zu schweren Verbrennungen und Gewebeschäden der Haut führen. Es ist wichtig, die betroffene Stelle sofort mit reichlich Wasser zu spülen und einen Arzt aufzusuchen.
Salzsäure kann durch Zugabe einer Base wie Natriumbicarbonat (Backpulver) oder Calciumcarbonat (Marmorsplitter) neutralisiert werden. Bei der Neutralisationsreaktion entstehen Wasser und ein Chloridsalz. Die Neutralisierung sollte jedoch nur mit geeigneten Sicherheitsmaßnahmen und unter kontrollierten Bedingungen durchgeführt werden.
Die chemische Formel für Salzsäure lautet HCl, was darauf hinweist, dass sie aus einem Wasserstoffatom und einem Chloratom besteht.
Durch die Reaktion zwischen Ammoniak (NH3) und Salzsäure (HCl) entsteht das Salz Ammoniumchlorid (NH4Cl).
Wenn Magnesiummetall mit Salzsäure reagiert, entsteht Wasserstoffgas (H2) zusammen mit Magnesiumchlorid (MgCl2).
Salzsäure sollte an einem kühlen, gut belüfteten Ort fern von Zündquellen, unverträglichen Substanzen und direkter Sonneneinstrahlung gelagert werden. Es sollte in dicht verschlossenen, ordnungsgemäß gekennzeichneten Behältern aus chemisch beständigen Materialien aufbewahrt werden.
Verschiedene Mineralien können mit Salzsäure reagieren. Karbonate wie Kalkstein (Kalziumkarbonat) beispielsweise sprudeln oder bilden Blasen, wenn sie Salzsäure ausgesetzt werden, da Kohlendioxidgas freigesetzt wird.
Salzsäure ist eine farblose Flüssigkeit. Es hat keine eindeutige Farbe.
