Trichlooraceetaldehyde (Chloraal)
Wat is trichlooraceetaldehyde?
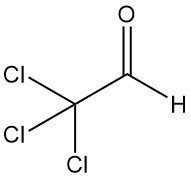
Trichlooraceetaldehyde [75-87-6], ook bekend als chloraal of 2,2,2-trichloorethanal, is een organische verbinding met de formule CCl3CHO. Het is een kleurloze vloeistof die voor het eerst in 1832 werd geproduceerd door Justus von Liebig door chlorering van ethanol.
Chloraal heeft historische betekenis als het eerste hypnotische medicijn, geïntroduceerd in 1869. Bovendien dient het als voorloper van het bekende insecticide DDT (1,1,1-trichloor-2,2-bis(4-chloorfenyl)ethaan), ontdekt in 1941.
Hoewel chloraal een waardevolle chemische stof was in de jaren 60, is het gebruik ervan sindsdien aanzienlijk afgenomen vanwege de beperkingen op DDT en andere gechloreerde insecticiden vanwege zorgen over het milieu.
Inhoudsopgave
1. Fysieke eigenschappen van trichlooraceetaldehyde
Chloraal, ook bekend als trichlooraceetaldehyde of trichloorethanal, vertoont de volgende fysieke eigenschappen:
- Moleculair gewicht: 147,39 g/mol
- Smeltpunt: −56,5 °C
- Kookpunt: 97,8 °C bij 101,3 kPa
- Dichtheid: 1,5121 g/cm³ bij 20 °C
- Breukindex: 1,4557 bij 20 °C
- Dampspanning: 4,7 kPa bij 20 °C
- Uiterlijk: Kleurloze, mobiele, olieachtige vloeistof
- Geur: Doordringend
- Oplosbaarheid: Goed oplosbaar in water, alcohol, ether, en chloroform
- Octanol-water partitiecoëfficiënt: 0,99 (laag)
- Azeotroopvorming: Vormt azeotropen met 1,2-dichloorethaan, heptaan, en benzeen
2. Chemische reacties van trichlooraceetaldehyde
Trichlooraceetaldehyde heeft onderscheidende chemische eigenschappen vergeleken met typische aldehyden, voornamelijk vanwege de sterke elektronenonttrekkende invloed van de drie chlooratomen. Het ontleedt bij blootstelling aan zonlicht of hitte.
Chloraal reageert gemakkelijk met nucleofielen, waarbij verschillende additieproducten worden gevormd. Met alcoholen genereert het isoleerbare hemiacetalen (CCl3CH(OH)OR) en met water vormt het het bekende chloraalhydraat [302-17-0] (CCl3CH(OH)2, smeltpunt 53 °C en kookpunt 97,5 °C).
In tegenstelling tot de meeste aldehyden kan chloraal niet deelnemen aan veel base-gekatalyseerde condensaties. Sterke basen hebben de neiging om hun koolstof-koolstofbinding te verbreken, wat leidt tot producten zoals chloroform en HCO2Na, of HCONR2 (R = alkyl), afhankelijk van het specifieke reagens.
CCl3CHO + NaOH → CHCl3 + HCO2Na
CCl3CHO + R2NH → CHCl3 + HCONR2 (R = alkyl)
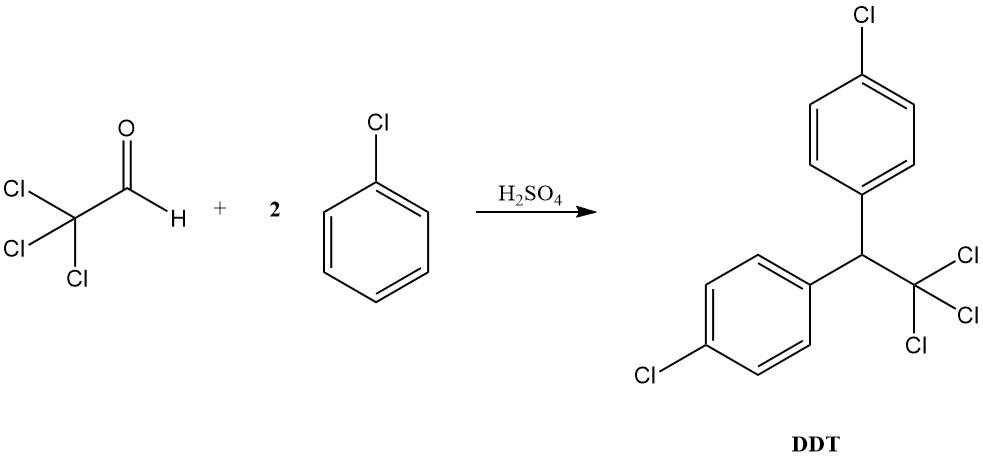
Onder zure omstandigheden gedraagt chloraal zich meer als een typische aldehyde, waarbij acetalen worden gevormd met alcoholen en condenseren met aromatische verbindingen om diaryltrichloorethanen, zoals geïllustreerd door de vorming van DDT uit chloorbenzeen.
In aanwezigheid van anionische initiatoren zoals lithium-tert-butoxide polymeriseert chloraal tot een onoplosbaar, niet-ontvlambaar hoog polymeer met de formule [CH(CCl3)O]n. Dit polymeer heeft echter geen bekende commerciële toepassingen.
Oxidatie van trichlooraceetaldehyde levert trichloorazijnzuur op.
3. Productie van trichlooraceetaldehyde
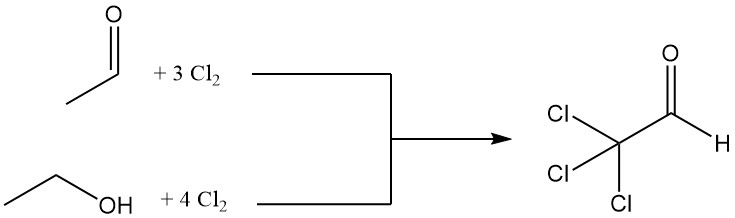
Chloraal wordt geproduceerd door de chlorering van aceetaldehyde of ethanol, waarbij aceetaldehyde vaak de voorkeur krijgt vanwege de economische voordelen.
CH3CHO + 3 Cl2 → CCl3CHO + 3 HCl
Aceetaldehyde reageert met chloor in een zoutzuur-oplossing om condensatiebijproducten en oxidatie van het aldehyde te verminderen. Antimoontrichloride wordt gebruikt als katalysator.
De temperatuur stijgt geleidelijk van 0 °C tot 90 °C om de reactiesnelheid te behouden.
Chloraal wordt uit het mengsel gedestilleerd als hydraat, dat vervolgens wordt ontleed met geconcentreerd zwavelzuur om zich te scheiden van de zwaardere zuurlaag. Het wordt vervolgens gedestilleerd door een fractioneringskolom.
Voor de chlorering van één mol ethanol zijn vier mol chloor nodig, waarbij één mol wordt gebruikt voor oxidatie tot aceetaldehyde.
CH3CH2OH + Cl2 → CH3CHO + 2 HCl
Reactievaten en leidingen zijn bekleed met zuurbestendige materialen (keramiek, enz.) om bestand te zijn tegen heet zoutzuur. Kleppen zijn gemaakt van nikkel-molybdeenlegeringen (Hastelloy B) voor corrosiebestendigheid.
De zuiverheid van chloor van technische kwaliteit varieert van 94% tot 99%, met water als belangrijkste onzuiverheid.
4. Toepassingen van trichlooracaetaldehyde
Chloraal werd aanvankelijk gebruikt bij de productie van het insecticide DDT, maar de toepassingen ervan reiken veel verder. Hoewel DDT in veel landen verboden is, wordt chloraal gebruikt bij de productie van verschillende andere insecticiden, zoals methoxychloor en naled, en herbiciden (trichloorazijnzuur).
Het wordt ook gebruikt bij de productie van hard polyurethaanschuim.
Trichlooraceetaldehyde kan zetmeelkorrels bij kamertemperatuur laten opzwellen, wat mogelijk gevolgen heeft voor verschillende zetmeelindustrieën.
Chloraalhydraat, de hydraatvorm van chloraal, werd in de geneeskunde gebruikt als een kalmerend en hypnotiserend middel (chloraalbetaïne, α-chloraalose en triclofosnatrium). Hoewel het voornamelijk werd gebruikt voor de behandeling van kortdurende slapeloosheid, is het ook gebruikt om angst te beheersen, sedatie te induceren voor procedures en ontwenningsverschijnselen van alcohol en andere drugs te behandelen.
Het gebruik ervan bij kinderen is afgenomen ten gunste van veiligere alternatieven, maar het vindt nog steeds toepassing in bepaalde medische situaties.
In de microscopie wordt de oplossing van Hoyer, die chloraalhydraat bevat, gebruikt om verschillende organismen zoals bryofyten, varens, zaden en geleedpotigen te monteren voor gedetailleerde observatie.
5. Toxicologie van chloraal
Blootstellingssymptomen:
- Chloraal en zijn hydraat vertonen identieke eigenschappen en werken als depressiva voor het centrale zenuwstelsel.
- Therapeutische doses (0,5–1,0 g) hebben minimaal effect op de ademhaling en de bloeddruk, maar hogere doses onderdrukken beide.
- Synergistische effecten treden op met ethanol, wat de werking van chloraal versterkt.
- Irritatie van de huid en slijmvliezen is een bekende bijwerking.
- Metabolisme zet chloraal om in trichloorethanol, de belangrijkste bijdrager aan de fysiologische effecten.
- Uitscheiding vindt voornamelijk plaats via conjugatie van glucuronide in de urine.
Toxiciteit:
- Orale inname van 4–30 g is dodelijk gebleken bij volwassenen.
- Inhalatiestudies bij ratten tonen een hoge toxiciteit aan, met een LC50 van 440 mg/m³ voor blootstelling gedurende 4 uur.
- Chronische blootstelling bij lagere concentraties (75–78 mg/m³) veroorzaakt ernstige longbeschadiging en sterfte bij ratten.
- Mutageniciteit is waargenomen in de Ames-test.
- Er zijn geen vastgestelde drempelwaarden (TLV) of maximaal toegestane concentraties (MAK) voor chloraal, wat aanleiding geeft tot voorzichtige behandeling, vergelijkbaar met chlooraceetaldehyde.
Carcinogeniciteit:
- Het Internationaal Agentschap voor Kankeronderzoek (IARC) classificeert chloraal en chloraalhydraat als Groep 3: “niet classificeerbaar wat betreft kankerverwekkendheid voor mensen”.
- Hoewel beperkt bewijsmateriaal in dierstudies wijst op kankerverwekkendheid, blijven gegevens over mensen ontoereikend.
EU-classificatie:
- Op basis van Richtlijn 67/548/EEG worden chloraal en chloraalhydraat aangemerkt als “Toxisch” (T) met risicozinnen R25-36/38, wat duidt op toxiciteit bij inname en huid-/oogirritatie.
Referentie
- Chloroaceetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
