Nitrilotriazijnzuur: eigenschappen, productie, toepassingen en toxicologie
Wat is Nitrilotriazijnzuur?
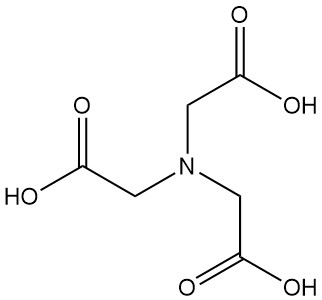
Nitrilotriazijnzuur, ook bekend als NTA of N,N-bis(carboxymethyl)glycine, is een tricarbonzuur met de formule C6H9NO6. Het is een kleurloze vaste stof die behoort tot de familie van aminopolycarbonzuren en is een van de belangrijkste chelerende middelen, samen met EDTA.
Het werd voor het eerst gesynthetiseerd in 1861 door Heintz door ammoniak te laten reageren met chloorazijnzuur. De grootschalige industriële productie begon in Ludwigshafen in 1936. Sindsdien heeft nitrilotriazijnzuur zich gevestigd als een chelerende middel dat wordt gebruikt in verschillende industriële processen.
Inhoudsopgave
1. Fysieke eigenschappen van nitrilotriazijnzuur
Nitrilotriazijnzuur is een trizuur dat kleurloze, naaldachtige kristallen vormt wanneer het wordt gekristalliseerd uit een waterige oplossing. Het is onoplosbaar in water en de meeste organische oplosmiddelen; alkalimetaalnitrilotriacetaten hebben echter een hoge oplosbaarheid in water. Trinatriumnitrilotriacetaat lost bijvoorbeeld tot 640 g/l op in water.
De belangrijkste fysische eigenschappen van nitrilotriazijnzuur worden in de volgende tabel weergegeven.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [139-13-9] |
| Chemische formule | C6H9NO6 |
| Moleculaire massa | 191,14 g/mol |
| Smeltpunt | 242 °C (ontleding) |
| Water oplosbaarheid | 0,13 g/100 g bij 5 °C 0,13 g/100 g bij 22,5 °C 0,95 g/100 g bij 80 °C 3,3 g/100 g bij 100 °C |
| pH van verzadigde oplossing | 2,3 |
| pK1 bij 25 °C | 1,80 |
| pK2 bij 25 °C | 2,48 |
| pK3 bij 25 °C | 9,65 |
2. Chemische eigenschappen van nitrilotriazijnzuur
Nitrilotriazijnzuur (NTA) wordt voornamelijk gekenmerkt door de vorming van in water oplosbare chelaten met multivalente metaalkationen. Zowel carboxylgroepen als tertiaire stikstof fungeren als ligandplaatsen. Onbezette metaalioncoördinatieposities kunnen worden ingenomen door watermoleculen.
Hoewel octaëdrische geometrie (coördinatiegetal 6) vaak metaal-NTA-chelaten vertegenwoordigt, geven recente structurele studies door röntgendiffractie aan dat er potentieel is voor hogere coördinatiegetallen in bepaalde metaalcomplexen. Bijvoorbeeld, Ca2+ in CaNTA–-complex vertoont een coördinatiegetal van 7.
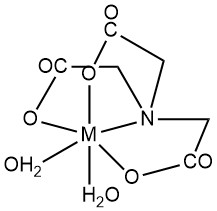
Over het algemeen vormen metaalcomplexen zich in een 1:1 metaal-tot-NTA molaire verhouding, en overtollig NTA kan leiden tot 1:2 complexen. Stabiliteitsconstanten (K1 voor 1:1, K2 voor 1:2) kwantificeren de stabiliteit van het complex. De polarisatie van de H-O-binding in het chelaat geeft een zwak zure eigenschap aan 1:1 complexen, gekarakteriseerd door de dissociatieconstante Kd.
K1 = [MNTA]/[M][NTA]
K2 = [MNTA2]/[M][NTA]2
Kd = [MNTAOH][H+]/[MNTA]
Waar M het multivalente metaalion is, vertegenwoordigt NTA het anion N(CH2COO–)3.
Tabel 2 geeft een aantal stabiliteitsconstanten voor NTA-chelaten.
| Metaalion | log K1 | log K2 | pKd |
|---|---|---|---|
| Al3+ | 11,4 | - | 5,09 |
| Ca2+ | 6,39 | 8,76 | - |
| Cd2+ | 9,78 | 14,39 | 11,25 |
| Co2+ | 10,38 | 14,33 | 10,80 |
| Cu2+ | 12,94 | 17,42 | 9,14 |
| Fe2+ | 8,33 | 12,80 | 10,60 |
| Fe3+ | 15,90 | 24,30 | 4,1-7,8 |
| Hg2+ | 14,60 | - | - |
| Mg2+ | 5,47 | - | - |
| Mn2+ | 7,46 | 10,94 | - |
| Ni2+ | 11,50 | 16,32 | 10,86 |
| Pb2+ | 11,34 | - | - |
| Zn2+ | 10,66 | 14.24 | 10.06 |
De complexvorming van metaal-nitrilotriazijnzuur concurreert met andere reacties. Metaalkationen kunnen spaarzaam oplosbare precipitaten vormen met anionen zoals carbonaat, sulfide, sulfaat of oxalaat. Bovendien concurreren waterstofionen met metaalkationen om nitrilotriazijnzuur-trianionbindingsplaatsen. Bijgevolg controleren meerdere evenwichten nitrilotriazijnzuursystemen.
Nitrilotriaacetaatchelaten zijn stabiel in een breed pH-bereik dat afhankelijk is van de chelaatconcentratie en de overtollige complexvormer; bijvoorbeeld Ca2+ (pH 9–12), Mg2+ (pH 7–10), Cu2+ (pH 3–12) en Fe2+ (pH 1,5–3).
3. Productie van Nitrilotriazijnzuur
De historische productie van nitrilotriazijnzuur uit ammoniak en chloorazijnzuur wordt niet meer gebruikt. De oxidatie van triethanolamine is niet van industriële relevantie.
Tegenwoordig wordt nitrilotriazijnzuur geproduceerd door een-fase alkalische of twee-fase zure cyanomethyleringsprocessen met behulp van ammoniak (of ammoniumsulfaat), formaldehyde en natriumcyanide (of waterstofcyanide).
3.1. Productie van Nitrilotriazijnzuur door het alkalische proces
Het alkalische proces is een lang gevestigd proces waarbij trinatriumnitrilotriazijnzuur wordt geproduceerd door de reactie van ammoniak, formaldehyde en natriumcyanide. De hydrolyse van het nitrilotriazijnzuur levert nitrilotriazijnzuurzout op.
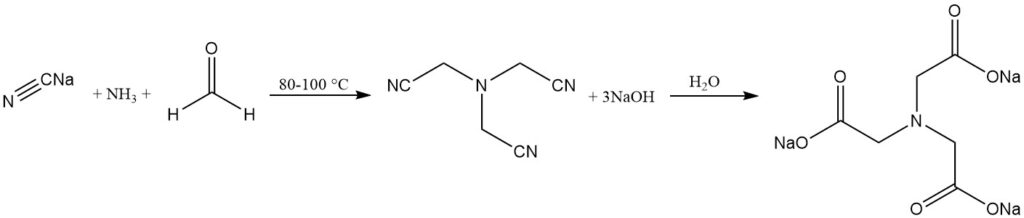
NH3 + 3 HCHO + 3 NaCN → N(CH2CN)3 + 3 NaOH
N(CH2CN)3 + 3 NaOH + 3 H2O → N(CH2COONa)3 + 3 NH3
Dit proces kan batchgewijs of continu worden uitgevoerd en vindt plaats bij 80–100 °C. Bij een hoge pH (ca. 14) wordt triscyanomethylamine in situ gehydrolyseerd tot trinatriumnitrilotriacetaat.
In een industrieel continu proces wordt waterige oplossing natriumcyanide samen met formaldehydeoplossing in een cascadereactorsysteem gevoerd. Deze methode genereert drie keer zoveel ammoniak, dat beperkt moet worden om de productie van bijproducten met lage carboxymethyleringsgraden, zoals glycine en iminodiazijnzuur, te voorkomen.
De eliminatie van overtollige ammoniak tijdens het proces wordt uitgevoerd door de ammoniak continu te destilleren met stoom of lucht gedurende het hele proces; de vorming van kleine hoeveelheden ongewenste producten zoals glycolzuur en andere eerder genoemde is echter onvermijdelijk.
De uiteindelijke oplossing wordt verkocht als een 40% oplossing, omgezet in poeder of aangezuurd om nitrilotriazijnzuur te vormen.
3.2. Productie van Nitrilotriazijnzuur door het zuurproces
Om de vorming van bijproducten in het alkalische proces te beperken, hebben sommige producenten fabrieken gebouwd op basis van het zuurproces; deze methode vereist echter strenge veiligheidsprotocollen vanwege het gebruik van waterstofcyanide en er is ook het corrosieprobleem.
Ten eerste produceren ammoniak en formaldehyde hexamethyleentetramine, dat vervolgens reageert met waterstofcyanide in zwavelzuur om triscyanomethylamine te vormen.
De vaste triscyanomethylamine is onoplosbaar in het reactiemedium, dus wordt het afgefilterd, gewassen en vervolgens verzeept met natriumhydroxide om een oplossing van trinatriumnitrilotriacetaat te verkrijgen met minimale bijproducten.
Deze oplossing wordt ook verkocht als een 40% product of gebruikt bij de productie van poeder of vast nitrilotriazijnzuur.
Commercieel nitrilotriazijnzuur wordt verkocht onder verschillende merknamen, waaronder Dissolvine A-klassen (Akzo), Masquol NTA-klassen (Protex), Rexene NTA-klassen (Akzo), Trilon A-klassen (BASF) en Versene NTA-klassen (Dow).
4. Toepassingen van Nitrilotriazijnzuur
Het primaire gebruik van nitrilotriazijnzuur en zijn zouten is gebaseerd op hun vermogen om complexen te vormen met metaalionen. Deze complexeringseigenschappen worden in diverse velden gebruikt om storende metaalionen te isoleren, precipitaten op te lossen, redoxpotentialen van metaalionen te moduleren of metaalionbuffers te creëren.
4.1. Toepassingen van Nitrilotriazijnzuur bij waterontharding
Nitrilotriazijnzuur verzacht water effectief door calcium- (Ca2+) en magnesium- (Mg2+) ionen te complexeren binnen een neutraal tot alkalisch pH-bereik. De vereiste hoeveelheid nitrilotriazijnzuur of trinatriumnitrilotriazijnzuur voor waterontharding varieert op basis van de waterhardheid.
Industrieën zoals papier, textiel, zeep, cosmetica, detergenten, ketelvoedingswaterbehandeling en chemische verwerking (bijv. fotografie, galvaniseren) gebruiken nitrilotriazijnzuur voor waterontharding.
4.2. Toepassingen van nitrilotriazijnzuur als fosfaatvervanger in detergenten
Trinatriumnitrilotriacetaat wordt gebruikt als vervanger voor pentanatriumtrifosfaat in detergenten met een laag fosfaatgehalte of zonder fosfaat, vaak in combinatie met zeolieten of polycarboxylaten.
In tegenstelling tot pentanatriumtrifosfaat is trinatriumnitrilotriacetaat bestand tegen hydrolyse en blijft het volledig effectief na sproeidrogen en tijdens het wassen. Hoewel de equivalentieverhouding van trinatriumnitrilotriacetaat tot pentanatriumtrifosfaat ongeveer 0,6 tot 1 is, tast het de primaire of secundaire reinigingskracht niet aan.
4.3. Toepassingen van Nitrilotriazijnzuur als Tetrakaliumdifosfaatvervanger in reinigingsmiddelen
Trinatriumnitrilotriazijnzuur vervangt tetrakaliumdifosfaat in reinigingsmiddelen met een gunstige 1:3 equivalentieverhouding, waardoor hydrotropen of oplosmiddelen vaak overbodig zijn. Synergetische buildereffecten treden op bij gedeeltelijke fosfaatsubstitutie.
4.4. Toepassingen van Nitrilotriazijnzuur bij het maskeren van zware metaalionen
Hoewel minder effectief dan EDTA, wordt Nitrilotriazijnzuur gebruikt om zware metaalionen zoals Fe3+, Cu2+ en Mn2+ te maskeren. Industrieën zoals zeepproductie, textielbleken, oppervlaktereiniging en verschillende chemische processen gebruiken het voor dit doel.
4.5. Gespecialiseerde toepassingen
Nitrilotriazijnzuur wordt ook gebruikt in gespecialiseerde toepassingen zoals scheiding van zeldzame aardmetalen, complexometrische titraties en formulering van landbouwmicronutriënten.
5. Toxicologie van nitrilotriazijnzuur
Nitrilotriazijnzuur is zeer biologisch afbreekbaar en mineraliseert gemakkelijk in anorganische eindproducten zonder persistente organische metabolieten.
Milieustudies, met name na de introductie van detergenten die nitrilotriazijnzuur bevatten, bevestigen de snelle biologische afbraak ervan in afvalwaterzuiveringsinstallaties (>98%) en oppervlaktewateren (halfwaardetijd < 1 dag). Na beperkte infiltratie zijn er minimale sporen nitrilotriazijnzuur in het grondwater te vinden.
Hoewel het complexvormende vermogen van nitrilotriazijnzuur mogelijk zware metalen kan mobiliseren, minimaliseert de snelle biologische afbraak dit risico. Studies naar afvalwaterzuiveringsinstallaties en riviersedimenten geven aan dat er onder realistische omstandigheden nauwelijks zware metalen worden gemobiliseerd.
Nitrilotriazijnzuur vertoont een lage acute toxiciteit voor waterorganismen, met LC50-waarden variërend van ongeveer 100 tot meer dan 10.000 mg/l, beïnvloed door de waterhardheid. Chronische toxiciteitsstudies naar verschillende organismen laten geen nadelige effecten zien onder 1 mg/l, met significante toxiciteitsdrempels bij veel hogere concentraties.
De acute toxiciteit bij zoogdieren verschilt per soort. De orale LD50-waarde voor trinatriumnitrilotriacetaat bij knaagdieren is ongeveer 2000 mg/kg; deze dosis veroorzaakt braken bij honden en apen.
Inhalatiestudies en huid-/oog-/luchtwegirritatietests tonen minimale effecten, zonder sensibilisatie- of allergie-indicaties. Nitrilotriazijnzuur heeft geen teratogene effecten, alleen of in combinatie met zware metalen zoals cadmium en kwik. Bovendien leveren mutageniteitstesten negatieve resultaten op.
Zoogdieren metaboliseren nitrilotriazijnzuur niet; in plaats daarvan scheiden de nieren het onveranderd uit. Niertubuli en uretercellen accumuleren hogere concentraties nitrilotriazijnzuur.
Subchronische en chronische studies koppelen nitrilotriazijnzuur aan niertoxiciteit als gevolg van verstoringen in het elektrolyt- en ijzermetabolisme. Hoge doses kunnen nier-, ureter- en blaasepitheelcellen beschadigen, wat mogelijk leidt tot de vorming van tumoren.
Er bestaat echter een significante drempelwaarde onder tumorontwikkeling, die de no-adverse effect level (NOEL) van 14 mg/kg lichaamsgewicht per dag ver overschrijdt.
Referentie
- Nitrilotriacetic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_377.pub3
