Methanol: eigenschappen, productie, reacties en toepassingen
Wat is methanol?
Methanol, ook bekend als houtalcohol, is een chemische verbinding met de formule CH3OH. Het is een kleurloze, ontvlambare vloeistof met een kenmerkende alcoholische geur. Methanol is de eenvoudigste alcohol en het is de belangrijkste alcohol in de industrie.
Methanol is een belangrijke chemische grondstof die wordt gebruikt bij de productie van een breed scala aan producten, waaronder kunststoffen, verf en farmaceutische producten. Het wordt ook gebruikt als brandstof en energiebron.
Methanol werd voor het eerst geïsoleerd in de 17e eeuw, maar pas begin 20e eeuw werd het op commerciële schaal geproduceerd. Tegenwoordig wordt methanol geproduceerd met behulp van verschillende processen, maar de meest voorkomende methode is het laten reageren van koolmonoxide en waterstof in de aanwezigheid van een koperoxidekatalysator.
Methanol is een zeer veelzijdig molecuul en kan worden omgezet in een breed scala aan andere chemicaliën via verschillende chemische reacties. Methanol kan bijvoorbeeld worden gebruikt om formaldehyde, azijnzuur en methylmethacrylaat te produceren.
Methanol wordt ook gebruikt als brandstof en energiebron. Het kan worden gemengd met benzine om emissies te verminderen en het kan ook worden gebruikt in brandstofcellen om elektriciteit op te wekken.
Inhoudsopgave
1. Fysieke eigenschappen van methanol
Methanol is een kleurloze vloeistof met een hoge polariteit en gemiddelde dampspanning. Het is een veelzijdig oplosmiddel dat een breed scala aan stoffen kan oplossen, waaronder water, alcoholen en andere organische oplosmiddelen. Het is in beperkte mate mengbaar met oliën en vetten.
Methanol heeft de fysieke eigenschappen die in de volgende tabel worden weergegeven:
| Eigenschap | Waarde |
|---|---|
| Fysieke toestand | Vloeibaar |
| Kleur | Kleurloos |
| Geur | Licht zoet, alcoholisch |
| Smeltpunt | −97,6 °C (−143,7 °F; 175,6 K) |
| Kookpunt | 64,7 °C (148,5 °F; 337,8 K) |
| Dichtheid | 0,792 g/cm³ |
| Oplosbaarheid in water | Mengbaar |
| Dampspanning | 160 mmHg bij 20 °C (68 °F) |
| Vlampunt | 11 °C (52 °F) |
| Ontvlambaarheidsgrenzen | 6,7–36% per volume in lucht |
| Zelfontbrandingstemperatuur | 455 °C (851 °F) |
2. Chemische reacties van methanol
Methanol is de eenvoudigste alcohol en de reactiviteit ervan wordt bepaald door de hydroxylgroep. Methanol reageert door de C-O- of O-H-binding te splitsen en de waterstof- of hydroxylgroep kan worden gesubstitueerd. In tegenstelling tot hogere alcoholen kan methanol geen β-eliminatie ondergaan om een meervoudige binding te vormen.
Belangrijke industriële reacties van methanol zijn:
- Dehydrogenering en oxidatieve dehydrogenering
- Carbonylering
- Verestering met organische of anorganische zuren en zuurderivaten
- Verethering
- Additie aan onverzadigde bindingen
- Vervanging van hydroxylgroepen
1. Methanolverbranding: Methanol kan verbranden, een chemische reactie waarbij methanol wordt gecombineerd met zuurstofgas om koolstofdioxide, water en energie te produceren.
2 CH3OH + 3 O2 → 2 CO2 + 4 H2O + energie
Deze reactie is exotherm en produceert veel warmte, waardoor methanol een bruikbare brandstof is.
2. Verestering: Methanol kan reageren met carbonzuren om esters te produceren, organische verbindingen met een karakteristieke zoete geur. Deze reactie wordt gekatalyseerd door een zure katalysator, zoals zwavelzuur of zoutzuur.
RCOOH + CH3OH → RCOOCH3 + H2O
3. Dehydratie: Methanol kan dehydratie ondergaan, een chemische reactie waarbij watermoleculen uit methanol worden verwijderd om dimethylether (DME) te produceren. Deze reactie wordt gekatalyseerd door een zure katalysator, zoals aluminiumoxide of zeoliet.
2 CH3OH → CH3OCH3 + H2O
4. Oxidatie: Methanol kan worden geoxideerd om formaldehyde (HCHO) te produceren, een nuttige tussenverbinding bij de productie van verschillende chemicaliën.
2 CH3OH + O2 → 2 HCHO + 2 H2O
Deze reactie wordt doorgaans gekatalyseerd door een metaalkatalysator, zoals koper of zilver.
5. Methylering: Methanol kan worden gebruikt als bron van methylgroepen (-CH3) in verschillende chemische reacties, zoals de methylering van fenolen om methylfenolen te produceren.
C6H5OH + CH3OH → C6H4(OCH3)OH + H2O
3. Productie van methanol
Methanol wordt momenteel op industriële schaal geproduceerd met behulp van een lagedrukkatalytische conversie van synthesegas. Dit proces heeft lagere investerings- en productiekosten, verbeterde operationele betrouwbaarheid en grotere flexibiliteit dan andere methoden.
De productie van methanol kan worden onderverdeeld in drie hoofdstappen:
- Productie van synthesegas
- Synthese van methanol
- Verwerking van ruwe methanol
3.1. Productie van synthesegas
Synthesegas kan worden geproduceerd uit verschillende koolstofhoudende materialen, waaronder steenkool, cokes, aardgas, aardolie en aardoliefracties. Aardgas is de meest voorkomende grondstof voor grootschalige synthesegasproductie voor methanolsynthese.
De samenstelling van het synthesegas dat nodig is voor methanolsynthese wordt gekenmerkt door het stoichiometrische getal S, dat als volgt wordt gedefinieerd:
S = (H2 – CO2)/(CO + CO2)
Het stoichiometrische getal moet ten minste 2,0 zijn voor het synthesegasmengsel. Waarden boven 2,0 duiden op een overmaat aan waterstof, terwijl waarden onder 2,0 duiden op een waterstoftekort.
Een tekort aan waterstof vermindert de selectiviteit voor methanol, terwijl een overmaat aan waterstof de omvang van de syntheselus vergroot. Daarom is een synthesegassamenstelling met een stoichiometrisch getal iets boven 2,0 optimaal voor methanolsynthese.
3.1.1. Synthesegas uit aardgas
De meeste methanol die wereldwijd wordt geproduceerd, is afkomstig van aardgas, dat kan worden gekraakt door stoomreforming, autothermische reforming, een combinatie daarvan of door gedeeltelijke oxidatie.
Stoomreforming
Bij stoomreforming wordt de aardgasgrondstof katalytisch gekraakt in afwezigheid van zuurstof met toevoeging van stoom en mogelijk koolstofdioxide. Dit levert een synthesegas op met een stoichiometrisch getal van ruim boven 2,0.
Het stoichiometrische getal kan worden aangepast naar de gewenste waarde van iets boven 2,0 door CO2 toe te voegen, hetzij stroomopwaarts of stroomafwaarts van de stoomreformer. De warmte die nodig is voor de reactie wordt extern geleverd.
Autothermische reforming
Bij autothermische reforming wordt de aardgasgrondstof omgezet door gedeeltelijke oxidatie met zuurstof en reactie op een op Ni gebaseerde katalysator. De warmte voor de reactie wordt geleverd door de exotherme gedeeltelijke oxidatiereactie. Het verkregen synthesegas wordt gekenmerkt door een tekort aan waterstof, dus waterstof moet worden toegevoegd voordat het naar de methanolsyntheselus wordt geleid.
Combinatie van stoom en autothermische reforming
In een combinatie van de twee processen wordt slechts een deel van de aardgasstroom onderworpen aan stoomreforming. De rest wordt samen met het stoomgereformeerde gas naar een autothermische reformer (ATR) gevoerd die is gevuld met een op Ni gebaseerde katalysator.
In de ATR wordt het aardgas gedeeltelijk geoxideerd met zuurstof. Het stoichiometrische getal van het synthesegas kan worden aangepast tot iets boven 2,0 door de splitsing tussen stoom en autothermische reforming aan te passen en de juiste procesparameters te selecteren.
Gedeeltelijke oxidatie
Bij gedeeltelijke oxidatie wordt de aardgasgrondstof gekraakt zonder katalysator door directe oxidatie met zuurstof. Dit genereert warmte voor de reactie.
3.1.2. Synthesegas uit andere grondstoffen
Koolwaterstoffen
Hogere koolwaterstoffen, zoals vloeibaar petroleumgas, raffinaderij-afgassen en nafta, kunnen ook worden gebruikt als grondstoffen voor de productie van synthesegas voor methanolfabrieken. Ze worden voornamelijk verwerkt door stoomreforming.
Ruwe olie, zware olie, teer en asfalt
Ruwe olie, zware olie, teer en asfaltproducten kunnen ook worden omgezet in synthesegas, maar dit is moeilijker dan bij aardgas. Hun zwavelgehalte is aanzienlijk hoger (0,7-1,5% H2S en COS) en moet worden verlaagd.
Het geproduceerde synthesegas bevat ook overtollig koolmonoxide en moet daarom worden onderworpen aan shiftconversie met water. Het resulterende overtollige kooldioxide wordt uit het gas verwijderd. Gasreiniging en verwijdering van kooldioxide kunnen bijvoorbeeld worden bereikt binnen een Rectisol-proces.
Steenkool
Steenkool kan worden omgezet in synthesegas met stoom en zuurstof door verschillende processen bij verschillende druk (0,5-8 MPa) en temperaturen (400-1500 °C). Het op steenkool gebaseerde synthesegas moet worden ontzwaveld en onderworpen aan shiftconversie om de vereiste stoichiometrie te verkrijgen.
3.2. Synthese van methanol
Methanol wordt gesynthetiseerd uit synthesegas in een reactor bij 200-300 °C en 5-10 MPa. De reactie is exotherm, dus warmte moet worden verwijderd om te voorkomen dat de reactor oververhit raakt.
Het gas dat de reactor verlaat, wordt gekoeld en de methanol wordt gecondenseerd. Het resterende gas wordt teruggevoerd naar de reactor, samen met vers synthesegas. Dit is nodig omdat slechts 50-80% van het synthesegas in één keer wordt omgezet in methanol.
De ruwe methanol wordt vervolgens gezuiverd en gedestilleerd. Het purgegas uit de recyclelus wordt gebruikt om de reformer te verwarmen.
Technologische ontwikkeling
Tot 1997 was het belangrijkste verschil tussen industriële lagedruk-methanolprocessen het reactorontwerp. De maximale capaciteit van methanolfabrieken was 2.500 tot 3.000 t/d.
In 1997 introduceerde Lurgi het MegaMethanol-proces, dat verschillende reactortypen combineert met een grootschalige synthesegasproductiefabriek. Dit maakte de weg vrij voor methanolfabrieken met capaciteiten tot 10.000 t/d per trein.
Tegenwoordig zijn er verschillende technologieën voor methanolsynthese beschikbaar, elk met zijn eigen voor- en nadelen. De belangrijkste technologieleveranciers zijn Lurgi, JM/Davy, Topsøe, MGC, JM/Uhde, JM/Jacobs, JM/Others en JM/Toyo.
Al deze technologieën zijn gebaseerd op zeer geïntegreerde concepten die alle stappen omvatten van vergassing en gasreiniging tot synthese en opwerking. Dit zorgt voor een hoge energie- en koolstofefficiëntie van respectievelijk 67% en 83%.
3.2.1. Reactorontwerp
Methanol wordt al sinds de jaren 60 op industriële schaal geproduceerd en er zijn nog steeds verschillende basisreactorontwerpen in gebruik. Het beste ontwerp voor een bepaalde fabriek hangt af van de specifieke vereisten, zoals de koolstofbron, beschikbaarheid van nutsvoorzieningen en warmte-integratie.
Adiabatische reactoren
Adiabatische reactoren onttrekken geen warmte tijdens de reactie, dus de temperatuur neemt geleidelijk toe langs de as van de reactor. Dit kan worden verzacht door de reactie op verschillende punten te blussen met koud gas, of door een reeks reactorbedden met tussenkoelers te gebruiken.
Quasi-isotherme reactoren
Quasi-isotherme reactoren handhaven een relatief constante temperatuur in de hele reactor. Dit wordt meestal gedaan door een buisreactor te gebruiken met koeling door kokend water. Er zijn ook gasgekoelde reactoren, waarin de warmte van de reactie wordt overgedragen aan het reactiegas.
Specifieke reactorontwerpen
Enkele specifieke methanolreactorontwerpen omvatten:
- Standaard quasi-isotherme reactor: Deze reactor gebruikt een buisreactor met koeling door kokend water.
- Variobarreactor: Deze reactor gebruikt een mantel-en-buisreactor die in verschillende lagen is opgerold, met koelbuizen ingebed in de katalysatorpakking.
- Gasgekoelde reactor: Deze reactor heeft een katalysatorbed aan de mantelzijde en het synthesegas stroomt door het katalysatorbed in een axiale, radiale of axiaal-radiale richting.
- Superconverter: Deze reactor gebruikt dubbelwandige buizen gevuld met katalysator in de ringvormige ruimte. Het synthesegas stroomt eerst door de binnenbuis om het op te warmen en vervolgens in de omgekeerde richting door het katalysatorbed om de reactiewarmte vrij te geven.
3.2.2. Grootschalige ontwerpen voor methanolsyntheselussen
Methanol is een goede energiedrager voor afgelegen gebieden omdat het gemakkelijk kan worden getransporteerd. Om echter economisch te zijn, moeten methanolproductiefabrieken grootschalig zijn. Dit betekent dat de conversiesnelheid van synthesegas naar methanol hoog moet zijn, zodat de hoeveelheid gas die door de lus stroomt, wordt geminimaliseerd.
Eén ontwerp voor een methanolsynthesefabriek met hoge conversie is de Lurgi Combined Converter Methanol Synthesis (Figuur 1). Dit proces maakt gebruik van twee reactoren parallel: een quasi-isotherme kokendwaterreactor en een gasgekoelde reactor.
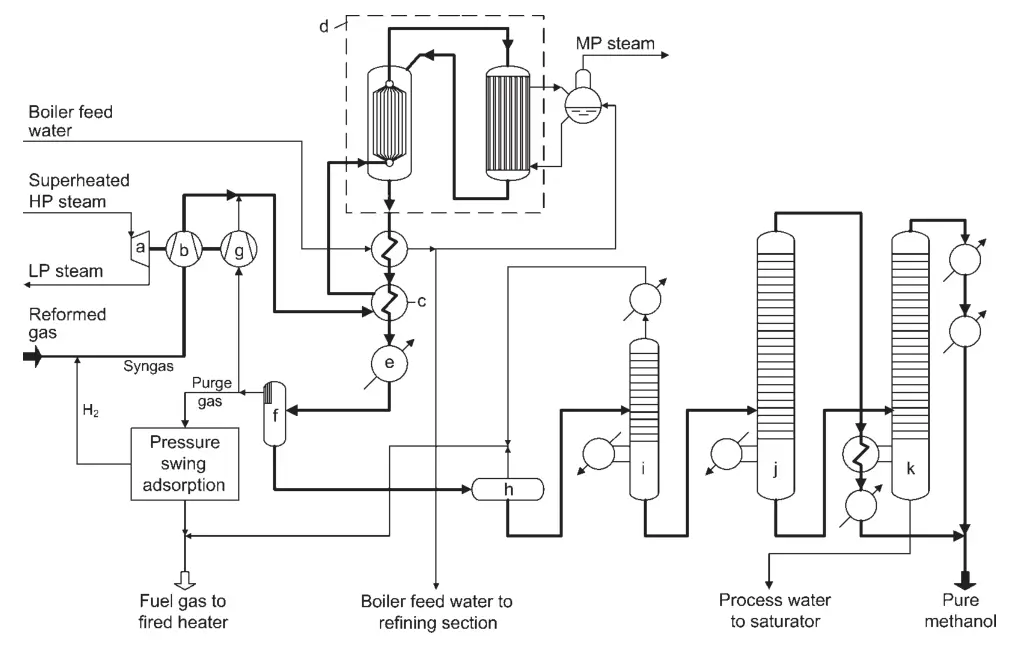
a) Turbine voor synthesegas en recyclecompressor; b) Synthesegascompressor; c) Trimverwarmer; d) Gecombineerd convertersysteem; e) Eindkoeler; f) Methanolseparator; g) Recyclegascompressor; h) Expansievat; i) Lichte eindkolom; j) Zuivere methanol-drukkolom; k) Atmosferische methanolkolom
De quasi-isotherme reactor zet het meest reactieve deel van het synthesegas om, terwijl de gasgekoelde reactor het resterende gas omzet. De reactiewarmte van de gasgekoelde reactor wordt gebruikt om het inlaatgas van de reactor voor de quasi-isotherme reactor voor te verwarmen.
Een ander ontwerp voor een methanolsynthesefabriek met hoge conversie is de serielustechnologie van Davy Process Technology (figuur 2). Dit proces gebruikt twee reactoren in serie, waarbij hetzelfde circulatiegas twee keer wordt gebruikt. De drijvende kracht voor de reactie wordt gehandhaafd door methanol te condenseren tussen de twee reactoren.
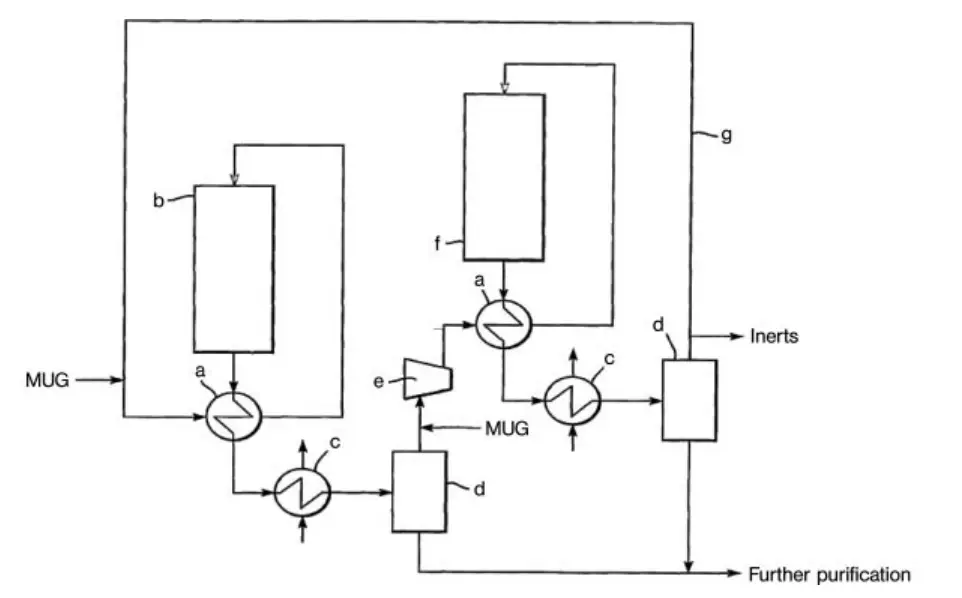
a) Wisselaar; b) Reactor; c) Condensor; d) Gas-vloeistofscheider; e) Circulator; f) Eindreactor; g) Recyclegasleiding
3.3. Alternatieve syntheseroutes van methanol
3.3.1. CO2-naar-methanol
De chemische valorisatie van CO2 door hydrogenering tot methanol wordt al sinds het begin van de jaren negentig bestudeerd. Het heeft echter pas de laatste jaren commerciële interesse gekregen door het toenemende bewustzijn van de noodzaak om CO2-uitstoot te verminderen en de ontwikkeling van overheidsbeleid zoals koolstofbelastingen en emissiehandelsprogramma’s.
Verschillende bedrijven hebben katalysatorsystemen en procesconcepten ontwikkeld voor de productie van CO2-naar-methanol. Resultaten op pilotschaal zijn echter schaars en de enige projecten op demonstratieschaal zijn van Mitsui Chemicals en Carbonrecycling, IJsland.
De basiskennis over de CO2-naar-methanoltechnologie is al beschikbaar, maar de echte uitdagingen zijn de productie van hernieuwbare waterstof en de economische productie van schone CO2 uit afvalgasstromen.
De politieke, ecologische en economische factoren zullen bepalen of en wanneer deze technologie op de markt komt.
3.3.2. Vloeistoffase-methanolsynthese
Methanol kan ook worden geproduceerd door koolmonoxide te laten reageren met waterstof in een vloeibare fase, meestal methanol. Bij gebruik van geschikte reactieomstandigheden en katalysatorsystemen die alkalicomponenten bevatten, kunnen aanzienlijke productiviteiten tot 1,3 kg.kgcat⁻¹ h⁻¹ worden bereikt.
Het reactiemechanisme in de vloeibare fase verschilt van dat in de gasfase. Het omvat de carbonylering van methanol (of een hogere alcohol) tot de betreffende methylester, gevolgd door hydrogenolyse tot de betreffende alcohol en methanol.
Eind jaren negentig werd een demonstratie-installatie voor vloeistoffase-methanolsynthese in gebruik genomen door het Amerikaanse ministerie van Energie (DOE) samen met Eastman en Air Products. Er werd echter vastgesteld dat de levensduur van de katalysator inferieur is aan die van conventionele processen (beste geval: 0,17%/d bij 215 °C). Zowel water als CO2 hebben een negatief effect op de katalysatorprestaties.
Ondanks deze uitdagingen is er nog steeds onderzoek gaande naar vloeistoffase-methanolsynthese. Dit concept is veelbelovend omdat het de potentie heeft om efficiënter en goedkoper te zijn dan conventionele gasfase-methanolsynthese.
3.3.3. Directe oxidatie van methaan
De directe oxidatie van methaan tot methanol is een zeer gewenste reactie, maar het is ook erg uitdagend. Dit komt omdat de reactie zowel kinetisch als thermodynamisch ongunstig is.
De meeste katalysatorsystemen voor de directe oxidatie van methaan tot methanol leveren een lage conversie (<10%) of lage selectiviteit (<80%) op. Sommige bedrijven beweren echter eenvoudige en efficiënte processen voor deze reactie te hebben ontwikkeld, voornamelijk voor kleine gasbronnen.
Een veelbelovend katalysatorsysteem is heterogene Pt-CTF (covalente triazine-gebaseerde framework) katalysatoren in een zwavelzuurmedium. Dit systeem heeft aangetoond een hoge conversie en selectiviteit te bereiken voor de directe oxidatie van methaan tot methanol.
3.4. Destillatie van ruwe methanol
Ruwe methanol die de reactor verlaat, bevat water en andere onzuiverheden, waaronder lichte en zware uiteinden. De hoeveelheid en samenstelling van deze onzuiverheden zijn afhankelijk van de reactieomstandigheden, het toevoergas en de katalysator.
Om de ruwe methanol te zuiveren, wordt deze eerst licht alkalisch gemaakt door kleine hoeveelheden waterige natronloog toe te voegen om lagere carbonzuren te neutraliseren en esters gedeeltelijk te hydrolyseren. Vervolgens worden de lichte uiteinden verwijderd in een lichte uiteindenkolom. Tot slot wordt zuivere methanol overhead gedestilleerd in een of meer destillatiekolommen.
Als de destillatiekolommen werken bij verschillende drukken, kan de condensatiewarmte van de dampen van de kolom die werkt bij hogere druk worden gebruikt om de kolom te verwarmen bij lagere druk.
Als het proceswater lichte onzuiverheden bevat, is een zijafvoer of een extra kolom voor zuivering vereist.
Sommige componenten vormen azeotrope mengsels met methanol, zoals aceton, ethylformiaat, methylacetaat, ethylacetaat en methylpropionaat.
4. Toepassingen van methanol
Methanol heeft een verscheidenheid aan toepassingen in verschillende industrieën. Voor gedetailleerde informatie, zie dit artikel: Gebruik van methanol →
5. Toxicologie van methanol
Methanol is een giftige alcohol die kan worden opgenomen via de mond, huid en longen. Het wordt gemetaboliseerd tot mierenzuur, wat acidose en andere gezondheidsproblemen kan veroorzaken.
Symptomen van methanolvergiftiging zijn onder meer buikpijn, misselijkheid, hoofdpijn, braken, lusteloosheid, wazig zien, oftalmalgie, fotofobie en xanthopsie. In ernstige gevallen kan methanolvergiftiging leiden tot coma en de dood.
De dodelijke dosis methanol ligt tussen 30 en 100 ml/kg lichaamsgewicht. De gevoeligheid voor methanol varieert sterk.
Behandeling voor methanolvergiftiging omvat:
- Toediening van ethanol om de oxidatie van methanol tot mierenzuur te remmen
- Maagspoeling
- Hemodialyse
- Behandeling met alkali om bloedhyperaciditeit te beheersen
- Toediening van CNS-stimulantia
- Drinken van grotere hoeveelheden vloeistof
- Oogverband om de ogen te beschermen tegen licht
- De patiënt warm houden
Methanol kan ook chronische vergiftiging veroorzaken, die wordt gekenmerkt door schade aan het visuele en centrale zenuwstelsel.
Referentie
- Methanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_465.pub3
