Gluconzuur: eigenschappen, reactie, productie en toepassingen
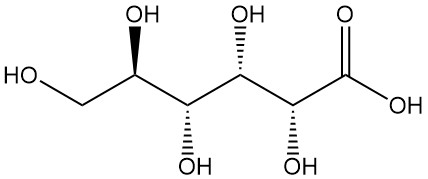
Wat is gluconzuur?
Gluconzuur, ook bekend als 1,2,3,4,5-pentahydroxypentaan-1-carbonzuur, is een organisch zuur met de formule C6H12O7. Het is een wit, geurloos, kristallijn poeder dat van nature voorkomt bij mensen en andere organismen en ook in voedingsproducten zoals wijn en honing.
Gluconzuur werd voor het eerst ontdekt in de jaren 1870 door Hlasiwetz en Habermann tijdens de oxidatie van glucose met chloor, en het werd geïsoleerd in de vorm van zijn barium- en calciumzouten.
Later ontdekten onderzoekers dat gluconzuur geproduceerd kon worden door verschillende mono-, di- en polysacchariden te behandelen met oxidatiemiddelen zoals elementair halogeen, koper(II) of hexacyanoferraat(III)zouten, of kwik(II)oxide.
De bijproducten van deze reacties zijn afhankelijk van het type suiker en de gebruikte oxidant, maar kunnen mierenzuur, glycolzuur, oxaalzuur en koolstofdioxide omvatten.
In de jaren 1880 ontdekte Butroux dat gluconzuur, samen met azijnzuur, werd geproduceerd door de oxidatieve werking van Acetobacter aceti op glucose, wat ook kenmerkend bleek te zijn voor andere bacteriën.
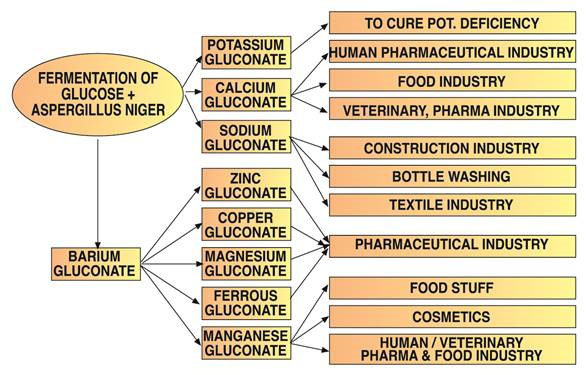
Molliard was de eerste die de aanwezigheid van gluconzuur in culturen van Aspergillus niger meldde, dat vroeger bekendstond als Sterigmatocystis nigra. De voorkeursmethode voor het produceren van gluconzuur en zijn derivaten is tegenwoordig gebaseerd op Aspergillus-stammen, gebaseerd op het werk van verschillende onderzoekers.
Anodische oxidatie werd in de jaren 30 voorgesteld als een methode voor het bereiden van calciumgluconaat, later gevolgd door studies naar de katalytische oxidatie van glucose met behulp van lucht of zuurstof.
Inhoudsopgave
1. Fysische eigenschappen van gluconzuur
De kristallisatie van D-gluconzuur in zijn vrije vorm is moeilijk en volgens sommige studies is de kristallisatie van de watervrije substantie alleen mogelijk onder 30 °C, en die van het monohydraat bij 0–3 °C.
De moleculaire massa van gluconzuur is 196,16 g/mol.
De watervrije vorm van gluconzuur is een wit, geurloos, kristallijn poeder met een smeltpunt variërend van 120 tot 131 °C vanwege de vorming van intramoleculaire anhydriden en een specifieke rotatie van [α]D20 = -6,7° en [α]D25 = -5,4°.
Het is zeer oplosbaar in water, licht oplosbaar in ethanol en onoplosbaar in niet-polaire oplosmiddelen. De commerciële 50% gluconzuuroplossing in water heeft een pH van 1,82 en een dichtheid van 1,23 g/cm3.
D-gluconzuur vormt lactonen bij opslag boven droogmiddel bij kamertemperatuur of verhitting boven 50 °C en ondergaat pyrolyse boven 200 °C.
Het bestaat in evenwicht met twee lactonen (1,5-lacton (1) en 1,4-lacton (2)) in waterige oplossing en in de vaste toestand. Het vrije zuur heeft een dissociatieconstante (KA) van 1,99 × 10-4 en een pKa van 3,70.
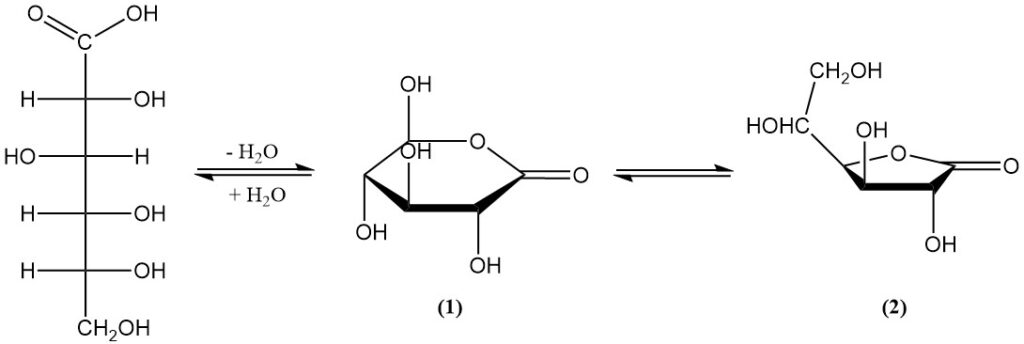
1,5-lacton (1) is een witte, kristallijne vaste stof met een lichte zoetheid, een smeltpunt van 153 °C en een specifieke rotatie: [α]D20 = +66,2°. Het is zeer oplosbaar in water (en neemt toe met de temperatuur) en licht oplosbaar in sommige organische oplosmiddelen.
1,4-lacton (2) verschijnt als fijne naalden met een smeltpunt van 134–136 °C en een specifieke rotatie: [α]D20 = +67,8°. Het heeft een lage oplosbaarheid in de meeste oplosmiddelen.
2. Chemische reacties van gluconzuur
Oxidatie van gluconzuurlactonen of calciumzout met milde oxidanten zoals salpeterzuur of waterstofperoxide leidt tot een mengsel van oxogluconzuren, voornamelijk met ketongroepen op positie 2 en 5.
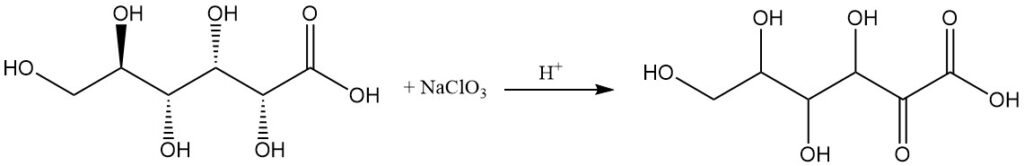
Anodische oxidatie, oxidatie met natriumchloraat in een zure oplossing, of fermentatie door specifieke bacteriën, zoals Acetobacter-soorten, kan 2-oxo-D-gluconzuur produceren als hoofdproduct.
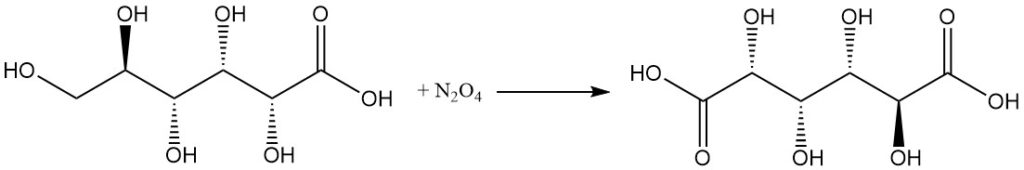
De reactie met geconcentreerd salpeterzuur, of N2O4 zet gluconzuur om in glucarinezuur.
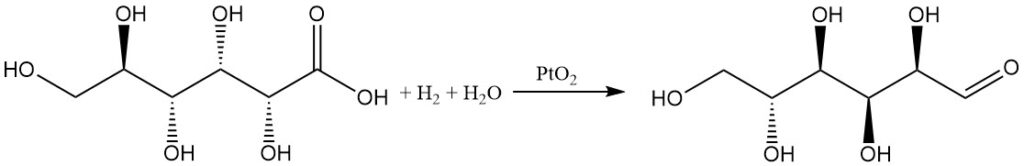
Hydrogenering van gluconzuur in water met een platinaoxidekatalysator levert D-glucose op in een matige opbrengst, terwijl 1,5-lacton een hoge opbrengst oplevert.
Door gluconzuur te koken met geconcentreerd waterstofjodide en rode fosfor ontstaat hexaanzuur.
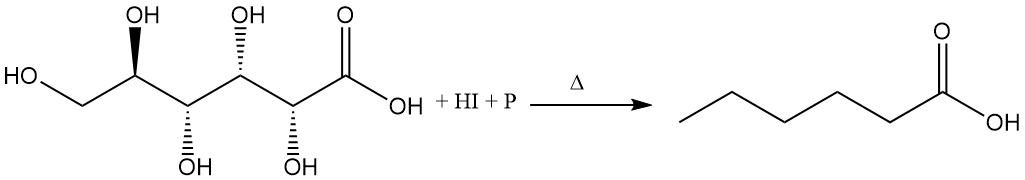
Functionele groepen van gluconzuur kunnen theoretisch reageren met verschillende reagentia (alcoholen, zuren, enz.); een volledige reactie is echter noodzakelijk voor stabiele derivaten. Gedeeltelijke reacties creëren onstabiele mengsels die vatbaar zijn voor hydrolyse en hebben een beperkte praktische waarde.
Gluconzuur en zijn alkalizouten zijn waardevol vanwege hun vermogen om stabiele complexen te vormen met polyvalente kationen. Voorbeelden zijn gluconaatzouten van calcium, koper, ijzer en mangaan.
Kernmagnetische resonantiestudies suggereren dat zowel carboxyl- als hydroxylgroepen betrokken zijn bij complexvorming met deze kationen.
3. Productie van gluconzuur
D-gluconzuur wordt industrieel geproduceerd door de oxidatie van glucose of grondstoffen die rijk zijn aan glucose. Het oxidatieproces kan chemisch, elektrolytisch, katalytisch of biochemisch zijn.
3.1. Productie van gluconzuur door chemische oxidatie van glucose
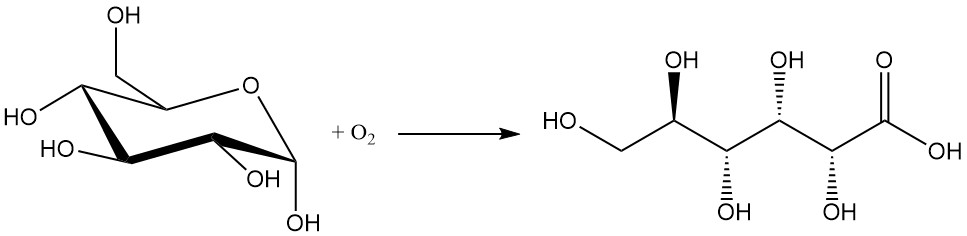
De chemische oxidatie van glucose is de minst geprefereerde methode vanwege de lage opbrengsten (tussen 60 en 80%) en de vorming van ongewenste bijproducten. De isolatie en zuivering van het gewenste product zijn moeilijk.
Veelgebruikte oxidanten in dit proces zijn waterstofperoxide, ozon en zuurstof.
3.2. Productie van gluconzuur door elektrochemische oxidatie van glucose
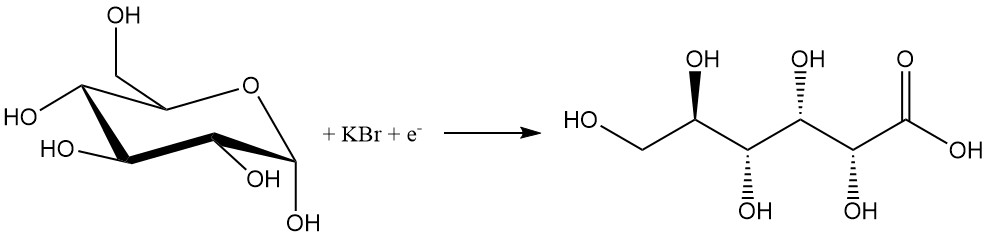
Vergelijkbaar met chemische methoden heeft het elektrochemische proces een lage selectiviteit vanwege het gebruik van halogenen.
Een oplossing van glucose met 10% bromide wordt geëlektrolyseerd bij een stroomdichtheid van 1–20 A/dm2 om 80–97% gluconzuur te produceren. Basen zoals calciumcarbonaat of hydroxiden worden toegevoegd om het resulterende
zuur te neutraliseren.
De hoge kosten van elektriciteit maken deze methode minder concurrerend.
3.3. Productie van gluconzuur door katalytische oxidatie van glucose
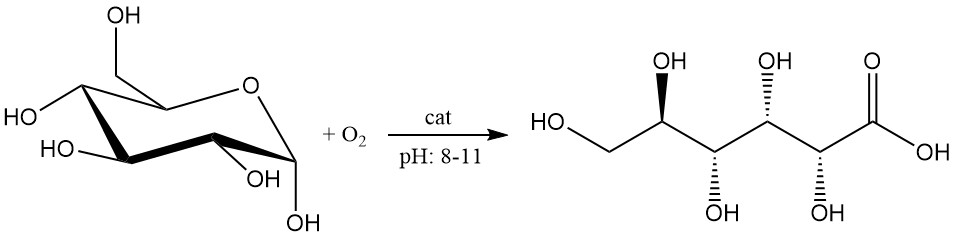
De katalytische oxidatie van glucose heeft recentelijk vooruitgang geboekt en wordt als veelbelovend beschouwd voor productie op industriële schaal.
De glucoseoplossing in een concentratie van 1 – 2 mol/L wordt geoxideerd door zuurstof of lucht bij een pH tussen 8 en 11.
Oorspronkelijk werden platinagroepmetalen op dragers, zoals actieve kool en aluminiumoxide, gebruikt als katalysatoren. Er zijn echter enkele uitdagingen ontstaan bij het gebruik van dit type katalysator, waaronder deactivering van de katalysator, de noodzaak van zuivere glucose en de vorming van bijproducten.
Het dopen van deze katalysatoren met elementen zoals lood, selenium of bismut verbetert de activiteit en selectiviteit, en actieve kool is de voorkeursdrager voor deze katalysatoren.
Door deze katalysatoren te gebruiken om een 2 M glucoseoplossing te oxideren tot gluconzuur met zuurstof bij 50 °C en pH 9,5, zijn hoge opbrengsten (> 99,5%) en zuiverheid (> 99,5%) bereikt met minimale zuiveringsbehoeften.
Deze katalysatoren zijn ook herbruikbaar, met minimaal activiteitsverlies.
De economische levensvatbaarheid van deze methode hangt sterk af van de kosten, activiteit, selectiviteit en levensduur van de katalysator, samen met de zuivering van het product en de energievereisten.
Ondanks eerdere suggesties is fotochemische oxidatie van glucose tot gluconzuur niet levensvatbaar.
3.4. Productie van gluconzuur door fermentatie
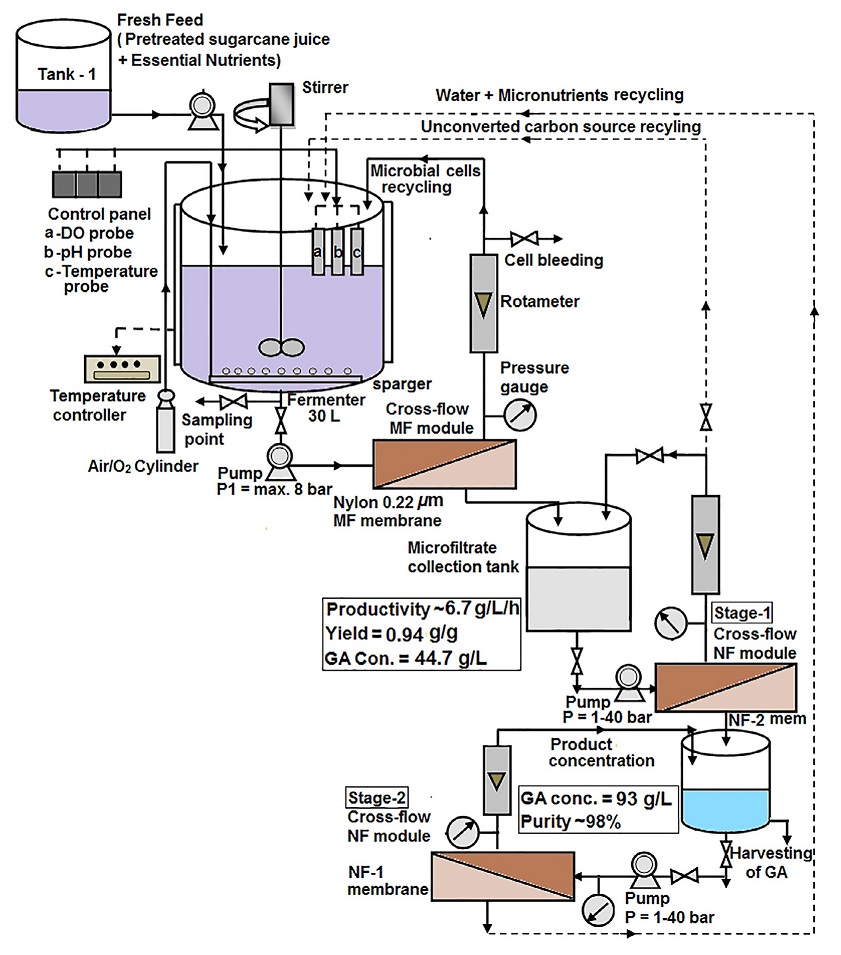
D-gluconzuur wordt commercieel geproduceerd door biologische fermentatie met behulp van twee hoofdorganismen: Aspergillus niger en Gluconobacter suboxydans.
3.4.1. Aspergillus niger-proces
Glucose wordt geoxideerd tot gluconzuur door het enzym glucose-oxidase in de schimmelcellen. Dit enzym gebruikt flavine-adeninedinucleotide als cofactor en produceert uiteindelijk waterstofperoxide. Catalase, een ander enzym dat aanwezig is in de schimmel, breekt de waterstofperoxide af tot water en zuurstof.
Het gevormde gluconzuur kan in evenwicht bestaan met zijn lactonvorm. De optimale pH voor dit proces is ongeveer 5,6.
Grootschalige productie omvat het fermenteren van een gesteriliseerde voedingsbouillon die glucose, magnesiumsulfaat, kaliumfosfaat en een stikstofbron bevat. De bouillon wordt geënt met een cultuur van Aspergillus niger.
Tijdens de fermentatie neemt de activiteit van glucose-oxidase snel toe, wat leidt tot een overeenkomstige stijging van de gluconzuurproductie. Het proces duurt doorgaans 40-100 uur en het handhaven van een goede zuurstoftoevoer en een goede pH-controle zijn belangrijk voor een efficiënte opbrengst.
Na de fermentatie wordt de schimmelbiomassa verwijderd door filtratie en wordt de gluconzuuroplossing gezuiverd door verschillende stappen zoals ontkleuring en filtratie. Afhankelijk van het gewenste eindproduct kan de oplossing worden gekristalliseerd om gluconzuur te verkrijgen of worden gesproeidroogd om een geconcentreerde oplossing te verkrijgen.
3.4.2. Gluconobacter suboxydans-proces
Dit proces gebruikt twee glucosedehydrogenase-enzymen voor de omzetting van glucose in gluconzuur. In tegenstelling tot de Aspergillus niger-methode heeft Gluconobacter suboxydans minder beluchting nodig vanwege zijn hogere zuurstofaffiniteit.
Bovendien tolereert dit organisme zuurdere omstandigheden, waardoor de directe isolatie van vrij gluconzuur uit de fermentatiebouillon mogelijk is.
3.4.3. Andere methoden en downstream processing
Hoewel ze nog niet commercieel levensvatbaar zijn, worden sommige processen die gebruikmaken van acidofiele methylotrope bacteriën zoals Acetobacter methanolicus onderzocht voor directe productie van gluconzuur. Er wordt ook onderzoek gedaan naar het gebruik van geïmmobiliseerde enzymen of micro-organismen voor dit doel.
Het terugwinnen van vrij gluconzuur uit fermentatiebouillons die natriumgluconaat (het natriumzout van gluconzuur) bevatten, kan worden bereikt door technieken zoals kationenuitwisseling of elektrodialyse.
Kristallisatie uit een oververzadigde oplossing is de primaire methode voor het verkrijgen van zuiver gluconzuur in zijn lactonvorm. Dehydratie met specifieke alcoholen gevolgd door kristallisatie is een andere methode voor lactonproductie.
4. Toepassingen van gluconzuur
Gluconzuur wordt gebruikt voor reinigingstoepassingen vanwege het vermogen om metaaloxiden, hydroxiden en carbonaten op te lossen en ook vanwege de vorming van in water oplosbare complexen met deze kationen.
Gluconzuur wordt gebruikt om kalk- en roestafzettingen van verschillende metalen te verwijderen, waaronder gegalvaniseerd ijzer, magnesiumlegeringen en roestvrij staal. Het wordt gebruikt bij het reinigen van bier- en melkaanslag van deze oppervlakken.
In combinatie met magnesiumzouten fungeert gluconzuur als stabilisator voor peroxidebleekbaden in de textielindustrie.
De fysiologische eigenschappen van D-gluconzuur maken het geschikt voor toepassingen in de voedings- en drankenindustrie. Lage concentraties (0,02-0,1%) keren sucrose effectief om zonder verdere fructosereacties.
Sporenelementen worden vaak toegediend als gluconaatzouten vanwege hun hoge biologische beschikbaarheid en tolerantie. Kaliumgluconaat, verkrijgbaar in watervrije of monohydraatvorm, heeft specifieke farmaceutische toepassingen.
Gluconzuur 1,5-lacton is in veel voorbeelden een handig alternatief voor het vrije zuur. Het biedt voordelen in zure omgevingen, zoals het inmaken van goederen, het uitharden van worsten en het laten rijzen van gebakken goederen.
Natriumgluconaat is het meest voorkomende gluconaatzout. Het vormt complexen met metaalkationen, waarbij de stabiliteit toeneemt bij een hogere pH. Het reinigt effectief verschillende oppervlakken en verwijdert vet, corrosie, roest en oxidecoatings van aluminium, staal, koper en hun legeringen.
Hete (95–100 °C) alkalische natriumgluconaatoplossingen verwijderen verf en vernis efficiënt zonder de onderliggende oppervlakken te beschadigen.
Gluconaatoplossingen worden gebruikt bij het voorbehandelen van oppervlakken voor nikkel-kobalt solderen op aluminium en het voorbereiden van gladde, glanzende nikkel-, tin- en zink-gegalvaniseerde oppervlakken. Het vervangt steeds vaker het giftige cyanide-ion in sommige toepassingen.
Natriumgluconaat, soms gecombineerd met polyfosfaten, wordt in de papierindustrie gebruikt als een lijmmiddel dat zuurbestendigheid aan papier verleent. In textiel helpt het bij het ontkleuren van polyester- of polyamidestoffen en het afwerken van natuurlijke cellulosevezels.
De stabiliteit van natriumgluconaat bij hoge temperaturen en pH, in combinatie met het vermogen om waterverhardende middelen te binden, maakt het een nuttig onderdeel van commerciële reinigingsmiddelen. Het wordt gebruikt bij het wassen van flessen en het reinigen van aluminium oppervlakken.
Betonfabrikanten gebruiken natriumgluconaat als een zeer effectief uithardingsvertrager. Het verbetert de homogeniteit, waterbestendigheid, vorstbestendigheid en verwerkbaarheid van beton, terwijl het scheuren vermindert.
Een belangrijk voordeel van gluconzuur, zijn lacton en hun zouten is hun biologische afbreekbaarheid in afvalwaterzuiveringssystemen. Dit strekt zich uit tot hun metaalcomplexen met aluminium, koper, ijzer en zink. Zelfs chroomgluconaatcomplexen zijn biologisch afbreekbaar, zij het langzamer.
Vrijgekomen metaalionen worden verwijderd tijdens de zuivering van afvalwater, waardoor de potentiële mobilisatie van zware metalen wordt verminderd. Biologische afbraak en hydroxideprecipitatie (bij pH 9–10) dragen bij aan de vernietiging van zware metaalgluconaatcomplexen in afvalwater.
Referenties
- Gluconic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a12_449
- S. Banerjee et al., Fermentative production of gluconic acid: A membrane-integrated Green process, Journal of the Taiwan Institute of Chemical Engineers (2018), https://doi.org/10.1016/j.jtice.2018.01.030
