Ftaalzuur: eigenschappen, productie en toepassingen
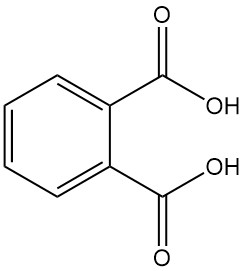
Ftaalzuur, ook bekend als o-ftaalzuur of 1,2-benzeendicarbonzuur, is een aromatisch dicarbonzuur met de chemische formule C8H6O4. Het is een witte, kristallijne vaste stof die industrieel niet van belang is. Het wordt gevormd als bijproduct bij de productie van ftaalzuuranhydride.
Ftaalzuur komt van nature voor in sommige planten, zoals Papaver somniferum, Cocos nucifera en andere organismen en dieren. Het werd voor het eerst ontdekt in 1836 door de Franse chemicus A. Laurent als een product van de oxidatie van naftaleen.
Inhoudsopgave
1. Fysische eigenschappen van ftaalzuur
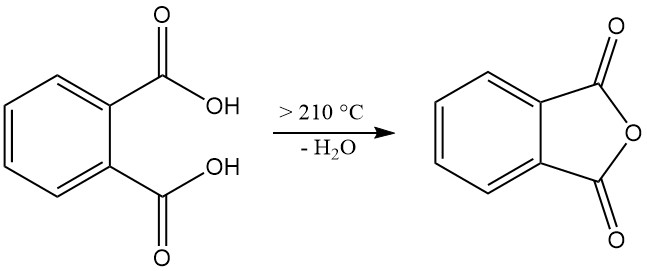
Ftaalzuur [88-99-3] is een zwak diprotisch zuur met dissociatieconstanten pKa1 = 2,89 en pKa2 = 5,51. Het vormt kleurloze, monokliene kristallen met een smeltpunt van 191 °C in een afgesloten buis die worden omgezet in ftaalzuuranhydride met de eliminatie van water bij temperaturen hoger dan 210 °C.
Ftaalzuur is oplosbaar in kokend water (100 °C), 18 g/100 ml, en is veel minder oplosbaar in koud water (14 °C), 0,54 g/100 ml. Het is oplosbaar in ethanol (10 g/100 ml) en methanol (19,5 g/100 ml) en onoplosbaar in chloroform en ether.
Enkele van de belangrijke fysische eigenschappen van ftaalzuur worden in de volgende tabel vermeld.
| Eigenschap | Waarde |
|---|---|
| Formule | C8H6O4 |
| Moleculair gewicht | 166,14 g/mol |
| Smeltpunt | 191 °C (in afgesloten buis) Ontleding bij 210 °C |
| Dichtheid bij 15 °C | 1,593 g/cm3 |
| Dampdichtheid | 5,7 |
| Smeltwarmte | 315,3 J/g |
| Soortelijke warmte van vaste stof (0–99 °C) | 1,214 J g-1 K-1 |
| Verbrandingswarmte | 19657,03 J/g |
| Vormingswarmte | 43714,34 J/g |
| Warmte van de oplossing bij 25 °C | 123,55 J/g |
| Vlampunt | 168 °C |
2. Reacties van ftaalzuur
Ftaalzuur ondergaat typische chemische reacties van carbonzuren en aromatische verbindingen.
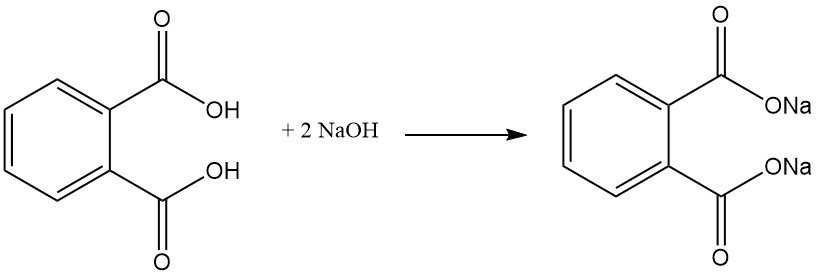
Ftaalzuur is een zwak diprotisch zuur dat reageert met basen zoals NaOH of KOH en metaaloxiden om zouten te vormen die ftalaten worden genoemd. Deze zouten kunnen oplosbaar zijn in water (zouten gevormd met alkalimetalen (bijv. natrium, kalium)) of onoplosbaar, zoals calcium- en magnesiumftalaten.
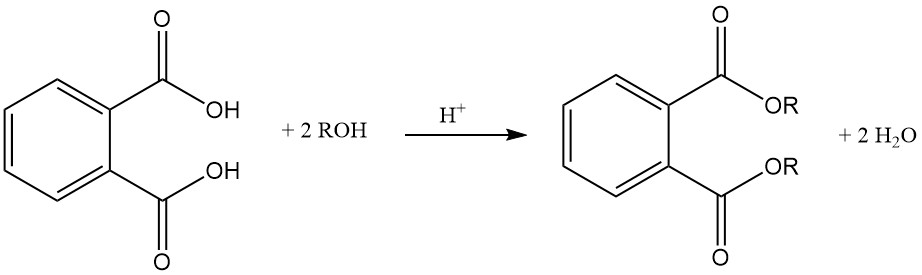
Ftaalzuur reageert met alcoholen in aanwezigheid van een zure katalysator (zwavelzuur) om ftalaatdiesters te vormen. Deze esters zijn nuttige industriële chemicaliën met verschillende toepassingen.
Wanneer ftaalzuur wordt verhit tot 210 °C of hoger, ondergaat het dehydratie, waarbij ftaalzuuranhydride ontstaat.
Ftaalzuur kan aromatische substitutiereacties ondergaan; de aanwezigheid van de twee carbonzuurgroepen deactiveert het echter. Onder specifieke en zware omstandigheden is verdere functionalisering van de aromatische ring mogelijk.
3. Productie van ftaalzuur
Ftaalzuur wordt gevormd als bijproduct bij de productie van ftaalzuuranhydride door hydrolyse. Ftaalzuur is niet belangrijk in de industrie. In plaats daarvan wordt ftaalzuuranhydride industrieel geproduceerd en indien nodig omgezet in ftaalzuur.
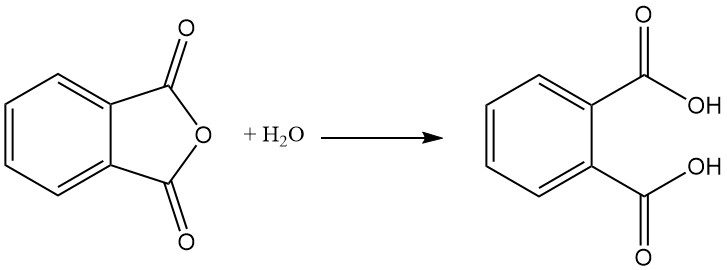
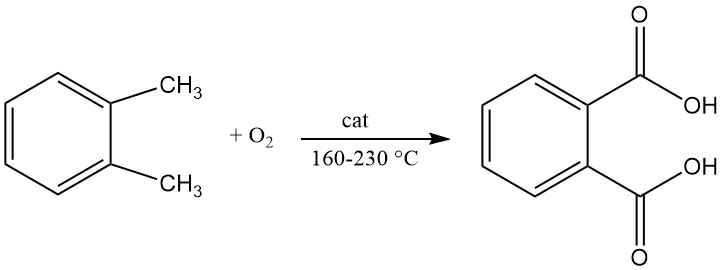
Ftaalzuuranhydride wordt bereid door katalytische oxidatie van naftaleen of ortho-xyleen (o-xyleen) bij hoge temperaturen en maakt vaak gebruik van een vaste-bed buisreactoropstelling.
Een patent uit 1979 beschreef de productie van ftaalzuur door continue vloeistofoxidatie van o-xyleen met lucht in een geroerde reactor. De reactie wordt uitgevoerd bij een temperatuur tussen 160 °C en 200 °C en een druk tussen 21 en 29 kg/cm2.
De katalysator die in dit proces werd gebruikt, bevatte een mengsel van kobalt, mangaan en broom en het watergehalte in het reactiemedium ligt tussen 0,2% en 7%.
De lucht wordt gebruikt als oxidatiemiddel en het resulterende vloeibare mengsel bevat 8% tot 40% ftaalzuur en 6% tot 30% o-xyleen. Dit vloeibare mengsel wordt continu, samen met extra lucht, in een tweede geroerde reactor gevoerd.
De temperatuur in deze tweede reactor wordt gehandhaafd tussen 210 °C en 230 °C. Het is belangrijk om op te merken dat hier verse katalysator wordt toegevoegd, die ten minste 1 milligramatoom kobalt per mol verwerkt xyleen bevat (vergeleken met de eerste fase).
Deze tweestapsreactie levert een vloeibaar effluent op dat rijk is aan ftaalzuur (85% tot 92%). Het bevat echter ook water, onzuiverheden zoals benzoëzuur en verbindingen met een hoger kookpunt.
4. Toepassingen van ftaalzuur
Ftaalzuur wordt gebruikt als analytisch en laboratoriumreagens en om medicijnen, kleurstoffen, ftaalimide, anthranilzuur, ftaalzuuresters en synthetische parfums te maken.
Ftaalzuur kan worden gebruikt als voorloper van ftaalzuuranhydride, dat waardevoller is en wordt gebruikt in verschillende industrieën zoals verf, kunststoffen, textiel en farmaceutica.
5. Toxicologie en gevaren van ftaalzuur
Ftaalzuur is een tussenproduct dat wordt geproduceerd en verder wordt gebruikt in de industrie onder goed gecontroleerde omstandigheden. Beroepsmatige blootstelling kan voorkomen, maar zal naar verwachting laag zijn. De blootstelling van het algemene publiek aan ftaalzuur is laag en verwaarloosbaar.
Ondanks het beperkte aantal beschikbare toxicologische studies, suggereren bestaande gegevens een lage toxiciteit voor ftaalzuur. Acute toxiciteitsstudies bij muizen (intraperitoneale injectie) geven een mediane letale dosis (LD50) van 550 mg/kg aan.
Na blootstelling wordt het grootste deel van het ftaalzuur uitgescheiden in de urine, hetzij direct (zoals bij honden) of gedeeltelijk geconjugeerd (zoals bij ratten en konijnen). Een klein deel kan decarboxyleren en worden geëlimineerd als benzoëzuur.
Referenties
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://patents.google.com/patent/US4215053A/en
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalic-acid
