Crotonzuur: eigenschappen, reacties, productie en toepassingen
Wat is crotonzuur?
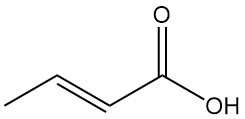
Crotonzuur is de trans-isomeer van 2-buteenzuur. Het is een korteketen, onverzadigd carbonzuur met de chemische formule CH3CH=CHCOOH. De cis-isomeer van 2-buteenzuur staat bekend als isocrotonzuur.
Crotonzuur verschijnt als een witte tot gelige vaste stof met een scherpe, verstikkende geur, terwijl isocrotonzuur een olieachtige, kleurloze vloeistof is met een karakteristieke geur die lijkt op bruine suiker.
De term “crotonzuur” komt van crotonolie, een olie die afkomstig is van de zaden van Croton tiglium. Aanvankelijk werd crotonzuur ten onrechte geïdentificeerd als een product dat werd gevormd tijdens de verzeping van deze olie.
Crotonzuur is te vinden in ruw houtdestillaat en wordt geproduceerd als een metaboliet tijdens de afbraak van vetzuren.
Inhoudsopgave
1. Fysieke eigenschappen van crotonzuur
Wanneer gekristalliseerd, vormt crotonzuur witte naalden, of prismakristallen, in het monokliene systeem. Het is licht oplosbaar in water en oplosbaar in ethanol, aceton, ethylacetaat en tolueen, en vormt azeotroop met water dat 96,86% crotonzuur bevat bij 99,7 °C.
Isocrotonzuur is mengbaar met water en polaire oplosmiddelen en vormt een eutectisch mengsel met crotonzuur (30% crotonzuur), dat smelt bij -3 °C.
Tabel 1 vat enkele van de fysieke eigenschappen van crotonzuur en isocrotonzuur samen.
| Eigenschap | Crotonzuur | Isocrotonzuur |
|---|---|---|
| Moleculair gewicht | 86,09 g/mol | 86,09 g/mol |
| Kookpunt | 189 °C | 169 °C |
| Smeltpunt | 72 °C | 15 °C |
| Dichtheid (20 °C) | 1.018 | 1.0267 |
| Breukindex | 1.4228 (80 °C) | 1.4456 (20 °C) |
| Oplosbaarheid in water, g/kg | 41.5 (0 °C), 94 (25 °C) | 656 (40 °C), 1260 (42 °C) |
| Vlampunt | 88 °C | - |
| Automatische ontsteking temperatuur | 396 °C | - |
| Dampspanning | 24 Pa (20 °C), 880 Pa (70°C) | - |
| Soortelijke warmte | 3,031 J g-1 K-1 (vast) 2,072 J g-1 K-1 (vloeistof) |
- |
| Verbrandingswarmte | 2,00 MJ/mol | 2,03 MJ/mol |
| Smeltwarmte | 150,9 J/g | - |
| pKa | 4,817 (25 °C) | - |
2. Chemische reacties van crotonzuur
Crotonzuur is een zwak zuur in waterige oplossingen, dus het kan reageren met organische en anorganische basen.
Crotonzuur ondergaat verschillende transformaties bij verhitting, blootstelling aan zuren, basen, UV-straling of andere reagentia. Deze reacties omvatten isomerisatie, oligomerisatie en polymerisatie.
Isocrotonzuur isomeriseert tot crotonzuur en bereikt een evenwicht bij 140–180 °C. 3-buteenzuur vormt zich als bijproduct, waarbij het uiteindelijke mengsel een isocrotonzuur-crotonzuurverhouding van ongeveer 0,17:1 bevat.
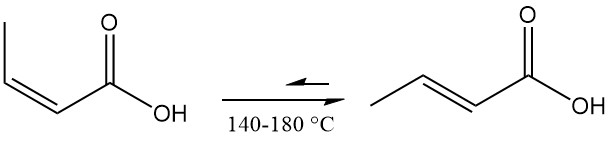
Zowel crotonzuur als isocrotonzuur kunnen worden gereduceerd tot crotylalcohol of boterzuur. Omgekeerd kunnen ze worden geoxideerd tot het overeenkomstige perzuur.
Crotonzuur copolymeriseert gemakkelijk met verschillende monomeren via een radicaalmechanisme. Copolymeren met vinylacetaat zijn industrieel belangrijk.
Additiereacties aan de dubbele binding van crotonzuur leveren 2-gesubstitueerde of 2,3-digesubstitueerde boterzuren op.
Katalytische hydrogenering zet crotonzuur om in boterzuur.
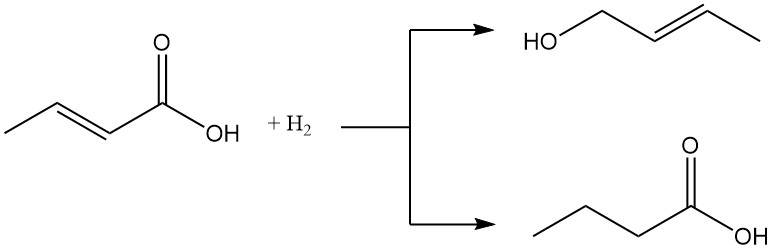
De halogenering of de additie van waterstofhalogeniden leidt tot de vorming van respectievelijk 2,3-dihaloboterzuren of 3-haloboterzuren.
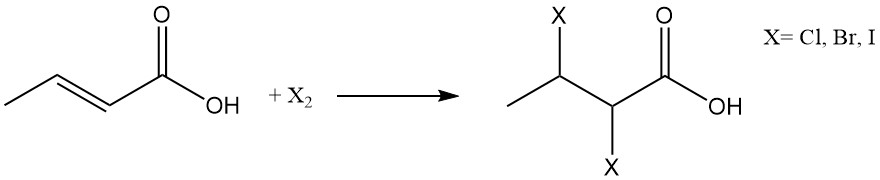
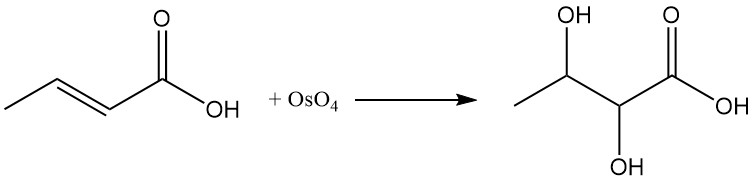
De reactie van crotonzuur met osmiumtetroxide (OsO4) of peroxybenzoëzuur produceert 2,3-dihydroxybutaanzuur.
Onder geschikte reactieomstandigheden ontstaat door toevoeging van ammoniak β-aminoboterzuur.
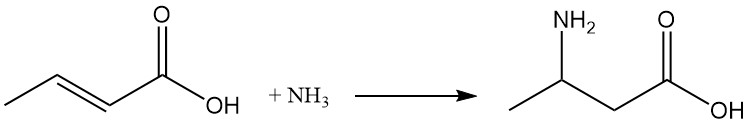
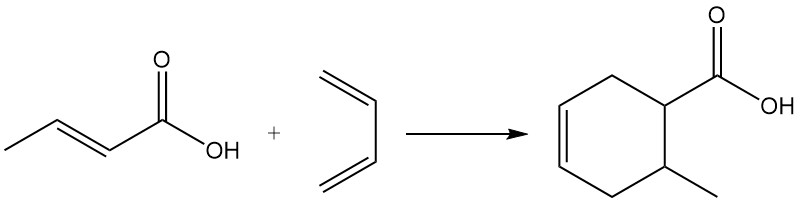
Vanwege het dienofiele karakter neemt crotonzuur deel aan Diels-Alder-reacties.
Verestering van crotonzuur is mogelijk met conventionele methoden. De aanwezigheid van de geconjugeerde dubbele binding leidt echter vaak tot lagere reactiesnelheden vergeleken met boterzuur.
Crotonylhalogeniden kunnen worden gesynthetiseerd door crotonzuur te laten reageren met het overeenkomstige acylhalogenide.
Crotonzuuranhydride wordt verkregen door de reactie van crotonylchloride met natriumcrotonaat of door crotonzuur te behandelen met azijnzuuranhydride.
3. Productie van crotonzuur
Crotonzuur wordt industrieel geproduceerd door de oxidatie van crotonaldehyde. Dit proces wordt gebruikt door bedrijven als Weylchem Frankfurt en maakt gebruik van een reactievolgorde in twee stappen:
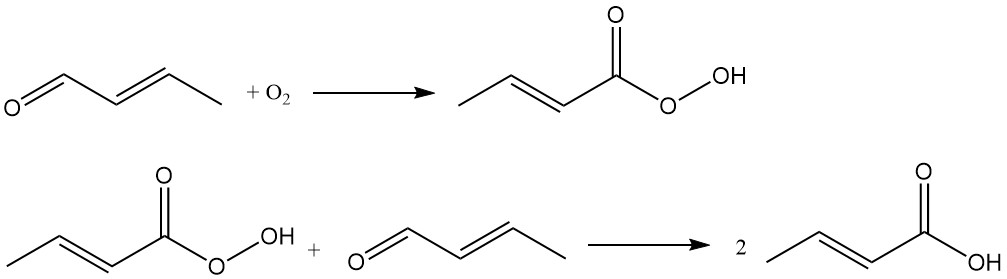
Crotonaldehyde ondergaat oxidatie om peroxocrotonzuur te vormen als tussenproduct, dat reageert met een ander crotonaldehydemolecuul om crotonzuur te produceren.
De reactie vindt doorgaans plaats bij gematigde temperaturen (20–45 °C) en druk (100–500 kPa). Metaalzouten, met name die van mangaan, kobalt, koper of thallium, worden toegevoegd als katalysatoren om de ongewenste ophoping van peroxiden te voorkomen. Bijproducten omvatten mierenzuur, azijnzuur, water en koolstofdioxide van volledige oxidatie.
Een historisch proces van Hoechst gebruikte een mangaanzoutkatalysator voor crotonaldehydeoxidatie bij 20–30 °C. Het resulterende reactiemengsel bevatte ongeveer:
- 20-30% crotonzuur
- 1-3% mierenzuur en azijnzuur
- 3-5% water
- Sporen van 3-buteenzuur, onbekende verbindingen en 0,5-1% isocrotonzuur
Overtollig crotonaldehyde wordt teruggewonnen door vacuümdestillatie en teruggevoerd in de reactie. Het destillatieresidu, rijk aan crotonzuur (60-70%), ondergaat verdere zuivering via een tweede vacuümdestillatie.
De laagkokende fractie en het residu worden weggegooid als afval. De hoofdproductfractie bevat crotonzuur met wat isocrotonzuur (3-5%). Fractionele kristallisatie wordt vervolgens gebruikt om het isocrotonzuur te verwijderen, wat resulteert in zeer zuiver crotonzuur (tot 99,9%).
Terwijl industriële productie afhankelijk is van crotonaldehyde-oxidatie, bestaan er verschillende alternatieve methoden voor de laboratoriumschaalsynthese van crotonzuur. Deze omvatten:
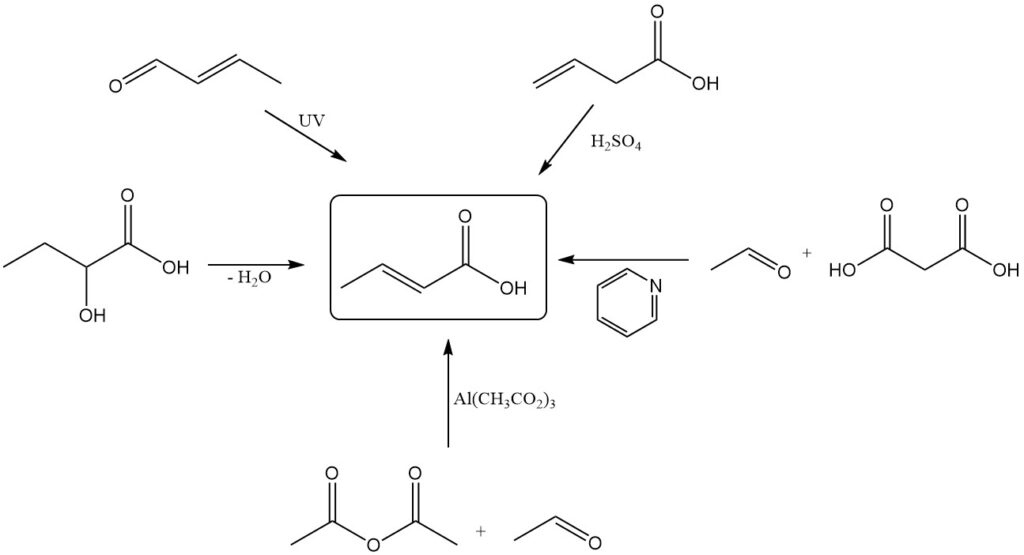
- Dehydratie van 2-hydroxybutaanzuur
- Fotochemische oxidatie of oxidatieve bestraling (met ultrageluid) van crotonaldehyde
- Isomerisatie van vinylazijnzuur met zwavelzuur
- Condensatie van aceetaldehyde en malonzuur met behulp van pyridine als katalysator
- Oxidatie van buteen met een heteropolymolybdeenzuurkatalysatorsysteem
- Oxycarbonylering van propeen met overgangsmetaalcomplexkatalysatoren
- Carbonylering van propyleenoxide
- Reactie van azijnzuuranhydride met acetaldehyde met behulp van basische aluminiumacetaatkatalysator
- Carbonylering van allylalcohol met nikkel- of palladium-gebaseerde katalysatoren
Isocrotonzuur kan worden gescheiden uit mengsels die crotonzuur bevatten met behulp van technieken zoals fractionele kristallisatie, rectificatie (destillatie) of gelfiltratiechromatografie.
Een stereospecifieke methode voor laboratoriumbereiding van isocrotonzuur omvat de bromering van 2-butanon (methylethylketon), gevolgd door Favorskii-omlegging.
4. Toepassingen van Crotonzuur
De primaire toepassing van crotonzuur is de productie van copolymeren met verschillende comonomeren. Crotonzuur-vinylacetaatcopolymeren zijn van industrieel belang. Deze copolymeren worden vaak op de markt gebracht onder handelsnamen zoals Mowilith, Vinnapas en Vinac.
Crotonzuurcopolymeren worden gebruikt in verf, coatings, smeltlijmen, lijmen en smeltlijmen. Ze worden ook gebruikt voor coatings op papier en textiel, als vlokmiddelen, bindmiddelen voor explosieven, keramiek en agrochemicaliën, en als booradditieven.
Andere toepassingen van crotonzuur zijn onder meer:
- Als antimicrobieel middel in estervorm voor deodorants.
- In UV-absorbers en metaal-effect interferentie pigmenten.
- Vetalcohol esters van crotonzuur worden gebruikt in de leerindustrie.
- Het vrije zuur heeft toepassingen in motor brandstoffen, etsen van metaaloppervlakken, elektrochemische metaalafzetting en PVC-hittestabilisatie.
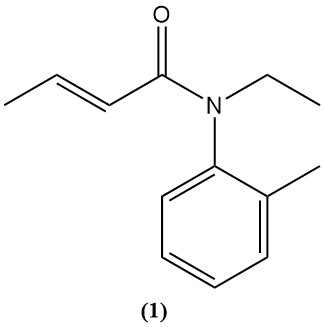
Crotonzuur en zijn derivaten, zoals anhydride en chloride, dienen als voorlopers voor verschillende agrochemicaliën en farmaceutische producten. Een voorbeeld is crotamiton (1), een medicijn dat wordt gebruikt om schurft te behandelen (scabicide) en jeuk te verlichten (antipruritisch).
5. Toxicologie van Crotonzuur
Crotonzuur is een bijtende stof en kan ernstige irritatie of brandwonden veroorzaken bij contact met de ogen, huid of luchtwegen. Inademing kan leiden tot een branderig gevoel, hoesten, hoofdpijn, misselijkheid, keelpijn en kortademigheid (symptomen kunnen vertraagd optreden). Inname veroorzaakt pijn, een branderig gevoel, keelpijn, diarree en braken.
Toxicologische gegevens uit dierstudies staan hieronder vermeld:
- LD50 (rat, oraal): 1000 mg/kg
- LD50 (rat, i.p.): 100 mg/kg
- LD50 (konijn, dermaal): 600 mg/kg
Het lichaam kan op natuurlijke wijze crotonzuur produceren tijdens het vetmetabolisme en dit snel afbreken door enzymen in de lever en andere weefsels. Blootstelling aan niet-irriterende concentraties veroorzaakt waarschijnlijk geen cumulatieve effecten.
Crotonzuur kan de plantengroei en zaadkieming beïnvloeden.
Referentie
- Crotonaldehyde and Crotonic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_083.pub2
