Chloormethaan: eigenschappen, productie en toepassingen
Chloormethaan, ook bekend als methylchloride, is het eenvoudigste gechloreerde derivaat van methaan met de chemische formule CH3Cl. Het is een kleurloos gas met een zwakke, zoete geur dat van nature in sporen voorkomt, maar voornamelijk industrieel wordt geproduceerd.
Inhoudsopgave
1. Fysieke eigenschappen van chloormethaan
Chloormethaan is een kleurloos en brandbaar gas zonder geur. De oplosbaarheid ervan in water is afhankelijk van de temperatuur en het vormt een azeotroop met water. De volgende tabel geeft de oplosbaarheid weer bij 0,1 MPa (1 bar):
| Temperatuur (°C) | Oplosbaarheid (g CH3Cl/kg H2O) |
|---|---|
| 15 | 9,0 |
| 30 | 6,52 |
| 45 | 4,36 |
| 60 | 2,64 |
De belangrijke fysische eigenschappen van chloormethaan staan vermeld in de volgende tabel 2:
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht | 50,49 g/mol |
| Kookpunt bij 1 bar | -24,0 °C |
| Smeltpunt | -97,7 °C |
| Dampspanning bij 20 °C | 4900 mbar |
| Enthalpie van verdamping | 21,67 kJ/mol |
| Smeltingsenthalpie bij smeltpunt | 6,4 kJ/mol |
| Dichtheid van vloeistof (25°C) | 911 kg/m3 |
| Dichtheid van damp bij kookpunt | 2,558 kg/m3 |
| Kubieke uitzettingscoëfficiënt van vloeistof (0–40 °C) | 0,00209 K-1 |
| Enthalpie van vorming van damp (25 °C, 1 bar) | -80,83 kJ/mol |
| Gibbs vrije energie van vorming van damp (25 °C, 1 bar) | -57,37 kJ/mol |
| Soortelijke warmtecapaciteit van damp (25 °C, 1 bar) | 0,807 kJ kg-1 K-1 |
| Kritische temperatuur | 143 °C |
| Kritische druk | 65,9 atm |
| Kritisch volume | 0,13645 ml/mol |
| Thermische geleidbaarheid van damp | 0,00841 W K-1 m-1 |
| Thermische geleidbaarheid van vloeistof (20 °C) | 0,161 W K-1 m-1 |
| Oppervlaktespanning bij 20 °C | 16,2 mN/m |
| Viscositeit van vloeistof bij 20 °C | 0,244 cP |
| Dipoolmoment | 1,86 D |
| Breukindex van vloeistof (25 °C) | 1,3712 |
| Diëlektrische constante van damp bij 20 °C | 1,01 |
| Diëlektrische constante van vloeistof bij 20 °C | 12,9 |
| Ontstekingstemperatuur | 618 °C |
| Onderste ontvlambaarheidsgrens in lucht | 7,1 vol% |
| Bovenste ontvlambaarheidsgrens in lucht | 18,5 vol% |
| Partitiecoëfficiënt lucht/water (20 °C) | 0,3 |
| Partitiecoëfficiënt n-octanol/water (20 °C) (log Pow) | 0,91 |
2. Chemische eigenschappen van chloormethaan
Chloormethaan is een unieke alifatische chloorverbinding die thermisch stabiel is. In tegenstelling tot veel verwante verbindingen is het bestand tegen ontleding tot het 400 °C overschrijdt, zelfs in aanwezigheid van de meeste metalen.
De zelfontbrandingstemperatuur in de lucht is een hoge 632 °C gemeten in een stalen apparaat. Terwijl verbranding voornamelijk CO2 en HCl genereert, kunnen er ook sporen van COCl2 en CO worden gevormd. Foto-oxidatie levert voornamelijk koolstofdioxide en fosgeen op.
Hydrolyse van chloormethaan produceert methanol en waterstofchloride; onder neutrale of zure omstandigheden bij kamertemperatuur is dit echter verwaarloosbaar. Een sterke alkali-aanwezigheid versnelt het proces, waardoor de halfwaardetijd van chloormethaan van tientallen jaren tot slechts enkele maanden wordt teruggebracht.
Chloormethaan neemt gemakkelijk deel aan organometaalreacties met elementen zoals lithium, magnesium, zink en aluminium, waarbij verbindingen worden gevormd zoals CH3MgCl en Al(CH3)3⋅AlCl3. Deze verbindingen hebben waardevolle toepassingen in de preparatieve organische chemie en de katalyse van polymeerproductie.
Het heeft de mogelijkheid om te fungeren als een methylerend middel in talrijke chemische reacties. Het dient als reagens in de Friedel-Crafts-reactie met benzeen voor tolueensynthese en methyleert gemakkelijk hydroxylgroepen om ethers te vormen, waaronder methylcellulose uit cellulose en verschillende fenolmethylethers.
Monochloormethaan vindt ook industriële toepassing bij de productie van quaternaire methylammoniumverbindingen door reactie met tertiaire aminen en verschillende methylaminen met ammoniak.
Het Grignard-reagens methylmagnesiumchloride wordt direct gesynthetiseerd uit chloormethaan en magnesium, terwijl de Wurtz-reactie met natrium ethaan oplevert.
Een bijzonder belangrijke reactie betreft chloormethaan en silicium, waarbij methylchloorsilanen (SiCl2(CH3)2) worden geproduceerd via de Müller-Rochow-synthese. Deze silanen zijn op hun beurt belangrijke uitgangsmaterialen voor de productie van siliconen door omzetting in siloxaan-intermediaires.
Ten slotte kan chloormethaan worden omgezet in methylmercaptaan onder druk en verhoogde temperatuur met behulp van natriumwaterstofsulfide of worden getransformeerd in tetramethyllood door reactie met een mononatriumloodlegering.
3. Productie van chloormethaan
Chloormethaan wordt geproduceerd door twee hoofdmethoden: methanolhydrochlorering en substitutiechlorering van methaan.
In het methanolhydrochloreringsproces reageert methanol (CH3OH) met waterstofchloride (HCl) om monochloormethaan (CH3Cl) en water (H2O) te produceren.
CH3OH + HCl → CH3Cl + H2O
In de substitutiechlorering reageert methaan (CH4) met chloor (Cl2) om een mengsel van chloormethanen en waterstofchloride te produceren.
CH4 + Cl2 → CH3Cl + CH2Cl2 + CHCl3 + CCl4 + HCl
Veel industriële fabrieken combineren beide methoden voor een geoptimaliseerde productie. Substitutiechlorering genereert het chloormethaanmengsel en HCl. Methanolhydrochlorering verbruikt een deel van de gegenereerde HCl om meer chloormethaan te produceren en het totale HCl-verbruik te verminderen.
3.1. Productie van chloormethaan door methanolhydrochlorering
In het proces van methanolhydrochlorering wordt de hydroxylgroep (–OH) van methanol vervangen door een chlooratoom uit waterstofchloride (HCl). Deze exotherme reactie genereert monochloormethaan (CH3Cl) en water (H2O) met een warmteafgifte van 33 kJ/mol:
CH3OH + HCl → CH3Cl + H2O ⇔ (ΔH = -33 kJ/mol)
Deze reactie kan worden uitgevoerd in de damp- of vloeistoffase. Zowel katalytische als niet-katalytische methoden bestaan in de vloeistoffase, terwijl dampfaseprocessen doorgaans katalysatoren gebruiken om de reactiesnelheid te verbeteren. In de meeste industriële omgevingen wordt een overmaat aan HCl ten opzichte van methanol in de reactie-atmosfeer gehandhaafd om de conversie naar monochloormethaanproductie te stimuleren.
3.1.1. Gasfasehydrochloreringsproces
Het gasfase hydrochloreringsproces gebruikt een vaste zure katalysator onder gecontroleerde druk (0,3–0,6 MPa) en temperatuur (280–350°C). Deze omzetting van methanol naar monochloormethaan vindt plaats via een Eley–Rideal-mechanisme, waarbij gechemisorbeerde methanol reageert met gasfase HCl op het katalysatoroppervlak.
De hoge selectiviteit (0,2–1% dimethylether als bijproduct) wordt toegeschreven aan de overvloed aan zure plekken die de gewenste reactie bevorderen en concurrerende dehydratie tot dimethylether onderdrukken.
Veelvoorkomende katalysatoren zijn zinkchloride, koperchloride en aluminiumoxide, vaak ondersteund op dragers zoals koolstof of silica. γ-aluminiumoxide is een veelvoorkomende industriële keuze. Studies hebben de kinetiek, veroudering en regeneratie van deze katalysatoren onderzocht.
De reactie vertoont een eerste-orde afhankelijkheid van HCl, maar minimale afhankelijkheid van methanoldruk. Met name de snelheidsconstante correleert met het oppervlak en hogere temperaturen introduceren beperkingen vanwege poriediffusie.
Verse katalysator bindt aanvankelijk chloor, waardoor zure plekken worden gevormd voor methanoladsorptie. Porie-diffusie beperkt de opname van chloor, wat leidt tot de aanwezigheid van oxide- en oxidehydraatplaatsen.
Katalysatorveroudering wordt voornamelijk veroorzaakt door koolstofafzetting van nevenreacties en poriënblokkering, terwijl sinteren het actieve oppervlak bij hoge temperaturen vermindert.
Hoogzuivere grondstoffen, waaronder technisch zuivere methanol en schoon HCl, zijn cruciaal voor het minimaliseren van nevenreacties en het verlengen van de levensduur van de katalysator. Als HCl afkomstig is van een aangrenzend chloreringsproces, is er een rigoureuze zuivering nodig om resterende chloormethanen te verwijderen.
Typische gasfasereactoren gebruiken talrijke dunne nikkelbuizen die zijn gevuld met katalysator. Efficiënte warmteoverdracht is essentieel vanwege de exotherme aard van de reactie.
Een vereenvoudigd stroomdiagram (Figuur 1) illustreert het proces:
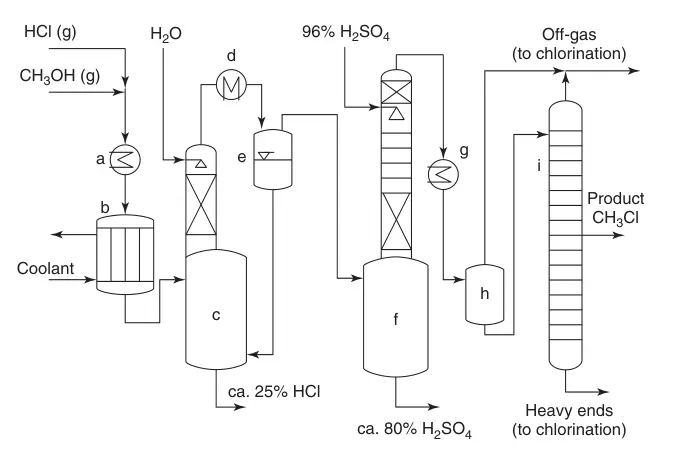
(a) Warmtewisselaars; (b) Meervoudige buizenreactor; (c) Koeling van de productstroom met water en absorptie van overtollig HCl; (d) Condensatie; (e) Blussysteem; (f) Verwijdering van water; (g) CH3Cl-condensatie; (h) Tussentijdse taak; en (i) Zuivering van monochloormethaan
- Mengen en verwarmen: HCl en methanol worden gemengd, verwarmd en aan de reactor toegevoerd.
- Conversie en blussen: Het katalysatorbed drijft de conversie aan, waarbij overtollig HCl de gewenste productvorming bevordert en dimethylether onderdrukt. Het reactiegas wordt geblust met water, waardoor overtollig HCl wordt geabsorbeerd.
- HCl-absorptie en koeling: De productstroom gaat door een koeler, condenseert water en absorbeert meer HCl. De teruggewonnen HCl wordt gerecycled, terwijl het water-HCl-mengsel een downstream-zuivering ondergaat voor methanolwinning.
- Dimethyletherverwijdering: De productstroom gaat een zwavelzuurkolom in om dimethylether en restwater te verwijderen. Het verbruikte zuur kan worden gebruikt bij de productie van meststoffen of bij de splitsing van zwavelzuur.
- Condensatie en destillatie van chloormethaan: Droog, ruw chloormethaan wordt gecondenseerd en verder gezuiverd via een hogedrukdestillatiekolom. De gasvormige overhead en destillatieresidu kunnen worden gerecycled.
Dit proces bereikt een hoge opbrengst op basis van methanol van ongeveer 99%.
3.1.2. Vloeistoffasehydrochloreringsproces
Methanolhydrochlorering tot chloormethaan kan in de vloeistoffase plaatsvinden, katalytisch of niet-katalytisch. Beide methoden omvatten een bimoleculair nucleofiel substitutiemechanisme:
- Protonering: De eerste stap omvat protonering van de alcohol door HCl, waardoor een positief geladen tussenproduct ontstaat. (ROH + HCl → ROH2+ + Cl–)
- Nucleofiele aanval: In de tweede stap valt een chloride-ion de geprotoneerde alcohol aan, wat leidt tot bindingssplitsing en de vorming van het gewenste product. (ROH2+ + Cl–) → [𝛿−Cl · · · R · · · 𝛿+OH2] → RCl + H2O
1. Katalytisch proces
De typische katalytische methode maakt gebruik van een geroerde reactor gevuld met een waterige metaalchlorideoplossing, vaak ZnCl2 (70–80 gew.%), en vervolgens worden methanol en HCl-gas of zoutzuur in de reactor gevoerd.
2. Niet-katalytisch proces
Het niet-katalytische proces, ontwikkeld door Shin-Estu en Dow, werkt bij lagere temperaturen en drukken vergeleken met de katalytische methode, waardoor de vorming van dimethylether als bijproduct wordt geminimaliseerd. Hoewel er niet-katalytische varianten in de gasfase bestaan, domineert het proces in de vloeistoffase industriële toepassingen.
Het niet-katalytische proces van Dow maakt gebruik van een kokendbedreactor die onder superatmosferische druk (7–21 bar) wordt gehouden om het reactiemedium vloeibaar te houden op de gewenste temperatuur (≥ 50 °C, bij voorkeur 100–180 °C). Methanol en ten minste een molaire overmaat van 10% HCl worden in de reactor gevoerd. De dampvormige producten komen vervolgens in een rectificerende toren terecht, waar:
- Eerst wordt waterdamp gebonden aan het refluxproduct, dat rijk is aan HCl, waardoor het product effectief wordt gedroogd.
- Vervolgens reageert overtollig HCl met alle dimethylether die in de reactor wordt gegenereerd, waardoor dit ongewenste bijproduct wordt geminimaliseerd.
3.2. Chloormethaan als bijproduct
Chloormethaan wordt gegenereerd als een coproduct bij de productie van siliconen door kopergekatalyseerde methanolhydrochlorering van SiCl2(CH3)2. Het wordt gewonnen uit Si(OH)2(CH3)2 en vervolgens opnieuw geïntroduceerd in het proces van silaanvorming, bekend als Müller-Rochow-synthese.
4. Toepassingen van chloormethaan
Chloormethaan staat bekend om zijn gebruik als grondstof voor verdere chlorering tot dichloormethaan en trichloormethaan. Het primaire industriële gebruik ervan is echter de productie van siliconen, waaronder vloeistoffen, elastomeren en harsen.
Deze materialen worden op grote schaal gebruikt in verschillende sectoren, van antischuimmiddelen in industriële processen tot consumentenproducten zoals coatings, kitten en zelfs persoonlijke verzorging.
Chloormethaan wordt gebruikt bij de synthese van cellulose-ethers. Deze gemodificeerde cellulosederivaten, zoals methylcellulose, hydroxypropylmethylcellulose (HPMC) en hydroxyethylmethylcellulose (HEMC), dienen als verdikkings-, emulgator- en geleermiddelen in een veelheid aan toepassingen. Van bouwmaterialen en cosmetica tot voedsel en farmaceutica, ze verbeteren de functionaliteit en stabiliteit van producten.
De methylerende eigenschappen van monochloormethaan maken het een essentieel reagens bij de productie van kationische polymeren. Deze polymeren worden op grote schaal gebruikt in waterbehandeling voor verschillende doeleinden, waaronder flocculatie, coagulatie en slibontwatering.
Het draagt ook bij aan de synthese van quaternaire ammoniumverbindingen (quats), die worden gebruikt als wasverzachters en organo-gemodificeerde kleien voor olie- en gasboringen, in gewasbeschermingsmiddelen en in kationische polymeren die worden gebruikt bij waterbehandeling.
Hoewel het gebruik ervan in koelsystemen in ontwikkelde landen is geannuleerd vanwege veiligheidszorgen, blijft chloormethaan essentieel in specifieke industriële processen. Het dient als een cryogeen oplosmiddel bij de productie van butylrubber en in laboratoriumomgevingen.
Het is belangrijk om op te merken dat het opnieuw introduceren van chloormethaan in op aluminium gebaseerde koelunits een aanzienlijk veiligheidsrisico vormt. De langzame Grignard-achtige reactie met aluminium kan leiden tot explosies met mogelijk fatale gevolgen.
Op dezelfde manier is het gebruik van monochloormethaan voor de productie van brandstof-antiklopmiddelen zoals tetraethyllood en tetramethyllood grotendeels stopgezet vanwege zorgen over het milieu en de gezondheid.
Monochloormethaan blijft echter relevant bij de productie van organometaalverbindingen zoals methyllithium, methylmagnesiumchloride, trimethylaluminium en methyltinverbindingen.
Deze verbindingen zijn essentiële tussenproducten in de fijnchemische synthese en krachtige katalysatoren in verschillende polymerisatiereacties. Bovendien vindt trimethylaluminium toepassing in chemische dampdepositie, waardoor dunne films van zeer resistent en diëlektrisch aluminiumoxide op verschillende substraten kunnen worden gecreëerd.
5. Toxicologie van chloormethaan
Chloormethaan is een geurloos gas, wat betekent dat de primaire blootstellingsroute inademing is, wat unieke veiligheidsrisico’s met zich meebrengt. De impact ervan op het centrale zenuwstelsel (CZS) is goed gedocumenteerd, met zowel dierstudies als gevallen van blootstelling bij mensen die wijzen op potentieel letsel en zelfs overlijden.
Overmatige blootstelling aan chloormethaan veroorzaakt symptomen die lijken op die van alcoholvergiftiging, waaronder loopstoornissen, onsamenhangendheid, desoriëntatie en persoonlijkheidsveranderingen. Deze effecten kunnen langer duren dan bij alcohol, zelfs permanent in ernstige gevallen. Interessant is dat menselijke vrijwilligers die 2 uur lang aan 10 ppm werden blootgesteld, geen irritatie of CZS-effecten ondervonden.
Reproductieve en ontwikkelingstoxiciteit: Overmatige blootstelling bij mannelijke ratten heeft invloed op de testikels, terwijl ontwikkelingstoxiciteit en mogelijke cardiale effecten die bij dieren worden waargenomen, als minder relevant voor mensen worden beschouwd vanwege hogere blootstellingsniveaus.
Chloormethaan vertoont in vitro zwakke mutagene eigenschappen; echter, in vivo bewijs voor genotoxiciteit verschijnt alleen bij hoge, reeds toxische concentraties.
Twee jaar durende carcinogeniciteitsstudies bij knaagdieren onthulden alleen niertumoren bij mannelijke muizen bij het hoogste blootstellingsniveau (1000 ppm); dit is waarschijnlijk gekoppeld aan herhaalde orgaanbeschadiging. Het Internationaal Agentschap voor Kankeronderzoek (IARC) classificeert het als “niet classificeerbaar wat betreft carcinogeniciteit voor mensen (Groep 3)”.
Blootstellingslimieten en veiligheid: Herhaalde dosisstudies bij dieren suggereren een No Observed Adverse Effect Concentration (NOAEC) van meer dan 150 ppm. Grenzen voor beroepsmatige blootstelling (OEL’s) variëren wereldwijd, meestal tussen 20 en 100 ppm.
Referentie
- Chloormethanen; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_233.pub4
