Benzalchloride: eigenschappen, productie en toepassingen
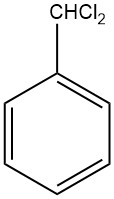
Wat is Benzalchloride?
Benzalchloride, ook bekend als dichloormethylbenzeen, α,α-dichloortolueen of benzylideenchloride, is een organische verbinding met de chemische formule C6H5CHCl2. Het is een kleurloze vloeistof die wordt gesynthetiseerd door de zijketen van tolueen te chloreren.
De eerste synthese van benzalchloride werd in 1848 gerapporteerd door A. Cahours, die benzaldehyde liet reageren met fosforpentachloride (PCl5).
Inhoudsopgave
1. Fysieke eigenschappen van benzalchloride
Benzalchloride is een kleurloze vloeistof met een scherpe geur. Wanneer het wordt blootgesteld aan vochtige lucht, geeft het dampen af en kan het sterke irritatie aan slijmvliezen en ogen veroorzaken. De fysieke eigenschappen zijn als volgt:
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht | 161,03 g/mol |
| Smeltpunt | -16,2°C |
| Kookpunt | 205,2°C |
| Dichtheid bij 20°C | 1,2536 g/cm³ |
| Dampspanning bij 20°C | 0,6 kPa |
| Breukindex | 1,5503 |
| Oppervlaktespanning (σ) bij 20°C | 40,1 mN/m |
| Dynamische viscositeit (η) bij 20°C | 2,104 mPa s |
| Soortelijke warmte bij 25°C | 222 J mol⁻¹ K⁻¹ |
| Verdampingswarmte bij 72°C | 50,4 kJ/mol |
| Eigenschap | 0°C | 20°C | 30°C | 57°C | 79°C | 135°C |
|---|---|---|---|---|---|---|
| Dichtheid | 1,2691 | 1,2536 | 1,2417 | 1,2122 | 1,1877 | 1,1257 |
| Dampspanning | 0,0 | 0,6 | 0,8 | 1,3 | 1,9 | 4,0 |
| Breukindex | 1,5499 | 1,5503 | 1,5506 | 1,5513 | 1,5523 | 1,5542 |
| Oppervlaktespanning | 40,4 | 40,1 | 39,8 | 38,9 | 38,2 | 36,4 |
| Dynamische viscositeit | 2,12 | 2,104 | 2,089 | 2,058 | 2,023 | 1,948 |
Benzalchloride kan verschillende azeotrope mengsels vormen, waarvan de voorbeelden in Tabel 2 staan vermeld.
| Component | kookpunt, °C | Benzalchloride, gew. % |
|---|---|---|
| Isoamyllactaat | 201 | 45 |
| n-Octanol | 195 | ca. 10 |
| Kamfer | 210 | 25 |
| Acetamide | 191 | 85 |
| Capronzuur | 199 | 64 |
Benzalchloride is oplosbaar in ethanol, di-ethylether, chloroform en koolstoftetrachloride, maar de oplosbaarheid in water is beperkt (0,05 g/l bij 5 °C en 0,25 g/l bij 39 °C).
In ethanolische en waterige oplossingen kunnen alcoholyse- of hydrolysereacties optreden.
De oplosbaarheid van chloor in 100 g benzalchloride varieert met de temperatuur, namelijk 6,2 g bij 30 °C, 4,3 g bij 50 °C en 1,5 g bij 100 °C.
2. Chemische reacties van benzalchloride
Benzalchloride kan worden omgezet in benzotrichloride door chloreringsmiddelen.
In aanwezigheid van Lewiszuren produceert chlorering van de aromatische ring chloorbenzalchloriden, die isomere verbindingen zijn.
Benzaldehyde wordt geproduceerd wanneer benzalchloride wordt gehydrolyseerd onder zure of alkalische omstandigheden.
Benzalchloride kan worden gepolymeriseerd in aanwezigheid van verbindingen zoals AlCl3 en FeCl3.
Natriummetaal kan benzalchloride omzetten in stilbeen.
3. Productie van benzalchloride
Benzalchloride wordt geproduceerd door de zijketen van tolueen te chloreren. Hetzelfde proces en dezelfde fabrieksconfiguratie worden gebruikt om benzylchloride en benzotrichloride te produceren.
De molaire chloor-tot-tolueenverhouding moet echter worden aangepast om optimale opbrengsten te bereiken. De hoogkokende bijproductfractie die wordt verkregen tijdens de productie van benzylchloride bestaat voornamelijk uit benzalchloride en benzylchloride.
Deze bijproductfractie kan worden gerecycled bij de synthese van benzalchloride. Als gevolg hiervan zijn de productie van benzalchloride en benzylchloride nauw met elkaar verweven en worden ze vaak tegelijkertijd uitgevoerd in dezelfde productiefaciliteit.
4. Toepassingen van benzalchloride
Benzalchloride wordt voornamelijk gebruikt om benzaldehyde en kaneelzuur te produceren. Het kan worden gehydrolyseerd in aanwezigheid van water bij temperaturen boven 100 °C, met behulp van alkalische of zure middelen. Friedel-Crafts-katalysatoren zijn effectieve katalysatoren voor deze reactie.
Ze kunnen ook worden gebruikt voor mengsels die zowel benzylchloride als benzalchloride bevatten. In deze gevallen wordt gezegd dat benzylchloride onveranderd blijft en alleen benzaldehyde wordt geproduceerd.
Dit proces is echter mogelijk niet commercieel levensvatbaar vanwege de bijna identieke kookpunten van benzylchloride en benzaldehyde. De scheiding van deze twee verbindingen door middel van fractionele destillatie zou onbetaalbaar duur zijn.
5. Toxicologie van benzalchloride
Benzalchloride is een kleurloze vloeistof met een scherpe geur. Het geeft dampen af bij blootstelling aan vochtige lucht en kan irritatie aan de ogen, huid en slijmvliezen veroorzaken.
De beschikbare gegevens over de toxiciteit van benzalchloride geven aan dat het minder toxisch is dan benzylchloride. De acute orale toxiciteit (LD50) van benzalchloride bij ratten en muizen is respectievelijk 3250 mg/kg en 2460 mg/kg.
De inhalatietoxiciteit van benzalchloride is ook lager dan die van benzylchloride, met een LC50 (blootstelling gedurende 2 uur) van 400 mg/m³ bij ratten en 210 mg/m³ bij muizen.
Benzalchloride staat bekend als mutageen en is in verband gebracht met de ontwikkeling van huidtumoren en longadenomen bij muizen. Er zijn echter geen afzonderlijke onderzoeken naar de carcinogene effecten van benzalchloride bij mensen.
Daarom is het door het Internationaal Agentschap voor Kankeronderzoek (IARC) geclassificeerd als een carcinogeen van groep 2B (bewijs van toereikendheid bij dieren, onvoldoende gegevens bij mensen) en als een carcinogeen van categorie 2 door de Duitse Onderzoeksstichting (DFG).
Referentie
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
