Ammoniumchloride: eigenschappen, productie en toepassingen

Wat is ammoniumchloride?
Ammoniumchloride is een chemische verbinding met de formule NH4Cl. Het bestaat als een witte kristallijne vaste stof met een karakteristieke zoute smaak en staat algemeen bekend als salmiak.
Ammoniumchloride komt van nature voor in vulkanisch materiaal, maar de extractie ervan uit natuurlijke bronnen is van minimaal belang. De industriële productie van NH4Cl is nauw verbonden met de vooruitgang van de soda-industrie en de grootschalige synthese van synthetische NH3.
Oorspronkelijk bedoeld voor gebruik als meststof, vindt ammoniumchloride nu toepassingen in uiteenlopende vakgebieden. De productieprocessen ervan zijn van bijzonder belang voor chemische technologie vanwege hun historische betekenis als een vroeg voorbeeld van chemische verwerking met alle drie de fasen: vast, vloeibaar en gas.
Inhoudsopgave
1. Eigenschappen van ammoniumchloride
De molaire massa van ammoniumchloride is 53,49 g/mol en het is een vaste stof met een soortelijke dichtheid van 1,530 bij 20 °C. De gemiddelde soortelijke warmte, cp, tussen 298 K en 372 K, wordt gemeten op 1,63 kJ/kg. Ammoniumchloride heeft twee reversibele kristallijne vormen, waarbij de transformatie tussen hen plaatsvindt bij 457,6 K (184,5 °C).
De stabiele vorm bij kamertemperatuur is de α-vorm, terwijl de β-NH4Cl (kubieke; NaCl-type) smelt bij 793,2 K onder 3,45 MPa en sublimeert bij atmosferische druk. Bij lagere temperaturen is NH4Cl relatief vluchtig en valt het uiteen in NH3 en HCl.
De oplosbaarheid van NH4Cl in water neemt toe met stijgende temperatuur. De integrale warmte van oplossing tot verzadiging is +15,7 kJ/mol en de differentiële warmte van oplossing bij verzadiging is +15,2 kJ/mol.
De toevoeging van ammoniak kan de oplosbaarheid in water verbeteren, terwijl de aanwezigheid van NaCl de neiging heeft om NH4Cl uit ammoniakale oplossingen te laten neerslaan. NH4Cl vertoont ook zwakke hygroscopische eigenschappen.
Vocht kan productklontering veroorzaken en het is onzeker of vochtgehaltes lager dan 0,1 gew.% alleen verantwoordelijk zijn voor ammoniumchlorideklontering. Sublimatie zou een andere mogelijke verklaring voor dit fenomeen kunnen zijn.
Ammoniumchloride is zeer oplosbaar in vloeibare NH3, maar vrijwel onoplosbaar in aceton en pyridine. Bij 292,7 K vertoont het een oplosbaarheid van 3,24 gew.% in methanol en 0,64 gew.% in ethanol.
De kristalvorm verkregen uit waterige oplossingen van NH4Cl kan worden beïnvloed door andere stoffen, wat is benut om grote kristallen te produceren en helpt bij het identificeren van onzuiverheden tijdens de NH4Cl-productie.
2. Productie van ammoniumchloride
Commerciële productie van ammoniumchloride omvat twee primaire processen:
1. Gewijzigd Solvay-proces (ammoniak-soda-asproces of ASAP): Dit is een van de meest gebruikte methoden voor commerciële NH4Cl-productie. Het omvat de reactie tussen ammoniak en soda-as (natriumcarbonaat) om ammoniumbicarbonaat te produceren, dat vervolgens door verhitting wordt omgezet in ammoniumchloride.
2. Directe reactie tussen HCl en NH3: In dit proces wordt ammoniumchloride direct gevormd door de reactie tussen zoutzuur en ammoniak.
Daarnaast is er een derde proces dat bekend staat als de reactie van reciproke paren zouten, dat nog steeds interessant is vanuit een wetenschappelijk perspectief, maar het is nog niet commercieel toegepast voor de productie van ammoniumchloride.
2.1. Productie van ammoniumchloride door gemodificeerd Solvay-proces (ammoniak-soda-as)
In het Solvay-proces wordt de productie van ammoniumchloride en natriumcarbonaat bereikt door een reeks reacties. Ammoniak en koolstofdioxide worden opgelost in een waterige oplossing van natriumchloride, wat resulteert in de vorming van matig oplosbaar natriumbicarbonaat.
Dit natriumbicarbonaat wordt vervolgens verhit (gecalcineerd) om natriumcarbonaat te verkrijgen. Ammoniak wordt gewonnen uit de resterende vloeistof (moederloog) door het te laten reageren met kalk, wat ook calciumchloride genereert.
De primaire bronnen van kalk en koolstofdioxide zijn kalksteen. De algehele reactie omvat de omzetting van steenzout en kalksteen in natriumcarbonaat en calciumchloride als bijproducten.
Om verliezen van de fabriek te compenseren, worden alleen de benodigde hoeveelheden water, koolstofdioxide en ammoniak toegevoegd. De keuze van de grondstof en de resulterende producten bepalen de locatie van een Solvay-fabriek, waardoor deze fabrieken grotendeels onafhankelijke eenheden worden.
Het gemodificeerde Solvay-proces, bekend als het ammoniumchloride-soda-asproces, is een vroeg voorbeeld van geïntegreerde industriële productie waarbij twee stoffen betrokken zijn. Bij dit aangepaste proces wordt ammoniumchloride ook uit de moederloog neergeslagen. De algehele reactie voor dit proces is:
2 NH3 + CO2 + H2O + 2 NaCl → 2 NH4Cl + Na2CO3
De hoeveelheden geproduceerd ammoniumchloride en soda zijn vrijwel gelijk: twee mol (107 g) NH4Cl worden gegenereerd voor elke mol (106 g) Na2CO3. Het aangepaste proces vereist externe NH3 en CO2 en moet worden geïntegreerd in een systeem van onderling verbonden installaties.
Bovendien wordt de behandeling van ammoniakhoudende afvalgassen uitgevoerd voor milieudoeleinden, in plaats van alleen om NH3– en CO2-verliezen te verminderen. De energiebalans in het aangepaste proces verschilt aanzienlijk van die in het traditionele Solvay-proces vanwege de verschillende grondstoffen en producten die erbij betrokken zijn.
2.1.1. Procesbeschrijving
In the manufacturing process of NH4Cl and Na2CO3, a continuously operated recycle process is used, with the concentrations adjusted based on whether ammonium chloride or sodium carbonate is the primary product. It was initially developed by BASF this process focuses on NH4Cl as the primary product (Figure 1).
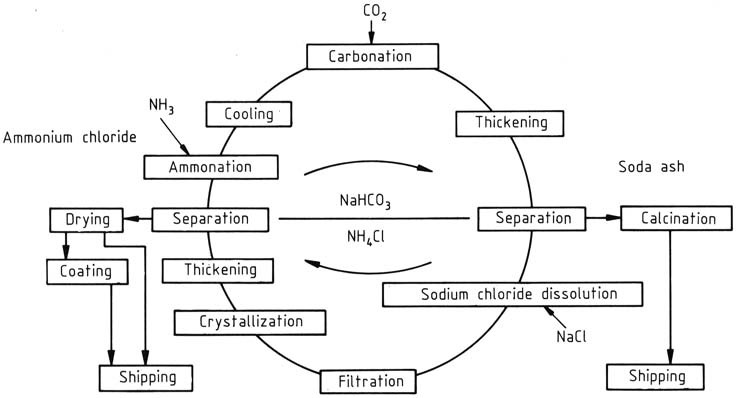
De cyclus begint met de toevoeging van ammoniak en koolstofdioxide aan een waterige recycleoplossing. Het gevormde ammoniumbicarbonaat reageert verder met natriumchloride in de oplossing, wat leidt tot de vorming van ammoniumchloride en matig oplosbaar natriumbicarbonaat. Dit laatste wordt gescheiden en gewassen met een centrifuge en vervolgens gecalcineerd om natriumcarbonaat te produceren.
Het verhitten van het resterende natriumbicarbonaat in de moederloog tot 337,2 K ontleedt het. Het zeer oplosbare natriumcarbonaat verstoort de kristallisatie van ammoniumchloride niet.
De hoge temperatuur van de oplossing wordt gebruikt om steenzoutgrondstof snel op te lossen, geïntroduceerd via mengtanks, waarbij de hoeveelheid wordt aangepast op basis van de materiaalbalans over de hele cyclus.
Onoplosbare onzuiverheden, zoals sulfaten, ijzer-, calcium- en magnesiumzouten, worden eruit gefilterd. De verwijdering van residuen, een toenemende zorg, wordt aangepakt door zuiverder zout als grondstof te gebruiken in plaats van steenzout.
Ammoniumchloride wordt gewonnen door twee-fase kristallisatie met behulp van indirecte koeling. De resulterende suspensie uit de kristallisator wordt verdikt in hydrocyclonen en de vaste stof wordt gescheiden en gewassen in een centrifuge.
De vaste stof met ongeveer 5 – 7 gew.% watergehalte wordt vervolgens gedroogd in een huidige droger om het vochtgehalte te verlagen tot minder dan 0,1%. Het eindproduct kan een antiklontermiddelcoating krijgen. Na verwijdering van ammoniumchloride is de cyclus voltooid en kan de moederloog worden hergebruikt.
Asahi Glass heeft een alternatief proces ontwikkeld dat soda-as produceert als primair product. In dit proces wordt ammoniak toegevoegd aan de moederloog vóór de kristallisatie van ammoniumchloride. Gemalen ruw zout kan worden toegevoegd met of zonder wassen en wordt opgelost in de oplossing.
Het afkoelen van de oplossing tot onder 20 °C veroorzaakt ammoniumchloridekristallisatie. De kristallen worden gescheiden met behulp van een centrifugaalscheider en de moederloog wordt gerecycled naar de carbonatatiesectie. Ammoniumchloridekristallen worden gedroogd om het vochtgehalte te verlagen tot minder dan 0,3% in een roterende of gefluïdiseerde beddroger. De grootte van de kristallen kan voor verschillende toepassingen worden geregeld.
In het carbonatatiegedeelte wordt de oplossing in een carbonatatietoren geleid, waar natriumbicarbonaat neerslaat door reactie met koolstofdioxide bij 30 – 40 °C.
De resulterende slurry wordt gescheiden in natriumbicarbonaatkristallen en de moederloog. De moederloog wordt naar de ammoniakabsorptiesectie geleid. De gescheiden kristallen worden gecalcineerd en omgezet in dichte soda-as.
Het Asahi Glass-proces omvat alle stappen van het BASF-proces zoals weergegeven in Figuur 1 met een andere volgorde. Ammoniak wordt toegevoegd na de scheiding van natriumbicarbonaat. De warmte die vrijkomt tijdens de toevoeging van ammoniak levert de energie die nodig is om het resterende natriumbicarbonaat te ontleden.
Hoewel er energiebesparingen worden waargenomen door deze aanpak, compenseert de hogere energievraag in de kristallisatiefase enkele van de voordelen, omdat ammoniumchloride beter oplosbaar is in ammoniakrijke oplossingen.
Het proces kan een wasstap omvatten voor de steenzouttoevoer vóór oplossing om de noodzaak van filtratie vóór kristallisatie te elimineren. Met of zonder wassen maximaliseert dit proces het gebruik van ruw zout, een belangrijke overweging in Japan waar zout geïmporteerd moet worden.
2.1.2. Verontreinigingsproblemen
Verontreinigingsproblemen gerelateerd aan de werking van de fabrieken zijn niet ernstig en kunnen effectief worden beheerd door zorgvuldige bediening. Met de juiste maatregelen kan de productie van afvalwaterstromen aanzienlijk worden verminderd, zo niet volledig worden geëlimineerd. Echter, elk afvalwater dat wordt geproduceerd vanwege het hoge ammoniakgehalte, vereist een geschikte behandeling.
Om gasvormige emissies aan te pakken, is een praktische oplossing het wassen van afvalgassen met zoutzuur, wat resulteert in de productie van extra ammoniumchloride.
Meestal worden hoge ammoniakconversies van ongeveer 98% en steenzoutconversies van ongeveer 95% bereikt, hoewel de exacte waarden kunnen variëren afhankelijk van het specifieke procestype en de geïmplementeerde milieumaatregelen. Deze aanpak helpt gasvormige emissies te minimaliseren en draagt bij aan de algehele ecologische duurzaamheid van het productieproces.
2.1.3. Kwaliteiten en capaciteit
In 1997, nadat verschillende productiefaciliteiten waren gesloten vanwege de verminderde vraag op de markt, was de geschatte capaciteit voor NH4Cl-productie door het aangepaste Solvay-proces in het westelijk halfrond en Japan ongeveer 100.000 ton per jaar.
In Azië is de productie van een korrelig product met meer dan 97% NH4Cl-gehalte gebruikelijk. Deze NH4Cl van meststofkwaliteit bevat doorgaans meer dan 25 gew.% ammoniakstikstof. Deze fabrieken richten zich voornamelijk op de productie van soda-as, waarbij NH4Cl een bijproduct is.
Als de primaire interesse echter NH4Cl-productie is, kan het proces worden aangepast om hogere zuiverheden te bereiken. Zuiverheidsniveaus van meer dan 99,7 gew.% NH4Cl, met minder dan 0,25 gew.% NaCl en minder dan 3 ppm Fe, kunnen worden bereikt, wat geschikt is voor de meeste industriële doeleinden.
Voor speciale toepassingen die NH4Cl van reagenskwaliteit vereisen, is grootschalige productie mogelijk met behulp van specifieke bedrijfstechnieken zonder dat er extra verwerkingsstappen nodig zijn.
Ammoniumchloride van reagenskwaliteit met minder dan 0,01 gew.% NaCl en dat voldoet aan de ACS (American Chemical Society)-specificatie kan worden verkregen. Deze NH4Cl van hogere zuiverheid is geschikt voor toepassingen die uitzonderlijke kwaliteit en precisie in chemische processen vereisen.
2.2. Productie van ammoniumchloride door directe reactie tussen HCl en NH3
De synthese van NH4Cl uit HCl en NH3 kan economisch voordelig zijn, vooral wanneer HCl als grondstof beschikbaar is tegen lage of geen kosten.
Het Engeclor-proces, ontwikkeld door het Braziliaanse bedrijf Engeclor, voert de reactie uit in een waterige oplossing. Ammoniak wordt in het conische gedeelte van een verzadiger gebracht, terwijl HCl, verdund met lucht, in de NH4Cl-suspensie wordt geleid.
De reactie vindt plaats bij 353 K onder verlaagde druk, met een overmaat NH3 om een pH van 8 te handhaven. De resulterende suspensie wordt uit de basis van de verzadiger gehaald, ingedikt met behulp van hydrocyclonen, en NH4Cl wordt in een centrifuge van het mengsel gescheiden en vervolgens gedroogd.
De moederloog wordt teruggevoerd naar de verzadiger. Om emissies te beheersen, worden afvalgassen uit de verzadiger gewassen met water.
Er zijn alternatieve schema’s voorgesteld waarbij gasvormige grondstoffen worden geïntroduceerd in niet-waterige oplosmiddelen. In deze gevallen wordt de reactiewarmte (-176 kJ/mol) verwijderd door de oplosmiddelen te verdampen, die vervolgens worden gecondenseerd.
Er zijn ook enkele wervelbedprocessen voor dit doel beschreven. Om aerosolvorming te voorkomen, wordt koolstofdioxide voorgesteld als dragergas in wervelbedden.
De geschatte wereldwijde jaarlijkse productie van NH4Cl door het HCl-NH3-proces was 50.000 ton in 1997. Ammoniumchloride dat met deze methode wordt geproduceerd, bevat minder dan 0,1 gew.% NaCl.
Het metaalgehalte, met name het gehalte aan zware metalen, kan variëren afhankelijk van de specifieke fabriek. Over het algemeen zijn de metaalgehaltes in NH4Cl die door dit proces worden geproduceerd, hoger dan die in het aangepaste Solvay-proces.
2.3. Reactie van wederkerige paren zouten
De reactie van wederkerige paren zouten blijft een interessante methode. Enkele geschikte paren zouten omvatten (NH4)2SO4 – KCl, wat resulteert in de vorming van NH4Cl – K2SO4 en (NH4)2SO4 – NaCl, wat leidt tot de productie van NH4Cl – Na2SO4.
De uitdaging met deze zoutparen is de lagere zuiverheid van NH4Cl vanwege het relatief hoge sulfaatgehalte. NH4Cl en KNO3 kunnen worden verkregen door de reactie van NH4NO3 en KCl. KNO3 met een hoge zuiverheid kan worden gebruikt bij de productie van explosieven, terwijl NH4Cl met een minimale zuiverheid van 96% geschikt is als meststof.
Bovendien is de bereiding van NaNO3 en NH4Cl uit NaCl en NH4NO3 onderwerp van onderzoek geweest. Dit proces onderzoekt de mogelijkheid om deze twee zouten te verkrijgen uit hun respectievelijke precursorzouten.
3. Toepassingen van ammoniumchloride
Ammoniumchloride vindt uitgebreide landbouwkundige en industriële toepassingen:
3.1. Landbouwgebruik
In Japan, China en Zuidoost-Azië wordt ammoniumchloride veel gebruikt als een zeer effectieve stikstofmeststof voor rijst en hooglandrijst, tarwe en verschillende andere gewassen.
In Japan wordt een aanzienlijk deel van de jaarlijkse NH4Cl-productie gebruikt voor hoogwaardige samengestelde meststoffen, zoals chloorammoniumfosfaat, chloorkalium-ammoniumfosfaat, magnesia-chloorkalium-ammoniumfosfaat en stikstofkaliummengsels. Het gebruik ervan als meststof is echter beperkt vanwege de zuurgraad en het hoge chloorgehalte.
3.2. Industrieel gebruik
Technische kwaliteit ammoniumchloride wordt gebruikt in verschillende industriële toepassingen:
- Vaste elektrolyten: Het dient als een essentieel onderdeel in droge celbatterijen.
- Groeiende explosieven: Een fijne vorm van ammoniumchloride wordt gebruikt als onderdeel in explosieven voor groeven.
- Harders voor lijmen: Het fungeert als een verhardingsmiddel in op formaldehyde gebaseerde lijmen.
- Etsoplossingen: Ammoniumchloride wordt, samen met andere chemicaliën, gebruikt bij de productie van printplaten.
- Vloeimiddelen bij het plateren: Het is een onderdeel, samen met zinkchloride, in vloeimiddelen die worden gebruikt voor het plateren van tin en zink.
- Fotografie: Het dient als een snelle fixeeradditief in fotografie.
- Reinigingsadditieven: Ammoniumchloride wordt gebruikt als additief in schoonmaakproducten.
- Voedingsstof in gistculturen: Het wordt gebruikt als voedingsstof in gistculturen voor verschillende toepassingen.
- Looien: In de looi-industrie vindt ammoniumchloride toepassingen.
- Raffinage van edele metalen: Het wordt gebruikt in het raffinageproces van edele metalen.
- Textiel bedrukken en verven: Ammoniumchloride wordt gebruikt bij het bedrukken en verven van textiel.
- Rubberindustrie: Het vindt toepassingen in de rubberindustrie.
- Tegels en bakstenen: Ammoniumchloride kan worden toegevoegd aan tegels en bakstenen voor het bakken om de porositeit te beheersen en het bakproces te versnellen.
3.3. Toepassingen met hoge zuiverheid
Ammoniumchloride met hoge zuiverheid wordt gebruikt in de voedings- en farmaceutische industrie, evenals in specifieke chemische syntheses.
Het is vermeldenswaard dat het gebruik van NH4Cl als verharder voor formaldehyde-gebaseerde lijmen aanzienlijk is afgenomen vanwege de vervanging ervan door chloridevrije producten.
Referenties
- Ammoniumverbindingen; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Proces van het maken van ammoniumchloride. – https://patents.google.com/patent/US2133513A/en
