Acetyleen: Eigenschappen, Reacties en Toxicologie
Wat is acetyleen?
Acetyleen, ook bekend als ethyn, is een kleurloos, ontvlambaar gas met de chemische formule C2H2. Het is de eenvoudigste koolwaterstof met een drievoudige binding. Het wordt veel gebruikt als brandstof bij oxy-acetyleenlassen en -snijden vanwege de ongelooflijk hete vlam, en als chemische bouwsteen voor verschillende organische chemicaliën en kunststoffen.
Acetyleen was de primaire bouwsteen voor industriële organische chemie voordat olie wijdverbreid werd aangenomen als belangrijkste grondstof. Het calciumcarbide-proces domineerde uitsluitend de acetyleenproductie tot de jaren 40, toen thermische kraakmethoden met behulp van methaan en andere koolwaterstoffen ontstonden.
De eerste implementaties maakten gebruik van elektrische bogen, maar in de jaren 50 werden gedeeltelijke oxidatie- en regeneratieve processen ontwikkeld.
Ondanks veelbelovende initiatieven zoals het ondergedompelde vlamproces van BASF, het HTP van Hoechst en het plasmaproces van Hüls, bleef de trend richting ethyleen als fundamentele chemische stof onverminderd.
Alle acetyleenprocessen, inclusief carbidemethoden, zijn energie-intensief en vereisen aanzienlijke warmtegeneratie en -overdracht. Ze verschillen voornamelijk in de manier waarop deze energie wordt gegenereerd en toegepast.
- Voor een compleet artikel over de industriële productie van acetyleen, zie het volgende artikel.
- Voor gedetailleerde informatie over het gebruik van acetyleen, zie het volgende artikel.
Inhoudsopgave
1. Fysieke eigenschappen van acetyleen
Acetyleen heeft een koolstof-koolstof driedubbele binding (C≡C), gekenmerkt door een korte lengte (0,1205 nm) en een hoge vormingsenergie. Deze configuratie maakt acetyleen zeer onstabiel en reactief vanwege zijn onverzadigde aard.
De zure waterstof van de C-H-bindingen (pKa=25) draagt bij aan de reactiviteit van acetyleen. Het is zuurder dan ethyleen (pKa=44) en kan acetyliden vormen met sterke basen.
Onder standaardomstandigheden is acetyleen een kleurloos, niet-toxisch gas met narcotische eigenschappen. Iets lichter dan lucht, bezit het verschillende fysieke eigenschappen die worden beschreven in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| Moleculaire massa | 26,0379 |
| Kritische temperatuur | 308,32 K (35,17 °C) |
| Kritische druk | 6,139 MPa |
| Kritisch volume | 0,113 m3/kmol |
| Tripelpunt | 192,4 K (−80,75 °C) |
| Tripelpuntdruk | 128,3 kPa |
| Normaal sublimatiepunt en normaal kookpunt | 189,15 K (−84,0 °C) |
| Kristalovergangspunt | 133,0 K (−140,15 °C) |
| Overgangsenthalpie | 2,54 kJ/mol |
| Dichtheid |
760,2 kg/m3 (131 K) 764,3 kg/m3 (141 K) |
| Dichtheid (vloeibare C2H2) | 465,2 kg/m3 (273,15 K) |
| Dichtheid (gasvormige C2H2 bij 1 bar) | 1,095 kg/m3 (288,15 K) |
| Moleculair volume (0 °C, 1,013 bar) | 22,223 m3/kmol |
| Enthalpie van verdamping (berekend) | 10,65 kJ/mol (273,15 K) |
| Enthalpie van sublimatie | 21,168 kJ/mol (5,55 K) |
| Enthalpie van vorming | 227,5 ± 1,0 kJ/mol (298,15 K) |
| Gibbs vrije energie van vorming | 209,2 ± 1,0 kJ/mol (298,15 K) |
| Entropie van vorming | 200,8 J mol−1 K−1 (298,15 K) |
| Enthalpie van verbranding | −1255,6 kJ/mol (298,15 K) |
| Hogere verbrandingswaarde | 50 400 kJ/kg |
| Lagere verbrandingswaarde | 48 700 kJ/kg |
| Dampspanning | 2,6633 MPa (273,15 K) |
| Thermische geleidbaarheid (0 °C, 1,013 bar) | 0,0184 W m−1 K−1 |
| Warmtecapaciteit (ideale gastoestand) | 43,990 J mol−1 K−1 (298,15 K) |
2. Chemische reacties van acetyleen
Acetyleen is zeer reactief ten opzichte van verschillende elementen en verbindingen vanwege de hoge onverzadiging en positieve vrije energie van vorming. Deze eigenschap maakt het een veelzijdige grondstof voor talloze stoffen. Belangrijke reactietypen zijn additiereacties, waterstofsubstituties, polymerisatie en cyclisatie.
Acetyleen is gevoeliger voor nucleofiele aanvallen vergeleken met ethyleen. Bovendien verleent de gepolariseerde C-H-binding (pKa ≈ 25) het zure eigenschappen, wat de oplosbaarheid in basische oplosmiddelen en de vorming van waterstofbruggen vergemakkelijkt. Dit gedrag wijkt af van de wet van Raoult voor oplossingen die acetyleen bevatten.
De ontwikkeling van acetyleen-drukreacties door W. Reppe markeerde een doorbraak in de acetyleenchemie. Opmerkelijke reactiegroepen zijn vinylering, ethynylering, carbonylering en cyclische en lineaire polymerisatie.
2.1. Industrieel belangrijke reacties
1. Vinylering:
Bij vinylering worden verbindingen met mobiele waterstofatomen (water, alcoholen, thiolen, aminen, etc.) aan acetyleen toegevoegd, wat resulteert in vinylderivaten die voornamelijk worden gebruikt voor polymerisatie.
Er bestaan twee typen: heterovinalering (waterstof uit O, S of N) en C-vinylering (direct gebonden koolstofwaterstof). Voorbeelden zijn acetyleendimerisatie, trimerisatie, acrylonitril-synthese en additie aan reactieve onverzadigde koolwaterstoffen zoals cyclopentadieen.
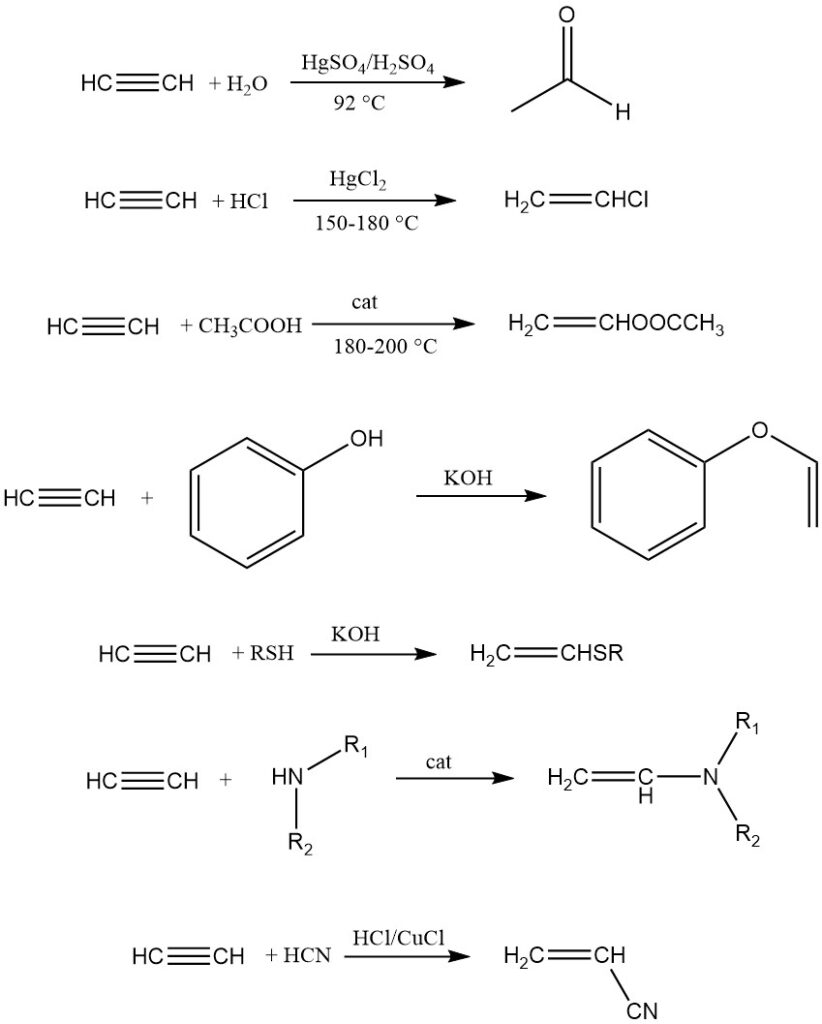
2. Ethynylering:
Ethynylering voegt carbonylverbindingen toe aan acetyleen terwijl de drievoudige binding behouden blijft. Reppe ontdekte dat zware metaalacetyliden, met name Cu2C2·2 H2O·2 C2H2, de reactie effectief katalyseren met aldehyden.
Ethynylering van ketonen wordt gekatalyseerd met alkalische katalysatoren. Het algemene reactieschema is:

Propargylalcohol en butyndiol zijn de belangrijkste producten van deze reactie.

3. Carbonylering:
Carbonylering omvat de reactie van acetyleen en koolmonoxide met verbindingen die mobiele waterstofatomen bezitten, gekatalyseerd door metaalcarbonylen (bijv. Ni(CO)4). Metaalhaliden die carbonylen kunnen vormen, kunnen ook worden gebruikt.
Acrylzuur is een prominent product dat wordt verkregen uit acetyleen, water en koolmonoxide met behulp van Ni(CO)4-katalysator. Andere producten van acetyleencarbonylering omvatten thioesters van acrylzuur, acrylamiden, carbonzuuranhydriden en hydrochinon.

4. Cyclisatie en polymerisatie:
Acetyleen kan, onder geschikte katalysatoren, cyclisatie en lineaire polymerisatie ondergaan. Berthelot observeerde als eerste cyclisatie, wat resulteerde in een mengsel van aromatische verbindingen zoals benzeen en naftaleen. Reppe synthetiseerde later 1,3,5,7-cyclooctatetraeen met een hoge opbrengst (70%).
Lineaire polymerisatie vindt plaats met koper(I)zouten, wat resulteert in vinylacetyleen, divinylacetyleen, enz. Een opmerkelijk voorbeeld is cupreen, gevormd door verhitting van acetyleen met koperspons. Ziegler-Natta-katalysatoren vergemakkelijken de vorming van polyacetyleen, dat unieke eigenschappen vertoont zoals geleidbaarheid bij doping.

2.2. Andere reacties en derivaten
1. Metaalacetyliden:
Acetyleen vormt metaalacetyliden door zijn waterstofatomen te vervangen door metaalatomen (M). Alkali- en aardalkaliacetyliden worden bereid via metaalamiden of directe reactie met gesmolten of fijn verdeelde metalen.

Explosieve koperacetyliden (Cu2C2·H2O) worden gevormd door de reactie van koper(I)-zouten met acetyleen in vloeibare ammoniak of koper(II)-zouten met acetyleen in basische oplossing met reductiemiddelen zoals hydroxylamine.
Bovendien kunnen koperoxiden en andere koperzouten gemakkelijk worden omgezet in acetyliden. Vanwege deze reactiviteit moeten koperen leidingen strikt worden vermeden in acetyleensystemen. Er bestaan andere explosieve metaalacetyliden voor zilver, goud en kwik.
2. Halogenering:
Chloor voegt zich toe aan acetyleen met FeCl3 als katalysator om 1,1,2,2-tetrachloorethaan te verkrijgen, een belangrijk tussenproduct bij de productie van oplosmiddelen. Broom en jodium kunnen ook deelnemen aan additiereacties, waarbij jodium stopt bij 1,2-di-joodethyleen.
3. Hydrogenering:
Acetyleen ondergaat gedeeltelijke of volledige hydrogenering over Pt-, Pd- of Ni-katalysatoren, wat resulteert in ethyleen of ethaan.
4. Organische siliciumverbindingen:
Silanen kunnen worden toegevoegd aan acetyleen met behulp van platinakatalysatoren in de vloeibare fase, wat siliciumbevattende derivaten oplevert.
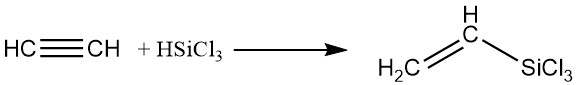
5. Oxidatie:
Acetyleen is bestand tegen oxidatie bij kamertemperatuur, maar vormt explosieve mengsels met lucht of zuurstof. Oxiderende middelen zoals ozon of chroomzuur zetten het om in mierenzuur, koolstofdioxide en andere producten. Reactie met verdund ozon levert glyoxaal op.
6. Hydraten:
Onder druk en temperaturen onder ongeveer 15 °C vormt acetyleen wasachtige hydraten met de samenstelling C2H2·6 H2O. Deze clathraatachtige structuren nemen watermoleculen op in hun kristalrooster, wat van invloed is op de opslag en verwerking van acetyleen. Hydraatvorming kan leiden tot blokkades van apparatuur en ontledingsrisico’s als gevolg van schokgolven.
7. Chlooracetylenen:
7.1. Monochlooracetyleen (HC≡CCl):
Monochlooracetyleen is een gas met een misselijkmakende geur dat slijmvliezen irriteert. Het wordt verkregen door 1,2-dichloorethyleen te laten reageren met alcoholisch NaOH in aanwezigheid van Hg(CN)2. Het is zeer ontvlambaar en explodeert gemakkelijk in aanwezigheid van zelfs sporen zuurstof of lucht en is extreem giftig.
7.2. Dichlooracetyleen (ClC≡CCl):
Dichlooracetyleen is een kleurloze olie met een onaangename geur die explodeert in de lucht of bij verhitting. Het wordt bereid uit acetyleen in een sterk alkalische kaliumhypochlorietoplossing of door trichloorethyleendamp te laten reageren met bijtende alkali. Het is zeer explosief en ontbindt gemakkelijk, wat aanzienlijke veiligheidsrisico’s oplevert.
3. Toxicologie van acetyleen
Puur acetyleen werkt als een eenvoudig verstikkend middel door zuurstof in de atmosfeer te verdringen. Echter, commercieel acetyleen bevat geen significante hoeveelheden giftige onzuiverheden meer zoals arsine, waterstofsulfide en fosfine, die historisch gezien bijdroegen aan schadelijke gezondheidseffecten door blootstelling aan acetyleen geproduceerd uit carbidecalcium.
De laagste gedocumenteerde dodelijke concentratie (LC) voor ratten is 9% van het volume in de lucht. Honden vertonen een grotere tolerantie, waarbij 80% acetyleen nodig is om narcose te induceren met verhoogde bloeddruk en verlaagde hartslag (wat duidt op vasomotorische en vaguszenuwstimulatie).
Bij mensen veroorzaakt het inademen van 10% acetyleen milde intoxicatie, terwijl 20% aanzienlijke intoxicatie veroorzaakt en 30% leidt tot coördinatiestoornissen. Bewusteloosheid treedt op binnen 5 minuten bij 35% blootstelling.
Lethale inhalatie omvat 35% gedurende 5-10 minuten of 10% gedurende 30-60 minuten. Symptomen van intoxicatie zijn opwinding, coma, cyanose, zwakke/onregelmatige pols en geheugenverlies.
Er is geen bewijs dat schadelijke gezondheidseffecten suggereert van herhaalde blootstelling aan aanvaardbare acetyleenniveaus. Interessant genoeg lieten menselijke studies een verminderde vatbaarheid zien bij herhaalde blootstelling.
Hoewel 33% acetyleen aanvankelijk binnen 6 minuten bewusteloosheid veroorzaakte, vereisten daaropvolgende blootstellingen binnen dezelfde week langere duurtijden (9 minuten op de tweede en meer dan 33 minuten op de derde) om hetzelfde effect te bereiken.
In tegenstelling tot sommige andere gassen irriteert acetyleen de slijmvliezen niet. Opvallend is dat er geen drempelwaarde (TLV) of maximaal toegestane concentratie (MAK) is vastgesteld voor acetyleen.
De huidige toegestane blootstellingslimiet (PEL) van de Occupational Safety and Health Administration (OSHA) en het National Institute for Occupational Safety and Health (NIOSH) is 2500 ppm (parts per million) in de lucht.
Referentie
- Acetylene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_097.pub4
