Acetylchloride: eigenschappen, reacties, productie en toepassingen
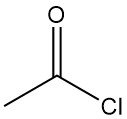
Wat is acetylchloride?
Acetylchloride, ook bekend als ethanoylchloride, is een organische verbinding met de molecuulformule CH3COCl. Het is een kleurloze, bijtende en sterk irriterende vloeistof met een verstikkende geur.
Concentraties van slechts 0,5 ppm acetylchloride veroorzaken tranenvloed en branderigheid in de ogen, neusholtes en keel. Acetylchloride is giftig omdat het gemakkelijk reageert met hydroxyl-, sulfhydryl- en aminogroepen, waardoor modificaties ontstaan die de activiteit van essentiële enzymen in levend weefsel remmen.
Inhoudsopgave
- Wat is acetylchloride?
- 1. Fysische eigenschappen van acetylchloride
- 2. Chemische reacties van acetylchloride
- 3. Productie van acetylchloride
- 4. Toepassingen van acetylchloride
- 5. Toxicologie en veiligheid
- Referenties
1. Fysische eigenschappen van acetylchloride
Acetylchloride is een kleurloze, bijtende vloeistof. De belangrijkste fysische eigenschappen van acetylchloride staan samengevat in tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-registratienummer | 75-36-5 |
| Molecuulformule | C2H3OCl |
| Molaire massa (g/mol) | 78,50 |
| Vriespunt (°C) | -112,0 |
| Kookpunt (°C, 101,3 kPa) | 50,2 |
| Dichtheid (g/ml) bij 4 °C | 1,1358 |
| Dichtheid (g/ml) bij 20 °C | 1,1051 |
| Dichtheid (g/ml) bij 25 °C | 1,0982 |
| Standaardvormingsenthalpie (ΔHf, kJ/mol) | -243,93 |
| Verdampingsenthalpie bij het kookpunt (ΔHv, kJ/g) | 0,36459 |
| Breukindex (nD20) | 1,38976 |
2. Chemische reacties van acetylchloride
Acetylchloride ondergaat een breed scala aan chemische reacties en wordt gebruikt in de organische synthese voor:
- Elektrofiele acetylering van arenen, alkenen, alkynen, verzadigde alkanen, organometalen en enolaten (op C of O)
- Klieving van ethers
- Verestering van sterisch ongehinderde of zuurgevoelige alcoholen
- Generatie van oplossingen van watervrij waterstofchloride in methanol
- Als dehydratatiemiddel
- Als oplosmiddel voor organometalen reacties
- Voor de deoxygenering van sulfoxiden
- Als scavenger voor chloor en broom
- Als bron van keteen
- Voor nucleofiele acetylering
In inerte oplosmiddelen zoals koolstofdisulfide of petroleumether reageert acetylchloride met aromatische koolwaterstoffen en olefinen om ketonen te produceren. Deze reacties worden gekatalyseerd door Lewis-zuren, waarbij de katalytische activiteit toeneemt in de volgorde:
ZnCl2 < BiCl3 < TeCl4 < TiCl4 < SnCl4 < TeCl2 < FeCl3 < SbCl5 < AlCl3
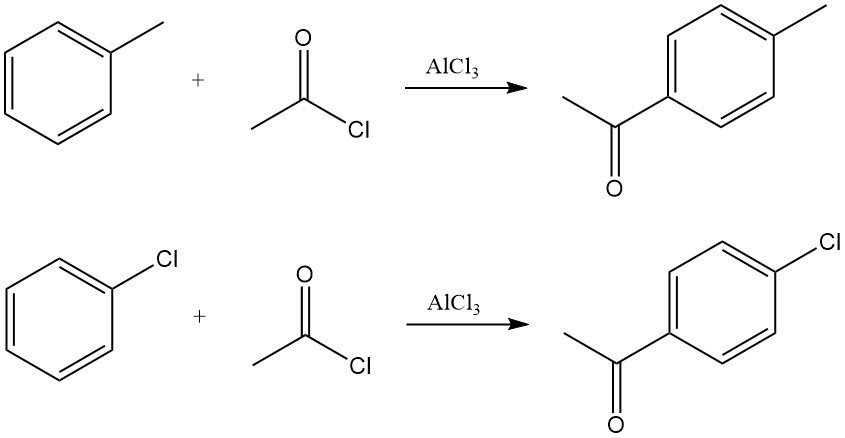
Arenen reageren met acetylchloride in aanwezigheid van Lewiszuren, meestal aluminiumchloride, om arylmethylketonen te produceren. De reactie verloopt via de vorming van het acyliumion, dat elektrofiele aromatische substitutie ondergaat.
Acetylering van tolueen levert bijvoorbeeld voornamelijk p-methylacetofenon op, terwijl acetylering van chloorbenzeen p-chlooracetofenon oplevert met een hoge selectiviteit.
Alkenen reageren met acetylchloride onder Friedel-Crafts-omstandigheden tot mengsels van chlooralkylmethylketonen en verwante producten. Elektron-deficiënte alkenen zoals ethyleen en allylchloride geven goede opbrengsten, terwijl hogere alkenen vaak herrangschikkingen ondergaan.
Zo levert de reactie van acetylchloride met cyclohexeen met AlCl3 als katalysator 2-chloorcyclohexylmethylketon en 4-chloorcyclohexylmethylketon op.

Alkynen ondergaan elektrofiele acetylering onder vergelijkbare omstandigheden. Acetyleen behandeld met acetylchloride en aluminiumchloride produceert β-chloorvinylmethylketon, terwijl hogere alkynen ketonische producten opleveren in matige tot hoge opbrengsten.
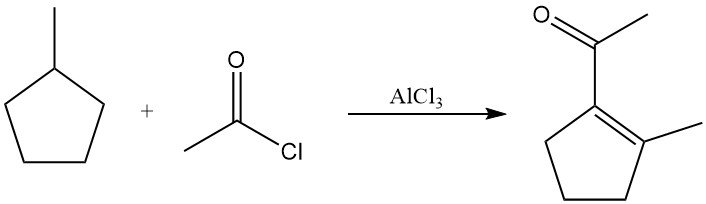
In aanwezigheid van acetylchloride en aluminiumchloride bij verhoogde temperatuur ondergaan verzadigde alkanen dehydrogenering tot alkenen, gevolgd door acetylering. De producten zijn doorgaans vinylmethylketonen of verzadigde alkylmethylketonen. Methylcyclopentaan levert bijvoorbeeld 1-acetyl-2-methylcyclopenteen op in een aanzienlijke opbrengst.
Acetylchloride reageert met een breed scala aan organometaalverbindingen, waaronder Grignard-, organolithium-, organozink- en organocupraatreagentia, om methylketonen te vormen. Overgangsmetaalkatalysatoren zoals palladium- of koperzouten worden vaak gebruikt om de selectiviteit en opbrengst te verbeteren.
Metaalenolaten reageren met acetylchloride om β-diketonen te vormen. De reactie kan ook concurrerende O-geacetyleerde producten opleveren, afhankelijk van het metaaltegenion. Het gebruik van zink- of koperenolaten verbetert de selectiviteit voor C-acetylering. Gerelateerde transformaties omvatten acetylering van silylketeenacetalen en -enaminen, waardoor gefunctionaliseerde esters en ketonen beschikbaar komen.
Ketonen en β-keto-esters kunnen met behulp van acetylchloride worden omgezet in enolacetaten. De reactie kan verlopen via voorgevormde enolaten of silylenolethers. Steroïdale ketonen kunnen bijvoorbeeld worden omgezet in geconjugeerde enolacetaten door behandeling met acetylchloride in aanwezigheid van aminebasen.
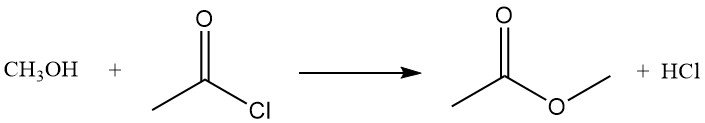
Acetylchloride reageert met alcoholen tot esters of alkylchloriden. Primaire alcoholen vormen meestal esters, terwijl secundaire en tertiaire alcoholen vaak chloriden vormen via substitutie. De reactie van methanol met acetylchloride produceert methylacetaat en waterstofchloride en wordt gebruikt als methode om oplossingen van watervrij waterstofchloride in methanol te bereiden.
Cyclische en acyclische ethers kunnen worden gesplitst door acetylchloride in aanwezigheid van halidezouten of Lewiszuren. Zo reageert tetrahydrofuraan met acetylchloride en natriumjodide tot 4-joodbutylacetaat en in aanwezigheid van een Lewiszuur zoals ZnCl2 tot chloorbutylacetaat met een opbrengst van ongeveer 76%.
Deze eigenschap maakt acetylchloride nuttig bij het verwijderen van beschermende ethergroepen.

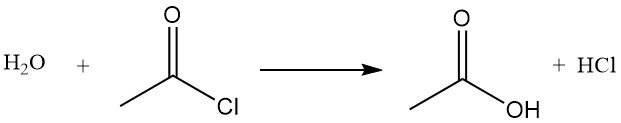
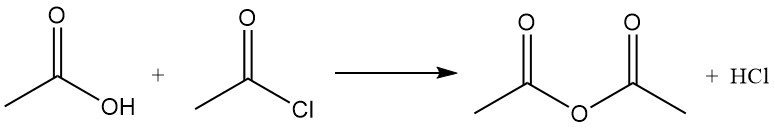
Acetylchloride werkt als een dehydratatiemiddel door met water te reageren tot azijnzuur en waterstofchloride. Het bevordert de cyclisatie van dicarbonzuren tot anhydriden, ketozuren tot lactonen en nitroverbindingen tot nitriloxiden. Het wordt ook gebruikt bij de omzetting van hydroperoxiden in onverzadigde ketonen. Het reageert bijvoorbeeld met azijnzuur tot azijnzuuranhydride.
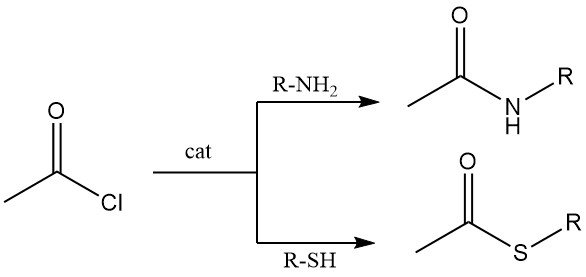
Primaire en secundaire aminen reageren met acetylchloride tot acetamidines. Onder Schotten-Baumann-omstandigheden (waterige base) is N-acetylering efficiënt, hoewel hydrolyse van acetylchloride kan concurreren.
Tertiaire aminen leveren acetylammoniumzouten op, die kunnen ontbinden tot ketenen of een von-Braun-fragmentatie kunnen ondergaan. Verwante reacties zijn onder andere N-acetylering van iminen tot enamiden en de omzetting van urethanen tot imiden.
Thiolen reageren met acetylchloride tot thioesters. Zowel alifatische als aromatische thiolen ondergaan deze transformatie, meestal in aanwezigheid van kobaltchloride als katalysator.
Acetylchloride vormt reversibele adducten met aldehyden en ketonen in aanwezigheid van Lewiszuren, waardoor α-chlooralkylacetaten ontstaan. Zo reageert aceton bij lage temperatuur met acetylchloride en zinkchloride om het overeenkomstige adduct in goede opbrengst te vormen.
Sulfoxiden worden door acetylchloride gereduceerd tot sulfiden in aanwezigheid van tin(II)chloride. De reactie verloopt onder milde omstandigheden en is compatibel met gevoelige functionele groepen, waaronder cefalosporinederivaten.
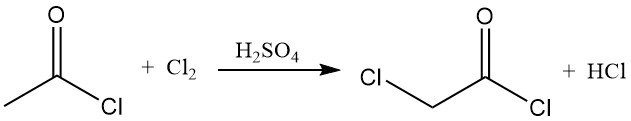
Acetylchloride reageert met chloor en broom om haloacetylchloriden te vormen. In aanwezigheid van zwavelzuur wordt chloor efficiënt omgezet in chlooracetylchloride, een belangrijk synthetisch intermediair.
Reacties van acetylchloride met tertiaire aminen zoals triethylamine genereren in situ keteen. Het keteen kan worden ingevangen door enolaten, enaminen of iminen om acetoazijnzuuresters, cyclobutanonen of diketeenadducten te vormen.
In aanwezigheid van samarium(II)jodide gedraagt acetylchloride zich als een nucleofiel acetylanion-equivalent, waarbij acyloïneproducten uit ketonen ontstaan.
De reactie van acetylchloride met waterstofperoxide produceert peroxyazijnzuur en acetylperoxide, waarbij laatstgenoemde een zeer explosieve verbinding is.
In aanwezigheid van vetzuren vormt het gemengde azijnzuur-alkylcarbonzuuranhydriden of acylchloriden, die beide kunnen worden gebruikt in veresteringsreacties. Laurinezuur reageert bijvoorbeeld met acetylchloride om de overeenkomstige derivaten te vormen.
Acetylchloride ondergaat een reductie met organometaalreagentia zoals lithiumaluminiumhydride (LiAlH4). In aanwezigheid van tert-butylalcohol wordt LiAlH4 omgezet in lithiumtri-tert-butoxyaluminiumhydride, dat acetylchloride selectief reduceert tot aceetaldehyde. Trifenyltinhydride reduceert ook acetylchloride.
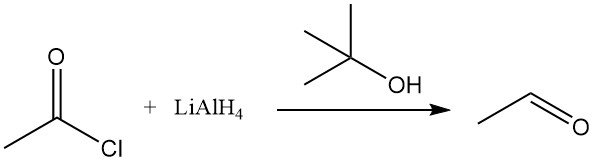
Katalytische hydrogenering van acetylchloride volgens de Rosenmund-methode is inefficiënt, maar reductie van azijnzuuranhydride tot ethylideendiacetaat is mogelijk in aanwezigheid van acetylchloride over palladiumcomplexen. Rhodiumtrichloride, methyljodide en trifenylfosfine vormen een complex dat actief is in de reductie van acetylchloride.
3. Productie van acetylchloride
Acetylchloride wordt commercieel geproduceerd in Europa en het Verre Oosten. In de Verenigde Staten is de productie beperkt en voornamelijk gericht op gebruik ter plaatse, met name voor farmaceutische acetylering.
Acetylchloride werd voor het eerst beschreven in de jaren 1850. Het werd verkregen door destillatie van watervrij natriumacetaat met fosforoxychloride.
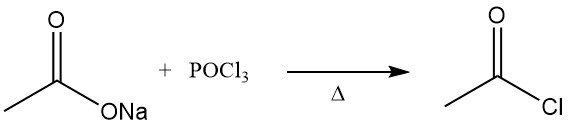
De vroegere methode voor de productie van acetylchloride was de reactie van thionylchloride, SOCl2, met grijs acetaat van kalk. Dit proces is grotendeels vervangen door de reactie van natriumacetaat of azijnzuur met fosfortrichloride, PCl3. Een vergelijkbare route is in de Sovjet-Unie nog steeds in gebruik. Beide methoden zijn relatief duur.
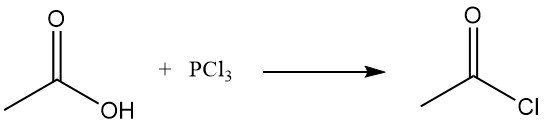
De carbonylering van methylchloride met koolmonoxide om acetylchloride te produceren, is in verschillende octrooien beschreven. Deze processen maken gebruik van katalysatoren op basis van rhodium-, palladium- of iridiumcomplexen in combinatie met joodverbindingen en fosfoniumjodiden of fosfineoxiden.
Een gerapporteerde reactie leverde bijvoorbeeld een omzetting van 56% naar acetylchloride op bij een temperatuur van 453 K en een druk van 8360 kPa. Deze reacties zijn haalbaar dankzij de beschikbaarheid van corrosiebestendige legeringen. De industriële toepassing van deze methode is niet bevestigd.
Alternatieve bereidingswijzen zijn onder andere de reactie van azijnzuur met gechloreerde ethylenen in aanwezigheid van ferrichloride, een combinatie van benzylchloride met azijnzuur (opbrengst 85%), de omzetting van ethylideendichloride (opbrengst 91%) en de ontleding van ethylacetaat door fosgeen tot acetylchloride en ethylchloride. De hoge kosten van grondstoffen en apparatuur maken de fosgeenroute niet haalbaar.
Chlorering van azijnzuur tot monochloorazijnzuur produceert ook acetylchloride als bijproduct. Omdat terugwinning kostbaar is, wordt acetylchloride meestal gerecycled tot monochloorazijnzuur. Een gepatenteerde methode beschrijft het wassen van mengsels van acetylchloride en waterstofchloride met zwavelzuur tot acetylsulfaat.
Een Amerikaans octrooi beschrijft een verbeterde opbrengst van acetylchloride uit de reactie van azijnzuuranhydride met waterstofchloride. Bij dit proces worden acetylchloride en een deel van het azijnzuurbijproduct continu uit het mengsel verwijderd, terwijl de resterende componenten worden teruggevoerd naar de reactor voor verdere reactie.
4. Toepassingen van acetylchloride
Een kleine hoeveelheid acetylchloride wordt verbruikt tijdens de opstartfase van de chlorering van azijnzuur tot monochloorazijnzuur. Eenmaal gestart, zorgt het gevormde acetylchloride als bijproduct voor het katalytische effect.
Acetylchloride is een effectief acetyleringsmiddel. Het wordt gebruikt bij de synthese van aspirine, paracetamol, acetanilide en acetofenon. Het wordt ook gebruikt bij de bereiding van vloeibaar-kristalcomposities die nodig zijn voor optische displays en geheugenapparaten.
Acetylchloride kan worden gebruikt ter vervanging van azijnzuuranhydride of azijnzuur als een zeer reactief acetyleringsreagens wanneer reacties moeilijk of traag zijn. Dit maakt acetylchloride bijzonder nuttig voor de bereiding van gespecialiseerde polymeren die kunnen cheleren met metaalionen, zoals koper, wat resulteert in verbeterde elektrische en magnetische eigenschappen.
Anthraline wordt geacetyleerd met acetylchloride in tolueen met behulp van pyridine als katalysator om 1,8-dihydroxy-10-acetylantron te produceren, een tussenproduct in medicijnen voor huidaandoeningen zoals wratten, psoriasis en acne. Suikeresters kunnen op een vergelijkbare manier onder watervrije omstandigheden met acetylchloride worden gesynthetiseerd.
Acetylchloride is in de analytische chemie gebruikt voor de bepaling van hydroxylgroepen, maar deze methode is grotendeels vervangen door spectroscopische technieken. Het wordt nog steeds gebruikt voor de bereiding van fenolderivaten zonder sterke zure katalysatoren en voor de acetylering van primaire en secundaire aminen.
Acetylchloride kan in veel acetyleringsreacties worden gebruikt als vervanging voor azijnzuuranhydride. In tegenstelling tot anhydride is hiervoor geen mineraalzuurkatalysator nodig. Ondanks de hogere kosten wordt acetylchloride veel gebruikt waar gemak opweegt tegen kosten. Een verlaging van de productiekosten zou acetylchloride tot een sterk alternatief voor azijnzuuranhydride maken in grootschalige processen.
5. Toxicologie en veiligheid
Acetylchloride produceert verstikkende dampen met een scherpe, irriterende geur. Het is zeer giftig. De ontvlambaarheid en sterke reactie met water en alkaliën vereisen strikte voorzorgsmaatregelen tijdens het gebruik.
Voldoende ventilatie is noodzakelijk om dampen uit werkruimtes te verwijderen. Personeel dient ondoordringbare beschermende kleding te dragen om blootstelling te voorkomen. Bulkcontainers moeten worden opgeslagen op een koele, droge plaats, afgeschermd van ontvlambare en niet-corrosieve stoffen.
Referenties
1. Wagner, F.S., Jr. (2002). Acetyl Chloride. In Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a04.pub2
2. Pearlman, B.A. (2001). Acetyl Chloride. In Encyclopedia of Reagents for Organic Synthesis, (Ed.). https://doi.org/10.1002/047084289X.ra025
3. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
