Disolfuro di carbonio: proprietà, reazioni, produzione e usi
Cos’è il disolfuro di carbonio?
Il disolfuro di carbonio è un liquido incolore con formula CS2. È un importante composto chimico ampiamente utilizzato in varie applicazioni industriali.
La scoperta del disolfuro di carbonio può essere attribuita a Lampadius nel 1796, che lo scoprì riscaldando una combinazione di pirite di ferro e carbonio.
Il composto suscitò interesse industriale già nel 1839, quando Schrötter lo sintetizzò con successo utilizzando carbone e zolfo in una storta riscaldata. Le notevoli capacità solventi del disolfuro di carbonio furono rapidamente riconosciute, portando al suo uso diffuso nell’estrazione di grassi e oli per un periodo considerevole.
Tuttavia, la sua vera importanza come prodotto chimico industriale su larga scala emerse con l’avvento del processo del rayon viscosa nei primi anni del 1900. Questo processo si basava sul disolfuro di carbonio per sciogliere la cellulosa, stabilendo così il suo ruolo fondamentale nel settore.
Tuttavia, la rapida crescita del rayon subì delle battute d’arresto alla fine degli anni ’60 a causa della concorrenza delle fibre sintetiche a base di petrolio, con conseguente declino sia nei mercati del rayon che del disolfuro di carbonio per tutti gli anni ’70. Tuttavia, in tempi recenti, l’uso del disolfuro di carbonio si è stabilizzato e si prevede una piccola crescita del mercato per il futuro.
Nel 1984, della produzione mondiale totale di 1,1 milioni di tonnellate di disolfuro di carbonio, oltre il 75% è stato consumato principalmente dall’industria della cellulosa rigenerata. La parte rimanente ha trovato applicazione nella produzione di tetracloruro di carbonio e diversi composti organosolforati, ampiamente utilizzati come prodotti chimici per la gomma, agenti di flottazione e pesticidi.
Sommario
1. Proprietà fisiche del disolfuro di carbonio
Il disolfuro di carbonio è un liquido altamente volatile di densità significativa, che presenta un ampio intervallo di infiammabilità in presenza di aria, che va dall’1 al 50 percento in volume. Possiede una temperatura di autoaccensione eccezionalmente bassa di 100 °C e un punto di infiammabilità di -30 °C. La sua velocità di evaporazione nell’atmosfera supera quella dell’etere dietilico di un fattore di 1,6.
Questo composto funge da solvente eccezionale per numerose sostanze organiche, dissolvendo facilmente zolfo, fosforo, iodio, cere, gomma e resine. La forma disponibile in commercio emette un aroma pungente, caratteristico dei composti a base di zolfo.
Alcune delle proprietà fisiche più utili del disolfuro di carbonio sono le seguenti:
- Massa molare = 76,13 g/mol
- Punto di fusione = -111,6 °C
- Punto di ebollizione = 46,23 °C
- Densità a 25 °C = 1,26 g/ml
- Temperatura critica = 273 °C
- Pressione critica = 7600 kPa
- Tensione superficiale a 20 °C = 32,3 mN/m
- Indice di rifrazione a 20 °C = 1,62546
- Viscosità a 25 °C = 0,36 mPa.s
2. Reazioni chimiche del disolfuro di carbonio
Il disolfuro di carbonio presenta un’ampia gamma di reazioni chimiche che sono state ampiamente studiate e documentate.
Quando il disolfuro di carbonio reagisce con solfuri, alcoli, ammoniaca, ammine e cloro, genera derivati e intermedi di importanza industriale. In presenza di alcali acquosi, il disolfuro di carbonio reagisce lentamente per formare composti di tritiocarbonato e carbonato, come rappresentato dall’equazione:
3 CS2 + 6 NaOH → 2 Na2CS3 + Na2CO3 + 3 H2O
I solfuri metallici formano tritiocarbonati quando reagiscono con il disolfuro di carbonio, come mostrato nella reazione:
K2S (acquosa) + CS2 → K2CS3
Inoltre, quando il disolfuro di carbonio reagisce con gli alcali alcolici, produce xantati, che sono sali di ditiocarbonati, attraverso il seguente processo:
ROH + NaOH → RONa + H2O
RONa + CS2 → ROCSSNa
Questa reazione costituisce la base per il processo della viscosa, in cui la cellulosa viene convertita in xantato e successivamente rigenerata sotto forma di fibre e pellicole, come dimostrato nella reazione:
(cellulosa)ONa + CS2 → (cellulosa)OCSSNa
2 (cellulosa)OCSSNa + H2SO4 → 2 (cellulosa)OH + 2 CS2 + Na2SO4
In presenza di ammoniaca, il disolfuro di carbonio forma ditiocarbammato di ammonio (1), tritiocarbonato di ammonio (2) e tiocianato di ammonio (3), a seconda della concentrazione di ammoniaca e della temperatura:
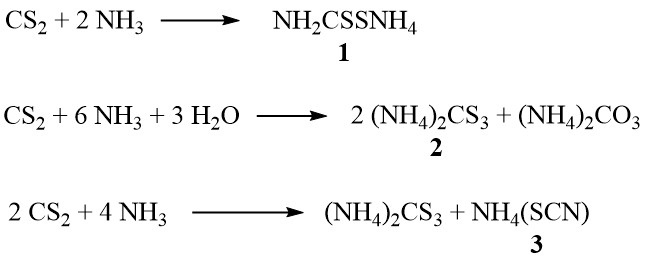
Inoltre, a temperature più elevate nella fase di vapore, il tiocianato si decompone per produrre tiourea:
NH4(SCN) → SC(NH2)2
Le ammine primarie e secondarie producono prevalentemente sali ditiocarbammati nella loro reazione con il disolfuro di carbonio:
2 RNH2 + CS2 → RNHCSSNH3R
2 R2NH + CS2 → R2NCSSNH2R2
In presenza di alcali si possono ottenere vari sali di acido ditiocarbammico di importanza commerciale:
R2NH+ CS2 + NaOH → R2NCSSNa + H2O
La reazione del disolfuro di carbonio con metilammina e soda caustica in una soluzione acquosa produce metilditiocarbammato di sodio (CH3NHCSSNa), un fumigante essenziale per il suolo. Allo stesso modo, il disolfuro di carbonio reagisce con l’etilendiammina per produrre il fungicida sodio etilene bis(ditiocarbammato):
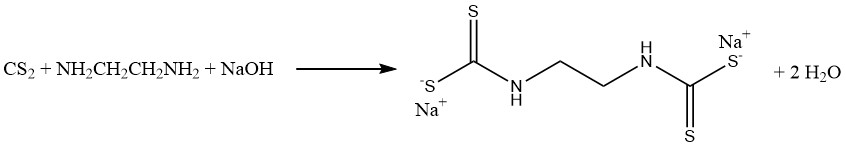
Le reazioni di anilina e disolfuro di carbonio danno luogo alla formazione di due importanti acceleratori di vulcanizzazione. In assenza di zolfo si produce tiocarbanilide, mentre in presenza di zolfo si ottiene 2-mercaptobenzotiazolo:
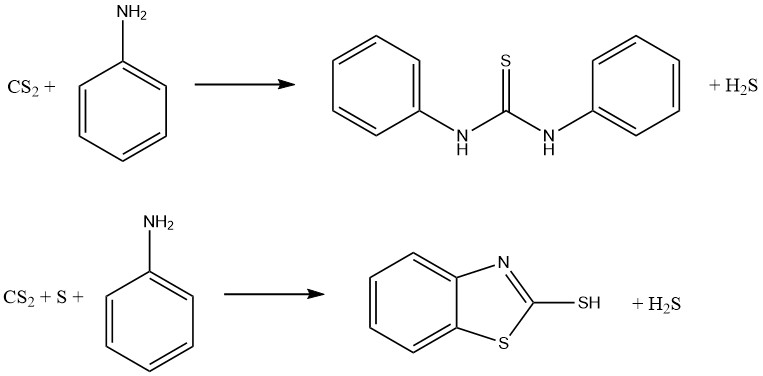
I ditiocarbammati possono essere ossidati per formare una famiglia di composti noti come disolfuri di tiurio, che vengono utilizzati come fungicidi e acceleratori di vulcanizzazione. La reazione comporta la seguente equazione:
2 R2NCSSNa + H2O2 + H2SO4 → (R2NCSS–)2 + Na2SO4 + 2 H2O
La clorurazione del disolfuro di carbonio porta alla formazione di vari prodotti clorurati. Con la catalisi dello iodio, la clorurazione a temperature comprese tra 5 e 30 °C produce cloruro di triclorometansolfenile, insieme a tetracloruro di carbonio, dicloruro di zolfo e tiofosgene, a seconda del grado di clorurazione.
In presenza di cloruri di ferro e metallici a temperature più elevate (70-100 °C), si ottengono esclusivamente tetracloruro di carbonio e cloruri di zolfo.
Il disolfuro di carbonio reagisce facilmente con l’acqua in presenza di catalizzatori di allumina e ossido sopra i 150 °C, producendo anidride carbonica e idrogeno solforato. Il solfuro di carbonile agisce come intermedio in questa reazione di idrolisi. A temperature comprese tra 200 e 300 °C, la conversione del disolfuro di carbonio in questi prodotti raggiunge l’equilibrio.
Quando sottoposto ad alte temperature (oltre 150-200 °C) in presenza di catalizzatori di solfuro metallico come solfuri di molibdeno e nichel, il disolfuro di carbonio subisce una riduzione da parte dell’idrogeno, con conseguenti quantità variabili di metantiolo, dimetilsolfuro, metano e idrogeno solforato.
3. Produzione di disolfuro di carbonio
Il disolfuro di carbonio viene prodotto dalla reazione dello zolfo con carbone vegetale o metano. Sebbene etano, propano e propene siano stati utilizzati in misura limitata, il processo del metano ha acquisito notevole importanza dalla sua introduzione nei primi anni ’50.
Di conseguenza, il vecchio processo del carbone vegetale non è più rilevante nella produzione di disolfuro di carbonio negli Stati Uniti, in Europa e in Giappone. Tuttavia, nelle regioni in cui il gas naturale o il metano non sono facilmente accessibili o quando le dimensioni degli impianti sono relativamente ridotte, il processo del carbone vegetale viene ancora impiegato per soddisfare la domanda locale di produzione di rayon viscosa.
3.1. Produzione di disolfuro di carbonio da carbone e zolfo
Il processo fondamentale per la reazione del carbone con lo zolfo ha subito cambiamenti minimi sin dal suo inizio a metà degli anni 1840. Le storte riscaldate esternamente sono ancora utilizzate, sebbene la progettazione delle apparecchiature sia notevolmente migliorata con la disponibilità di materiali da costruzione superiori.
Negli impianti a storta, lo zolfo fuso viene vaporizzato e surriscaldato prima o dopo essere stato introdotto nella storta. All’interno della storta, a temperature comprese tra 850 e 900 °C e leggermente superiori alla pressione atmosferica, il vapore di zolfo surriscaldato reagisce con un letto stazionario di carbone.
Il gas prodotto risultante, che include disolfuro di carbonio, zolfo, idrogeno solforato, solfuro di carbonile e gas inerti, passa attraverso una serie di condensatori, scrubber e assorbitori di olio per recuperare il disolfuro di carbonio grezzo.
Un ulteriore trattamento in colonne di distillazione produce il prodotto puro. Il gas di coda, costituito principalmente da acido solfidrico, solfuro di carbonile e gas inerti, può essere incenerito e depurato con una soluzione caustica o indirizzato a un impianto di recupero dello zolfo.
In genere, ogni storta è in grado di produrre da 1 a 3 tonnellate metriche al giorno di disolfuro di carbonio. La vita utile delle storte in ghisa è limitata a meno di un anno a causa della corrosione ad alta temperatura. Per ridurre al minimo la necessità di pulizie del reattore, le materie prime utilizzate nelle storte devono avere un basso contenuto di ceneri e residui. L’incrostazione delle storte ostacola il trasferimento di calore e ne riduce la durata.
La qualità del carbone è fondamentale, poiché i materiali meno reattivi richiedono temperature più elevate per un funzionamento soddisfacente. Per questo motivo si preferisce il carbone derivato dal legno duro.
Il carbone viene in genere precalcinato a 500 °C per rimuovere le sostanze volatili che potrebbero portare alla formazione di sottoprodotti indesiderati. L’efficienza termica delle storte è di circa il 25%, con rese di carbonio e zolfo generalmente inferiori al 90%.
Una fonte di calore alternativa per la reazione del carbone con lo zolfo è fornita dal riscaldamento a resistenza elettrica in reattori elettrotermici rivestiti in mattoni. Quando è disponibile energia a basso costo, il metodo elettrico può essere più conveniente.
Il consumo di energia per tonnellata di disolfuro di carbonio prodotto è di circa 1200 kWh. I reattori elettrotermici offrono diversi vantaggi, tra cui una maggiore capacità per reattore (fino a 10 tonnellate al giorno) e una maggiore durata del reattore. Inoltre, è possibile utilizzare una gamma più ampia di alimentazione di carbonio solido poiché i reattori elettrotermici possono generare temperature più elevate.
3.2. Produzione di disolfuro di carbonio da metano e zolfo
A causa della crescente domanda di disolfuro di carbonio negli anni ’40, i limiti dei processi del carbone hanno spinto lo sviluppo di un metodo di produzione su larga scala più efficiente.
La reazione catalizzata tra metano e zolfo, sfruttando il gas naturale facilmente disponibile e conveniente, emerse come un’alternativa di successo. Tra il 1943 e il 1965 furono rilasciati numerosi brevetti che coprivano vari aspetti di questo processo.
Il processo commerciale del metano, basato principalmente sui brevetti acquisiti dalla Pure Oil Co., fu in seguito rilevato dalla Food Machinery Corp. (FMC) e dalla Stauffer Chemical Co.
Nel 1953, FMC costruì il primo impianto di processo del metano a South Charleston, West Virginia, seguito da un impianto Stauffer a LeMoyne, Alabama, tre anni dopo. A metà degli anni ’60, tutta la produzione di disolfuro di carbonio negli Stati Uniti veniva realizzata con questo metodo e presto impianti simili emersero in Europa e in altre regioni.
Attualmente, oltre l’85% della capacità produttiva mondiale di disolfuro di carbonio si basa sul processo del metano.
Un tipico diagramma di flusso del processo del metano è illustrato nella Figura 1. Il gas naturale purificato, contenente oltre il 95% di metano e basse concentrazioni di propano e idrocarburi più pesanti, viene preriscaldato a circa 250 °C nella sezione di convezione del forno di reazione.
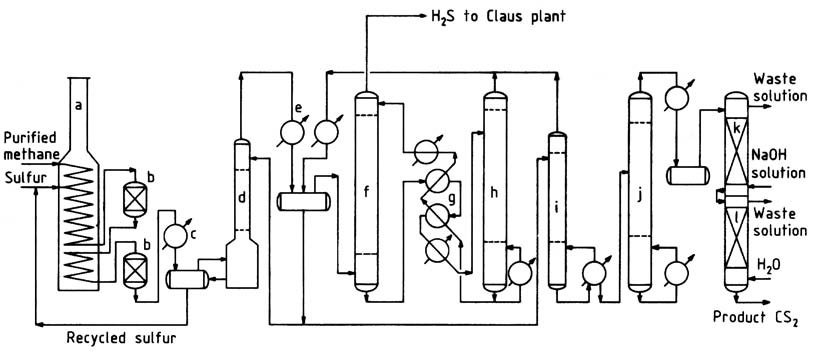
a) Forno di reazione; b) Reattori catalitici; c) Condensatore di zolfo; d) Scrubber CS2; e) Condensatore CS2; f) Assorbitore CS2; g) Scambiatori di olio; h) Stripper CS2; i) Colonna stabilizzatrice; j) Colonna di purificazione; k) Colonna di lavaggio caustico; l) Colonna di lavaggio ad acqua
Il forno, un forno di pirolisi di tipo box comunemente impiegato nell’industria petrolchimica, è costituito da sezioni radianti e a convezione. Il gas metano caldo viene miscelato con zolfo liquido e introdotto nella serpentina di riscaldamento orizzontale situata nella sezione radiante.
In questa sezione, lo zolfo liquido vaporizza e la temperatura della miscela sale a 550-650 °C. La pressione di esercizio varia in genere da 400 a 700 kPa.
In alternativa, metano e zolfo possono essere introdotti separatamente e in punti diversi all’interno della serpentina. Viene impiegato un leggero eccesso di zolfo (circa il 5%) per garantire un’efficiente conversione del metano e ridurre al minimo la formazione di carbonio e catrame.
Per resistere all’ambiente corrosivo ad alta temperatura, viene utilizzato acciaio inossidabile fuso ad alta lega come materiale per tubi, garantendo una durata del tubo di circa 2-3 anni. I reattori imballati e rivestiti in mattoni sono collegati alla serpentina di riscaldamento per offrire ulteriore tempo di residenza e alloggiamento per i letti del catalizzatore.
La reazione avviene sia nei tubi che nei reattori, assicurando una conversione quasi completa degli idrocarburi prima che il gas esca dall’ultimo reattore. Il gas che esce dal sistema del forno di reazione passa attraverso un condensatore di zolfo, dove la maggior parte dello zolfo in eccesso viene separato.
Successivamente, il gas raffreddato procede verso uno scrubber di zolfo e poi verso lo scrubber CS2, dove lo zolfo rimanente viene rimosso. Il gas relativamente privo di zolfo entra nei condensatori raffreddati ad acqua per la separazione in massa del disolfuro di carbonio.
Il disolfuro di carbonio rimanente viene estratto dal gas di idrogeno solforato nell’assorbitore di olio. Il gas di idrogeno solforato che esce dall’assorbitore di olio contiene circa l’1-2% di metano e meno di 1000 ppm di disolfuro di carbonio.
Questo gas viene indirizzato a un impianto di recupero dello zolfo Claus, dove subisce una riconversione in zolfo.
Il disolfuro di carbonio grezzo, incluso quello recuperato nello stripper, viene inviato alla colonna stabilizzatrice per eliminare le impurità bassobollenti.
I fondi della colonna stabilizzatrice vengono quindi sottoposti a lavorazione nella colonna di purificazione per separare i contaminanti ad alto punto di ebollizione dal prodotto. La purificazione del prodotto viene completata tramite lavaggi con acqua e caustici, dopodiché il prodotto finito viene pompato per controllare i serbatoi e lo stoccaggio.
4. Utilizzi del disolfuro di carbonio
Il principale consumatore di disolfuro di carbonio è l’industria della cellulosa rigenerata, che rappresenta oltre il 65% della produzione mondiale. Nello specifico, la produzione di rayon utilizza una porzione significativa di disolfuro di carbonio, con circa 0,32 kg di disolfuro di carbonio consumati per ogni chilogrammo di rayon prodotto.
Circa il 10% di disolfuro di carbonio viene utilizzato nella produzione di cellophane, mentre un altro 10% viene clorurato per produrre tetracloruro di carbonio. Questo metodo rappresenta circa il 25% della produzione globale di tetracloruro di carbonio.
Il restante 15% di disolfuro di carbonio è distribuito tra varie applicazioni, tra cui prodotti chimici per gomma, agenti di flottazione, pesticidi, reagenti chimici vari, solventi di estrazione, agenti di presolfitazione del catalizzatore e solventi per pozzi petroliferi.
Tuttavia, l’industria della cellulosa rigenerata deve affrontare sfide dovute alla concorrenza di fibre e pellicole sintetiche, che ne limitano la crescita di mercato. Per favorire il progresso, è necessario un graduale miglioramento nell’uso del disolfuro di carbonio, in particolare attraverso un maggiore utilizzo nella produzione di prodotti chimici agricoli e speciali.
Riferimento
- Carbon Disulfide; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a05_185
