Cloruro cianurico: proprietà, reazioni, produzione e usi
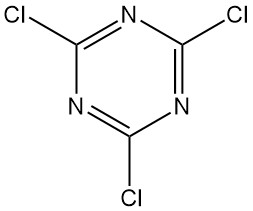
Cos’è il cloruro cianurico?
Il cloruro cianurico, noto anche come 2,4,6-tricloro-1,3,5-triazina, è un composto organico di formula C3N3Cl3. Si presenta come un solido cristallino incolore dall’odore pungente. È il derivato clorurato della 1,3,5-triazina e il trimero del cloruro di cianogeno.
Sommario
1. Proprietà fisiche del cloruro cianurico
Il cloruro cianurico forma cristalli monoclini incolori dall’odore pungente, che ricorda l’acetammide e i cloruri acidi. È solubile nella maggior parte dei solventi organici ma insolubile in acqua.
La Tabella 1 mostra la solubilità (in percentuale in peso) del cloruro cianurico in vari solventi a 25 °C.
| Solvente | Solubilità (% in peso) |
|---|---|
| Acetone | 25,0 |
| Acetonitrile | 21,0 |
| Acrilonitrile | 19,0 |
| Benzene | 19,0 |
| Clorobenzene | 16,0 |
| Tetraclorometano | 7,5 |
| Etere dietilico | 14,0 |
| Diossano | 55,0 |
| Acetato di etile | 21,0 |
| Metilvinile chetone | 27,0 |
| Nitrobenzene | 18,0 |
| Tetraidrofurano | 43,0 |
| Triclorometano | 20,0 |
| Toluene | 18,5 |
Il cloruro cianurico sublima prima di raggiungere il punto di ebollizione. La tensione di vapore del cloruro cianurico liquido in funzione della temperatura è data dalla seguente equazione:
ln p (mmHg) = -0,33480-742,7311/T(K)+11,15147 ln T(K)
Le principali proprietà fisiche del cloruro cianurico sono elencate nella tabella seguente.
| Proprietà | Valore |
|---|---|
| Numero CAS | [108-77-0] |
| Formula | C3N3Cl3 |
| Peso molecolare | 184,5 g/mol |
| Punto triplo | 145,7 °C a 255 kPa |
| Punto di ebollizione punto | 194 °C |
| Densità (solido) | 1,92 g/cm3 |
| Densità (fuso) | 1,48 g/cm3 |
| Capacità termica | 0,99 kJ kg-1 K-1 a 150 °C |
| Calore di fusione | 123 kJ/kg |
| Calore di vaporizzazione | 256 kJ/kg |
2. Reazioni del cloruro cianurico
In condizioni anidre, il cloruro cianurico agisce come agente clorurante. Alcoli e ammine terziarie vengono convertiti in cloruri alchilici, mentre gli acidi carbossilici in acetone anidro con trietilammina formano cloruri acidi, che vengono isolati o utilizzati in situ per la produzione di esteri e ammidi. L’acido cianurico è un sottoprodotto in entrambi i casi.
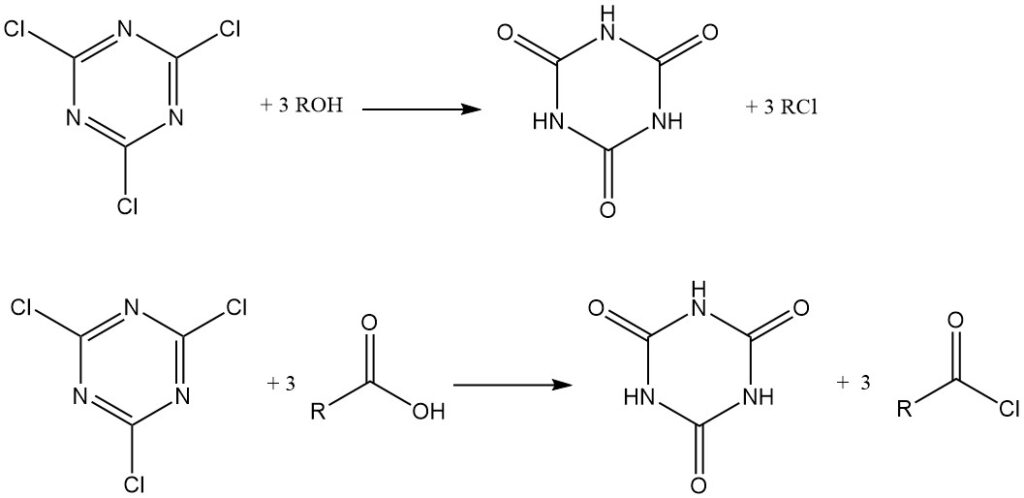
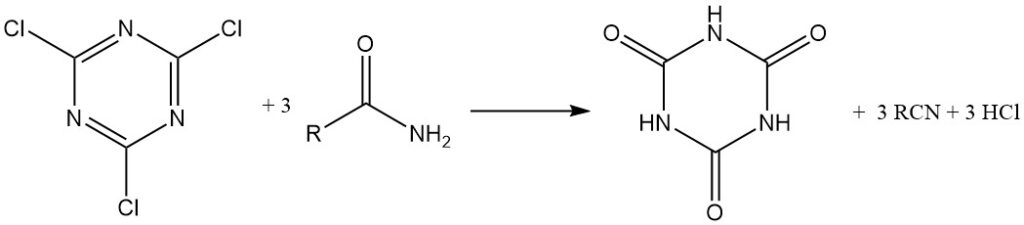
Può anche essere utilizzato come reagente di condensazione (disidratante). Ammidi, tioammidi e aldossime possono essere convertite in nitrili.
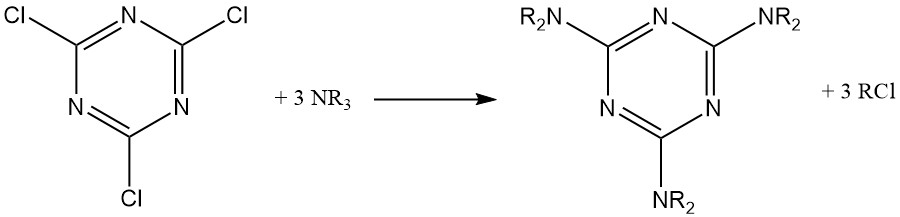
In condizioni anidre, le ammine alifatiche terziarie reagiscono con il cloruro cianurico per formare derivati della melammina sostituita, con un gruppo alchilico convertito nel corrispondente cloruro alchilico.
Il cloruro cianurico reagisce tipicamente come il cloruro acido, formando acido cloridrico. Mentre una sospensione in acqua ghiacciata mostra una certa stabilità (fino a 12 ore a 0 °C), l’idrolisi viene accelerata all’aumentare della temperatura, con oltre il 40% idrolizzato entro 1 ora a 30 °C. L’acido cianurico è il prodotto finale dell’idrolisi.
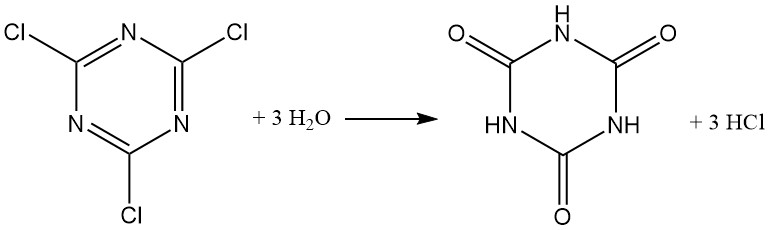
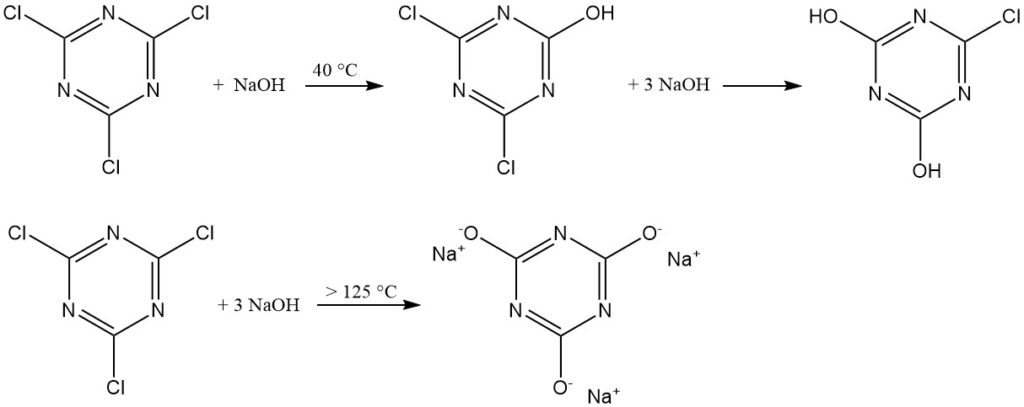
I mezzi acquosi alcalini (NaOH o NaHCO3 a 40 °C) promuovono la formazione di 2,4-dicloro-6-idrossi-1,3,5-triazina. Un eccesso di base produce 2,4-diidrossi-6-cloro-1,3,5-triazina. La formazione di cianurato trisodico avviene solo al di sopra di 125 °C.
La temporanea stabilità del cloruro cianurico in acqua consente reazioni con nucleofili forti (come alcoli, tioli e ammine primarie e secondarie) in sospensioni di acqua ghiacciata. Queste reazioni spesso procedono passo dopo passo per ottenere la trisostituzione a temperature controllate.
Una regola empirica suggerisce di sostituire il primo cloro a 0-5 °C, il secondo a 30-50 °C e il terzo a 70-100 °C per i sostituenti amminici. Gli scavenger di HCl includono idrossido di sodio, bicarbonato di sodio, bifosfato disodico e ammine terziarie.
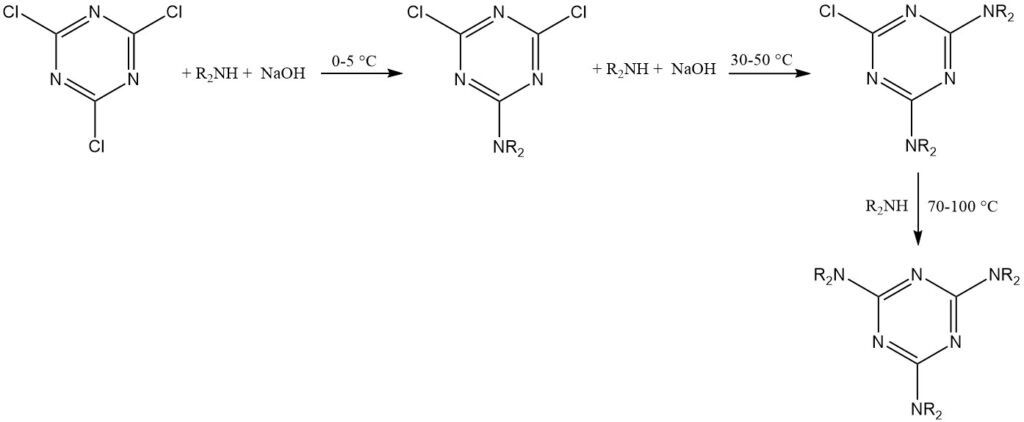
Il prodotto triazina viene tipicamente isolato per filtrazione o centrifugazione. Acetone, metil etil chetone o toluene sono solventi comuni per queste reazioni.
Il cloruro cianurico (fuso o in polvere) viene disciolto/sospeso nel solvente con il nucleofilo e quindi trattato con NaOH acquosa. Il prodotto viene isolato dallo strato organico per evaporazione o filtrazione.
Questo metodo consente l’introduzione sequenziale di vari sostituenti a diverse temperature. Potrebbero essere necessari solventi altobollenti o il reagente fuso per sostituire il terzo atomo di cloro.
La neutralizzazione dell’acido cloridrico liberato e la dissipazione del calore durante le reazioni sono cruciali. L’idrolisi esotermica del cloruro cianurico (ΔH = -2164 kJ/kg) può diventare incontrollabile, soprattutto nella produzione di cianurato da alcoli.
I solventi miscibili in acqua accelerano l’idrolisi. La conservazione di soluzioni di cloruro cianurico in acetone acquoso senza un’adeguata rimozione del calore può portare a reazioni incontrollabili anche a temperatura ambiente.
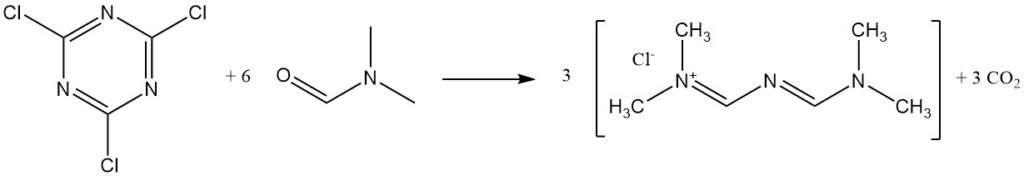
Il cloruro cianurico reagisce con la DMF per formare il Gold’s salt.
3. Produzione di cloruro cianurico
Gli impianti di produzione di cloruro cianurico si trovano in genere in prossimità di impianti di produzione di acido cianidrico (HCN), la materia prima principale. Anche il cianuro di sodio può essere utilizzato, ma in misura minore.
Il processo di produzione del cloruro cianurico prevede due fasi principali: la clorurazione dell’HCN a cloruro di cianogeno (ClCN) e la trimerizzazione del ClCN a cloruro cianurico.
Inizialmente, l’HCN reagisce con il cloro (Cl2) in un reattore a ciclo continuo a temperature moderate, comprese tra 20 e 40 °C, per formare ClCN. Questa reazione è esotermica (ΔH = -89 kJ/mol).
Successivamente, il ClCN viene separato, purificato e quindi trimerizzato (combinando tre molecole in una) su carbone attivo a temperature superiori a 300 °C. Anche questa fase è esotermica (ΔH = -233 kJ/mol).
La Figura 1 illustra un processo dettagliato per la produzione di cloruro cianurico da cloro e acido cianidrico.
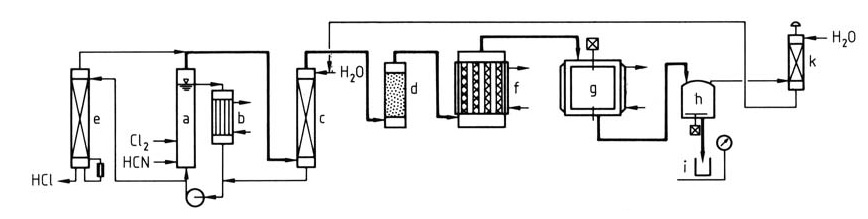
a) Reattore ClCN; b) Scambiatore di calore; c) Scrubber; d) Essiccatore; e) Stripper degli effluenti; f) Trimerizzatore; g) Condensatore; h) Stoccaggio; i) Tamburo; k) Scrubber dei gas di coda
Una miscela di HCN e Cl2 viene immessa nel reattore a circuito chiuso (a e b). La soluzione acquosa satura di ClCN esce dal circuito, quindi il ClCN viene lavato con acqua (c) per rimuovere le impurità e essiccato (d).
L’acqua di lavaggio contenente HCl viene inviata a uno stripper (e) per recuperare il ClCN disciolto e rilasciare HCl concentrato per ulteriori utilizzi. In alternativa, le sezioni (e), (a) e (c) possono essere combinate in un’unica unità. Il ClCN purificato e essiccato viene sottoposto a trimerizzazione (f) su carbone attivo per formare vapori di cloruro cianurico.
I vapori vengono condensati in cloruro cianurico fuso o solido (g). Il prodotto può essere disciolto in un solvente per uso interno o confezionato in contenitori (h e i). I gas di coda vengono depurati e riciclati (k) per ridurre al minimo gli sprechi.
Questo processo raggiunge in genere rese di ClCN superiori al 95% e di cloruro cianurico superiori al 90%.
Diverse varianti mirano a eliminare la formazione di HCl diluito durante la produzione di ClCN. Tra queste, reazioni in fase gassosa monofase con carbone attivo, tetracloroetano o cianogeno e cloro su carbone attivo.
Sono stati esplorati altri catalizzatori per la trimerizzazione di ClCN, come cloruro cianurico fuso, cloruri metallici, miscele eutettiche e zeoliti.
In laboratorio, soluzioni di ClCN in solventi organici come benzene e cloroformio possono essere trimerizzate utilizzando HCl. I processi commerciali potrebbero utilizzare l’azeotropo cloruro di idrogeno-dimetil etere per la trimerizzazione.
Le apparecchiature per la produzione di ClCN utilizzano materiali resistenti alla corrosione, come vetro, fluoropolimeri, grafite o resine speciali. Le apparecchiature per la produzione di cloruro cianurico utilizzano tipicamente nichel, acciaio inossidabile o alluminio.
L’umidità è un problema significativo in questo processo e può causare grave corrosione. Attrezzature, materiali e procedure di manipolazione adeguati sono importanti per ridurre questo rischio.
4. Usi del cloruro cianurico
Il cloruro cianurico è utilizzato come precursore di pesticidi ed erbicidi, nella produzione di coloranti, sbiancanti e stabilizzanti UV nelle materie plastiche e nella sintesi organica.
I derivati più significativi del cloruro cianurico sono le amminotriazine, in particolare le alchilamminotriazine, che vengono utilizzate come pesticidi ed erbicidi. Gli erbicidi a base di triazina rimangono tra i più efficaci a livello commerciale, con la maggior parte delle formulazioni contenenti 2-cloro- o 2-metiltio-4,6-dialchilammino-1,3,5-triazine.
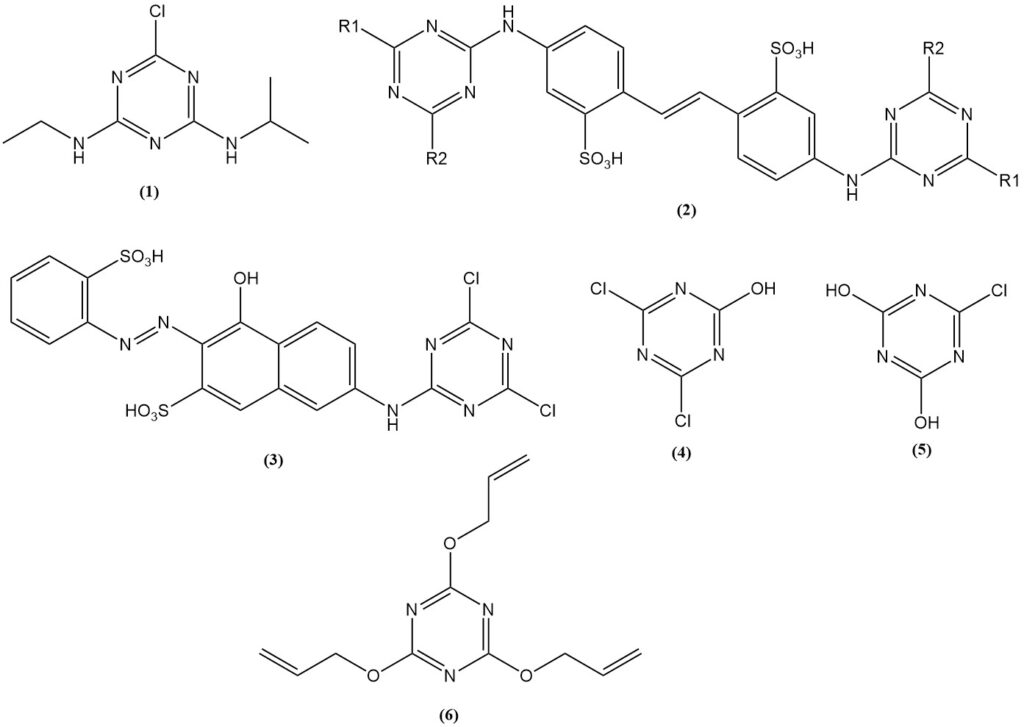
L’atrazina (1) è l’erbicida triazinico più importante, responsabile di oltre il 70% del consumo di cloruro cianurico destinato alla produzione di erbicidi. Gli erbicidi a base di triazina sono prodotti a livello globale.
Meno del 30% della produzione di cloruro cianurico viene utilizzata in altre applicazioni industriali, come sbiancanti ottici, stabilizzanti UV, coloranti reattivi e agenti reticolanti.
I prodotti di reazione degli amminostilbeni con triazine sostituite, in particolare gli acidi bis(triazinilammino)stilbenedisolfonico (2), sono utilizzati come agenti sbiancanti per tessuti e carta.
I derivati coloranti preparati a partire dal cloruro cianurico possono reagire chimicamente con i tessuti. I coloranti Procion (3) furono tra i primi.
Il cloruro cianurico e i cianurati vengono utilizzati nella produzione di gelatina e colle. Alcuni esempi includono i sali di sodio di 2,4-dicloro-6-idrossi-1,3,5-triazina (4) e 2,4-diidrossi-6-cloro-1,3,5-triazina (5). Inoltre, il triallil cianurato (6) viene utilizzato nell’industria della gomma e delle materie plastiche.
Le triazine hanno vari altri usi, tra cui come modificatori, acceleratori, ritardanti di fiamma, prodotti farmaceutici, antiossidanti, antiozonanti e scavenger di metalli pesanti.
5. Tossicologia del cloruro cianurico
Il cloruro cianurico è un grave irritante per la pelle, le mucose (inclusi gli occhi), le vie respiratorie e il tratto gastrointestinale. La sua soglia di irritazione a 1 minuto per le mucose è eccezionalmente bassa, pari a 0,3 mg/m³. Possono verificarsi anche reazioni allergiche.
Il contatto diretto con il cloruro cianurico deve essere rigorosamente evitato. Garantire un’adeguata ventilazione negli ambienti di lavoro.
Quando si maneggiano vapori o polveri di cloruro cianurico, indossare una maschera antigas a pieno facciale dotata di filtro a carbone attivo o utilizzare un autorespiratore.
Il cloruro cianurico è etichettato con il simbolo di pericolo Xi e assegnato alle frasi di rischio (frasi R) R 36/37/38, che indicano irritazione per gli occhi, le vie respiratorie e la pelle. Inoltre, le frasi di sicurezza (S) 28 sottolineano la necessità di indossare indumenti protettivi adeguati.
Per un’etichettatura di sicurezza completa, è necessario applicare anche le seguenti frasi R e S:
- R 22: Nocivo per ingestione
- R 26: Molto tossico per inalazione
- R 41/43: Può provocare sensibilizzazione per inalazione e contatto con la pelle
- S 36/37/39: Indossare indumenti protettivi, guanti e protezioni per occhi/viso adatti
- S 45: In caso di incidente o di malessere, consultare immediatamente un medico
Quando si aggiunge polvere di cloruro cianurico a solventi infiammabili, utilizzare imbuti con messa a terra per evitare scariche elettrostatiche. Solo personale qualificato e formato nelle corrette procedure di manipolazione deve essere autorizzato a lavorare con il cloruro cianurico.
Riferimento
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191
