Cicloesanone: proprietà, reazioni, produzione e usi
Cos’è il cicloesanone?
Il cicloesanone, noto anche come chetoesametilene o chetone pimelico, è un composto organico con formula chimica C6H10O. È un liquido da incolore a giallo pallido con un odore simile a quello dell’acetone, molto solubile nella maggior parte dei solventi organici.
Fu sintetizzato per la prima volta per distillazione a secco del pimelato di calcio, e successivamente da Bouveault per deidrogenazione catalitica del cicloesanolo.
Il cicloesanone viene prodotto industrialmente su larga scala come materia prima per la produzione di nylon.
Sommario
1. Proprietà fisiche del cicloesanone
Il cicloesanone è un liquido incolore con un odore simile a quello della menta piperita e dell’acetone. È molto solubile in metanolo, etanolo, acetone, benzene, n-esano, nitrobenzene, etere dietilico, nafta, xilene, glicole etilenico, acetato di isoamile, dietilammina e nella maggior parte dei solventi organici.
Il cicloesanone può sciogliere una varietà di prodotti, come nitrato di cellulosa, acetato di cellulosa, eteri di cellulosa, resine viniliche, gomma grezza, cere, grassi, gommalacca, coloranti basici, oli, lattice, bitume, kaure ed elemi. Forma un azeotropo con acqua che bolle a 96,6 °C con una composizione acqua:cicloesanone di 56:44.
Le proprietà fisiche del cicloesanone sono presentate nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero CAS | [108-94-1] |
| Formula chimica | C6H10O |
| Peso molecolare | 98,15 g/mol |
| Punto di fusione | -47 °C |
| Punto di ebollizione | 156,4 °C |
| Pressione di vapore | 0,52 kPa a 20 °C |
| Densità | 0,9455 g/cm3 |
| Indice di rifrazione | 1,4552 |
| Coefficiente di dilatazione | 9,14 × 10-4 |
| Viscosità dinamica | 1,803 mPa · s a 30 °C |
| Specifica calore | 1,811 j/g |
| Tensione superficiale | 33,51 mN/m a 30 °C |
| Calore di fusione | 1,501 kJ/mol |
| Calore di combustione | -3,521 MJ/mol |
| Calore di vaporizzazione | 44,92 kJ/mol |
| Calore di formazione | -272 kJ/mol |
| Punto di infiammabilità | 54 °C |
| Temperatura di autoaccensione | 420 °C |
| Solubilità in acqua a 20 °C | 9,0 g/100 g di acqua |
2. Reazioni del cicloesanone
A causa della presenza di un gruppo carbonilico, il cicloesanone subisce una varietà di reazioni tipiche dei chetoni alifatici. Circa lo 0,02% della molecola è presente nell’enolo tautomero a temperatura ambiente.
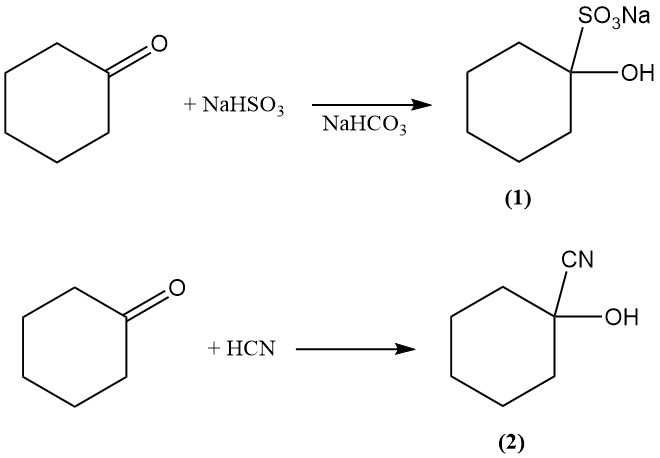
La reazione di addizione del cicloesanone con bisolfito e acido cianidrico produce rispettivamente 1-idrossicicloesano-1-solfonato (1) e 1-idrossicicloesano-1-carbonitrile (2).
La reazione di Grignard forma alcoli terziari dopo idrolisi.
L’idrogenazione catalitica o la riduzione del cicloesanone utilizzando boroidruro di sodio o idruro di litio e alluminio produce cicloesanolo, mentre condizioni più rigorose formano cicloesano.
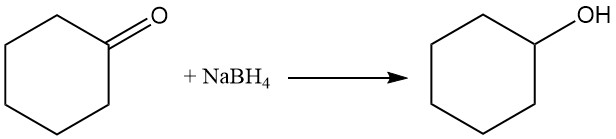
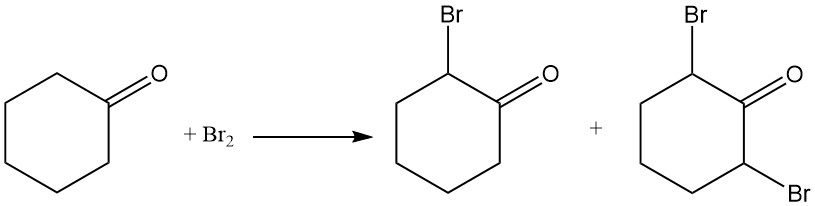
Il cicloesanone reagisce con il cloro o il bromo per formare composti alogenati nella posizione α o in entrambe le posizioni 2 e 6.
Può facilmente subire condensazione aldolica base-catalizzata con se stesso o con altre aldeidi o chetoni.
Il cicloesanone forma enammine quando reagisce con ammine secondarie.
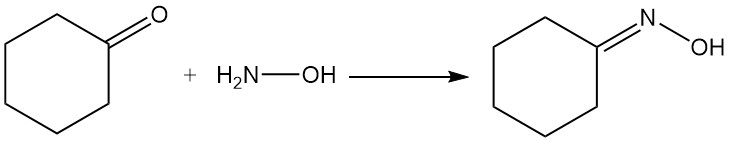
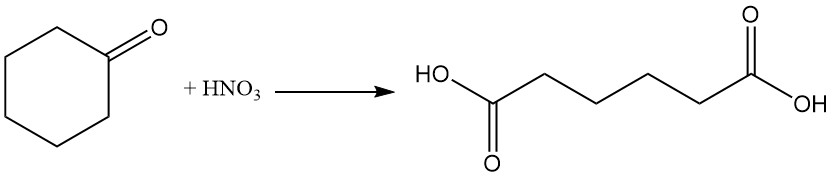
Reazioni del cicloesanone di importanza industriale sono la formazione di ossima di cicloesanone per reazione con idrossilammina e l’ossidazione con acido nitrico ad acido adipico.
3. Produzione industriale di cicloesanone
Il cicloesanone viene prodotto commercialmente attraverso i seguenti processi principali:
- Deidrogenazione del cicloesanolo
- Ossidazione del cicloesano
- Idrogenazione del fenolo
La maggior parte degli impianti su larga scala utilizza la tecnologia di ossidazione del cicloesano per produrre una miscela di cicloesanolo e cicloesanone. DSM in Olanda e Allied Signal Corp. negli Stati Uniti sono gli unici grandi impianti rimasti che utilizzano ancora l’idrogenazione del fenolo.
Per ossidare il cicloesanolo a cicloesanone vengono utilizzati processi catalitici e non catalitici.
3.1. Produzione di cicloesanone mediante idrogenazione del fenolo
La distribuzione dei prodotti di idrogenazione del fenolo, inclusi cicloesanolo, cicloesanone o una loro miscela, dipende dalla scelta del catalizzatore e dalle condizioni di reazione.
La Figura 1 illustra la produzione di cicloesanone in fase vapore a partire dal fenolo.
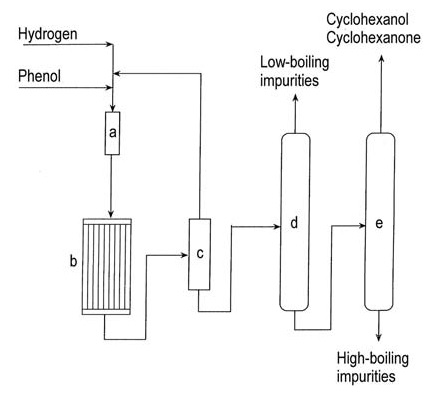
a) Evaporatore del fenolo; b) Reattore di idrogenazione; c) Condensatore; d) Colonna di rimozione a bassa temperatura; e) Colonna di recupero cicloesanolo/cicloesanone
L’idrogenazione del fenolo a cicloesanone in fase vapore utilizza diversi catalizzatori a base di metalli nobili supportati, tra cui palladio, platino, iridio, rutenio, rubidio e osmio. La reazione avviene a 140-170 °C a pressione atmosferica e raggiunge una resa del 95% a conversione completa.
L’idrogenazione commerciale in fase liquida del fenolo utilizzando palladio su un catalizzatore a carbone produce >99% di cicloesanone con una conversione del 90% in condizioni blande.
3.2. Produzione di cicloesanone mediante deidrogenazione del cicloesanolo
La deidrogenazione del cicloesanone produce cicloesanone, un precursore del caprolattame.
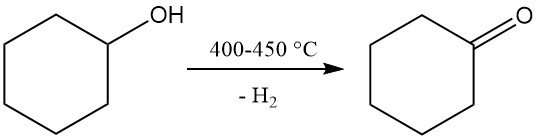
La deidrogenazione non catalitica in fase vapore del cicloesanolo viene effettuata a una temperatura di 400-450 °C. I vapori generati vengono raffreddati, l’idrogeno viene separato e il cicloesanone grezzo, contenente cicloesene e acqua come sottoprodotti, viene purificato tramite distillazione. La purezza del cicloesanone risultante raggiunge il 98-99%.
La deidrogenazione catalitica del cicloesanolo a cicloesanone utilizzando catalizzatori come ossido di cromo-rame, cromato di rame, nichel, solfuro di zinco, zinco-ferro, carbonato di cobalto e altri metalli avviene in condizioni più miti e garantisce rese migliori.
3.3. Produzione di cicloesanone mediante ossidazione del cicloesano
L’ossidazione in fase liquida del cicloesano a cicloesanolo e cicloesanone viene solitamente effettuata, non catalizzata o con un catalizzatore solubile al cobalto, in una serie di reattori agitati o in un ossidatore a torre singola a una temperatura di 140-180 °C e una pressione di 0,8-2 MPa.
Il cicloesilidroperossido è un intermedio in questa reazione e viene convertito dagli ossidanti in cicloesanolo, cicloesanone e sottoprodotti.
L’aggiunta di cromo (III) all’ossidatore ad aria catalizza la disidratazione del cicloesilidroperossido a cicloesanone e acqua, conferendo una maggiore selettività per il cicloesanone.
Un altro metodo per aumentare il rapporto tra cicloesanone e cicloesanolo nel prodotto finale consiste nel decomporre il cicloesilidroperossido con una fase caustica acquosa contenente poche ppm di cobalto.
Un diagramma di flusso di questo processo caustico è mostrato in Figura 2.
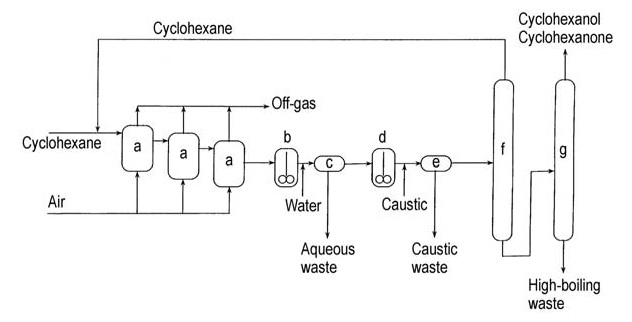
a) Ossidatori ad aria; b) Decantatore con lavaggio ad acqua; c) Decantazione; d) Reattore di decomposizione caustica; e) Decantazione caustica; f) Colonna di recupero del cicloesano; g) Colonna di recupero del cicloesanolo/cicloesanone
Il prodotto grezzo di questo processo contiene una miscela di cicloesanone e cicloesanolo, che può essere separata per distillazione e convertita in cicloesanone mediante deidrogenazione per aumentarne la resa complessiva.
4. Usi del cicloesanone
Oltre il 97% di tutto il cicloesanone prodotto viene utilizzato come materia prima per la produzione di acido adipico e caprolattame, impiegati nella produzione industriale di nylon.
Il cicloesanone viene anche utilizzato come solvente per lacche, resine, polimeri e altri composti. Altri usi includono l’impiego come materiale di partenza nella sintesi di insetticidi, erbicidi e prodotti farmaceutici.
Il cicloesanone viene utilizzato nella produzione di nastri magnetici e videocassette.
La conformità alla Norma 66 della California ne consente l’uso come sostituto dell’isoforone per applicazioni in solventi per resine e polimeri.
5. Tossicologia del cicloesanone
Il cicloesanone presenta una bassa tossicità per via orale, cutanea e inalatoria. Il contatto con liquidi o vapori può indurre una lesione corneale transitoria. Il contatto cutaneo prolungato o significativo può causare irritazione e sgrassamento.
L’esposizione per inalazione ha causato congestione polmonare, edema ed emorragia. Elevate concentrazioni di vapore o esposizione ripetuta possono portare a depressione del sistema nervoso centrale.
I valori di LD50 variavano da 0,93 a 1,54 g/kg (ip) e da 1,8 a 2,1 g/kg (intragastrica) negli studi sugli animali, con le cavie che hanno mostrato la massima sensibilità.
Sebbene esistano risultati sia positivi che negativi sull’attività genetica, le prove di cancerogenicità rimangono inconcludenti. Il cicloesanone ha dimostrato di non essere teratogeno nei ratti e nei topi.
Studi di inalazione su due generazioni di ratti non hanno rivelato effetti avversi su crescita, sviluppo o riproduzione a 1000 ppm per una generazione o a 250/500 ppm per due generazioni.
L’esposizione della progenie a 1400 ppm ha provocato effetti reversibili, tra cui letargia, riduzione della fertilità maschile e riduzione della sopravvivenza e del peso della progenie.
È stato stabilito un NOEL di almeno 500 ppm. Il limite di esposizione professionale (PEL) OSHA e il limite di esposizione professionale (TLV) ACGIH per il cicloesanone sono pari a 25 ppm (100 mg/m³) con annotazione sull’assorbimento cutaneo.
Si applicano le precauzioni standard per la manipolazione di solventi volatili, tra cui ventilazione, evitare l’inalazione e il contatto con la pelle, prevenire l’ingestione e proteggere gli occhi.
Riferimenti
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://www.sciencedirect.com/science/article/abs/pii/0041008X7990454X
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanone
