Acido solfammico: proprietà, reazioni, produzione e usi
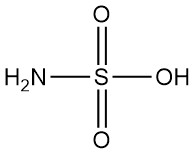
Cos’è l’acido solfammico?
L’acido solfammico, noto anche come acido amidosolforico, è un acido inorganico forte con formula chimica H3NSO3. È un solido bianco, inodore, cristallino e non igroscopico, fortemente dissociato in acqua.
L’acido solfammico viene prodotto industrialmente da circa mezzo secolo. Nel periodo dal 1950 al 1980, sono stati aperti impianti di produzione in diverse nazioni industrializzate in previsione di una crescente domanda di mercato.
Tuttavia, il successivo calo della domanda di prodotto, insieme alle difficoltà di produzione e alle difficoltà legate allo smaltimento dei sottoprodotti, ha portato alla chiusura di tutti gli impianti di produzione in Europa e negli Stati Uniti. La produzione continua in Giappone (Nissan) e a Taiwan (diversi produttori).
Sommario
1. Proprietà fisiche dell’acido solfammico
L’acido solfammico è un solido bianco, cristallino e non volatile a temperatura ambiente. Forma una soluzione acquosa fortemente acida con un pH di 1,18 per una soluzione all’1%. La solubilità dell’acido solfammico in acqua aumenta con l’aggiunta di altri acidi o sali e mostra una solubilità limitata negli acidi inorganici concentrati e nella maggior parte dei solventi organici.
La solubilità in acqua dipende dalla temperatura, come dettagliato nella Tabella 1.
| Temperatura (°C) | Solubilità (g/100 g) | Concentrazione (% in peso) |
|---|---|---|
| 0 | 14,7 | 12,8 |
| 10 | 18,5 | 15,6 |
| 20 | 21,3 | 17,5 |
| 30 | 26,1 | 20,7 |
| 40 | 29,5 | 22,8 |
| 50 | 32,8 | 24,7 |
| 60 | 37,1 | 27,0 |
| 70 | 41,9 | 29,5 |
| 80 | 47,0 | 32.0 |
Nella tabella seguente sono riportate le principali proprietà fisiche dell’acido solfammico.
| Proprietà | Valore |
|---|---|
| Numero CAS | [5329-14-6] |
| Formula chimica | H3NSO3 |
| Peso molecolare | 97,1 g/mol |
| Punto di fusione | 205 °C |
| Costante di dissociazione | 1,10 x 10-1 |
| Densità a 25 °C | 2,126 g/cm3 |
| Calore specifico | 1,1467 J/g |
| Pressione di vapore a 20 °C | 0,8 Pa |
| Pressione di vapore a 100 °C | 0,25 Pa |
2. Reazioni chimiche dell’acido solfammico
Riscaldando l’acido solfammico a temperature superiori a 209 °C, si decompone in anidride solforosa, anidride solforosa, acqua, ammoniaca e azoto.
Le soluzioni acquose di acido solfammico si idrolizzano per formare idrogenosolfato di ammonio:
NH2SO3H + H2O → NH4HSO4
La velocità di idrolisi dipende da concentrazione, pH e temperatura. Le soluzioni acquose diluite sono stabili a temperatura ambiente. Una soluzione al 10% di acido solfammico viene idrolizzata al 50% a una temperatura di 80 °C per 10 ore.
L’acido solfammico può essere ossidato in presenza di cloro, bromo e clorati per produrre acido solforico.
2 NH2SO3H + KClO3 → 2 H2SO4 + N2 + KCl + H2O
Riscaldando l’acido nitrico concentrato con acido solfammico, si forma ossido di diazoto.
NH2SO3H + HNO3 → H2SO4 + N2O + H2O
L’acido nitroso reagisce completamente con l’acido solfammico per produrre azoto e acido solforico, quindi questa reazione può essere utilizzata per analisi quantitative.
NH2SO3H + HNO2 → H2SO4 + H2O + N2
La reazione con il cloruro di tionile porta alla formazione di cloruro di solfamile:
NH2SO3H + SOCl2 → ClSO2NH2 + SO2 + HCl
L’acido solfammico dissolve idrossidi, ossidi e carbonati metallici.
Gli alcoli primari e secondari reagiscono con l’acido solfammico per formare solfati di alchilammonio.
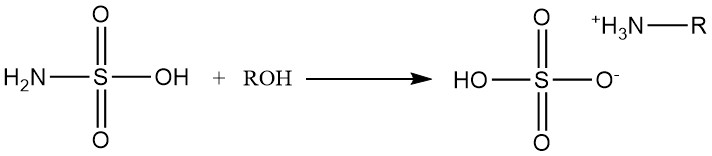
Le reazioni alcoliche secondarie richiedono la presenza di catalizzatori amminici e gli alcoli terziari non reagiscono con l’acido solfammico.
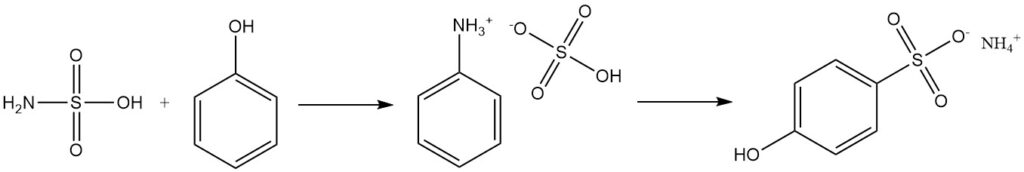
Gli alcoli aromatici come il fenolo reagiscono con l’acido solfammico per produrre solfonati, con il solfato di fenilammonio come intermedio.
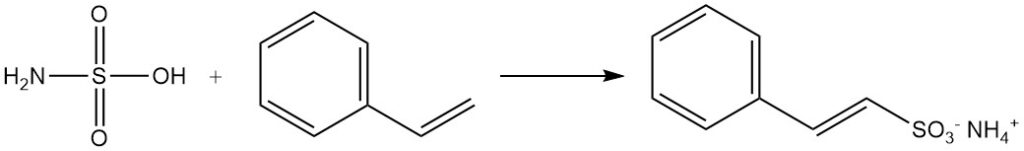
Le aldeidi formano prodotti di addizione con sali di acido solfammico. I composti aromatici con catene laterali insature, come lo stirene, subiscono solfonazione da parte dell’acido solfammico, preservando il doppio legame della catena laterale.
3. Produzione di acido solfammico
La produzione di acido solfammico utilizza esclusivamente il processo dell’urea, con impianti che utilizzano ammoniaca e anidride solforica ormai cessati.
L’acido solfammico viene prodotto direttamente facendo reagire quantità equimolari di urea, anidride solforica e acido solforico.
NH2CONH2 + SO3 + H2SO4 → 2 NH2SO3H + CO2
Questa reazione è fortemente esotermica e prevede un processo in due fasi, secondo le seguenti reazioni:
NH2CONH2 + SO3 → NH2CONHSO3H
NH2CONHSO3H + H2SO4 → 2 NH2SO3H + CO2
Nella fase iniziale, l’urea viene agitata con acido solforico in eccesso e Anidride solforica. La temperatura viene mantenuta al di sotto dei 40 °C per inibire la formazione di anidride carbonica. La seconda fase prevede la reazione del prodotto della prima fase in presenza di un eccesso di anidride solforica a una temperatura compresa tra 50 e 80 °C per produrre acido solfammico e anidride carbonica.
Dopo la rimozione dell’eccesso di anidride solforica, si ottiene acido solfammico con una purezza superiore al 95% e un prodotto ad elevata purezza si ottiene mediante ricristallizzazione.
Secondo un brevetto Nissan, l’acido solfammico viene prodotto facendo reagire l’urea con l’oleum (xH2SO4 · ySO3).
Il prodotto di reazione viene ricristallizzato a umido, seguito dalla separazione e dall’essiccazione dell’acido cristallizzato. La macinazione ad alta pressione, con una pressione compresa tra 600 e 1500 kg/m², produce un prodotto cristallino fine con un diametro medio delle particelle ≤ 500 μm.
4. Usi dell’acido solfammico
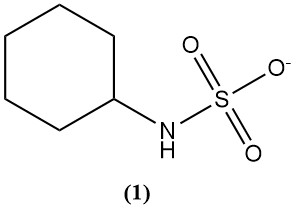
L’acido solfammico viene utilizzato principalmente per sintetizzare il ciclamato (1), un dolcificante artificiale.
L’acido solfammico viene utilizzato anche nei prodotti per la pulizia per rimuovere depositi di carbonato e fosfato, come le incrostazioni delle caldaie, grazie alla sua capacità di formare sali solubili e alla sua relativamente bassa corrosività verso i metalli.
Viene utilizzato per la pulizia di macchinari e strumenti in settori come quello cartario, zuccheriero, lattiero-caseario e della birra, nonché per l’eliminazione di depositi all’interno di impianti di evaporazione, scambiatori di calore e sistemi di raffreddamento.
In alcuni paesi, l’acido solfammico viene utilizzato per trattare alcoli grassi o etossilati in un processo su scala industriale per la produzione di precursori della cera.
L’acido solfammico viene utilizzato anche come stabilizzante del cloro, nella produzione di coloranti, nei processi di galvanica e nell’industria cartaria e tessile.
In laboratorio, viene impiegato nella chimica analitica.
5. Tossicologia dell’acido solfammico
L’acido solfammico è generalmente considerato a bassa tossicità. Le sue proprietà fisiologiche sono caratteristiche di un acido minerale forte.
La polvere di acido solfammico può irritare le mucose del naso e della faringe, nonché la congiuntiva degli occhi. Questo è un effetto comune a molti acidi forti.
La somministrazione orale di 1,6 g/kg di acido solfammico ai ratti si è rivelata letale. Ciò indica un certo livello di tossicità, ma è essenziale considerare che si tratta di una dose relativamente elevata e che lo studio è stato condotto sui ratti. La tossicità umana può variare.
L’acido solfammico, come altri acidi forti, è corrosivo per la pelle, gli occhi e le vie respiratorie. Il contatto diretto deve essere evitato.
Quando si lavora con l’acido solfammico, è essenziale adottare procedure di manipolazione appropriate, incluso l’uso di dispositivi di protezione individuale (DPI) come guanti, occhiali e protezioni respiratorie.
Riferimento
- Sulfamic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a25_439
Sono un chimico organico appassionato e continuo ad apprendere su vari processi di chimica industriale e prodotti chimici. Garantisco che tutte le informazioni su questo sito web siano accurate e meticolosamente referenziate ad articoli scientifici.
