Acido malico: proprietà, produzione e usi
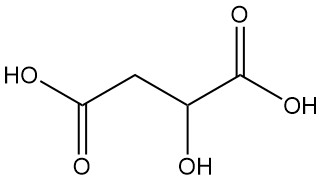
Cos’è l’acido malico?
L’acido malico, noto anche come acido idrossisuccinico o acido idrossibutandioico, è un acido dicarbossilico con formula chimica C4H6O5. È un composto organico naturale caratterizzato da un sapore aspro.
Fu descritto per la prima volta da Sheele che, nel 1785, isolò questo acido da mele acerbe. Il nome malico deriva dal latino “malum”, che significa mela.
L’acido malico è un costituente di vari frutti, in particolare delle mele. Nei sistemi biologici, l’acido malico, nella sua forma ionizzata, il malato, funge da intermedio nel ciclo degli acidi tricarbossilici. Questa via metabolica è cruciale per la produzione di energia.
L’isomero L dell’acido malico è la forma predominante in natura e possiede attività biologica. Sebbene noto principalmente per il suo ruolo negli aromi alimentari, evidenze emergenti suggeriscono potenziali benefici per la salute umana.
L’acido malico è coinvolto nel metabolismo energetico, in particolare in condizioni di ipossia. Studi indicano il suo potenziale per migliorare le prestazioni fisiche e alleviare i sintomi associati alla fibromialgia.
Il metabolismo dell’acido malico è influenzato da enzimi come l’enzima malico. Questo enzima catalizza la decarbossilazione ossidativa del malato in piruvato. Il piruvato generato può subire ulteriori trasformazioni metaboliche, tra cui la conversione in glucosio o ossalacetato.
L’acido malico mostra proprietà antimicrobiche. La sua natura acida contribuisce alla conservazione degli alimenti inibendo la crescita microbica. Tuttavia, la sua efficacia è influenzata da fattori come il pH e specifiche specie microbiche.
Sommario
| Proprietà | Valore |
|---|---|
| Numero CAS | [617-48-1] |
| Formula chimica | C4H6O5 |
| Massa molecolare | 134,09 g/mol |
| Punto di fusione | 131 °C |
| Densità | 1,60 g/cm3 |
| Viscosità di una soluzione acquosa al 50% a 25 °C | 6,5 mPa.s |
| Calore di combustione a 20 °C | -1,340 MJ/mol |
| pKa1 a 20 °C | 3,51 |
| pKa2 a 20 °C | 5,03 |
| Proprietà | Valore |
|---|---|
| Numero CAS | [97-67-6] |
| Punto di fusione | 100 °C |
| Densità a 20 °C | 1,595 g/cm3 |
| Rotazione specifica a 18 °C (7% in peso in H2O) | -2,3° |
| Solubilità in acqua a 20 °C | 36,4 g/100 g |
2. Reazioni chimiche dell’acido malico
Grazie alla presenza di acido carbossilico e gruppi funzionali ossidrilici nell’acido malico, esso è in grado di subire una varietà di reazioni chimiche.
In quanto acido carbossilico, l’acido malico reagisce con le basi per formare sali, come il malato di sodio o il malato di potassio.
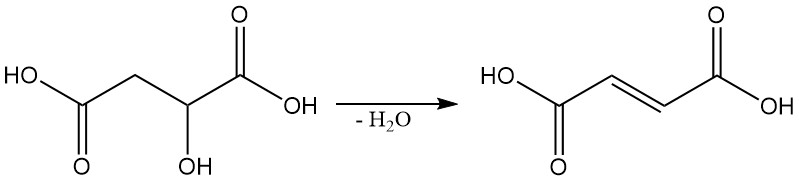
In condizioni specifiche, l’acido malico può essere disidratato per produrre acido fumarico.
La decarbossilazione dell’acido malico produce acido piruvico.
L’acido malico può reagire con gli alcoli per formare esteri, spesso utilizzati come agenti aromatizzanti.
L’acido malico può essere ossidato per produrre vari prodotti, come l’acido ossalacetico, l’acido ossalico e l’anidride carbonica, a seconda delle condizioni.
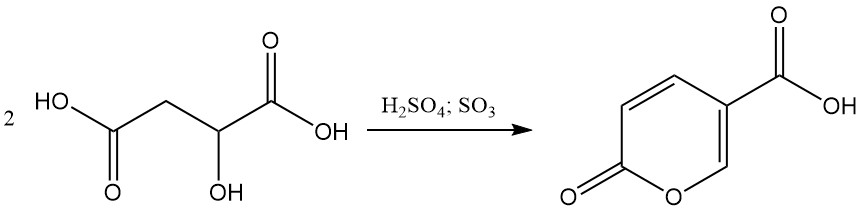
In presenza di acido solforico fumante al 20-30%, l’acido malico subisce un’autocondensazione per formare acido cumalico.
L’acido malico può formare complessi con ioni metallici come calcio e magnesio.
La fermentazione malolattica è un processo comune nella vinificazione in cui l’acido malico viene convertito in acido lattico dai batteri. È anche un intermedio nel ciclo di Krebs, in cui subisce l’ossidazione ad acido ossalacetico.
3. Produzione dell’acido malico
3.1. Produzione chimica dell’acido malico
La sintesi dell’acido malico si basa principalmente su processi chimici, che producono acido D,L-malico racemico. Il precursore, l’anidride maleica, è derivato da idrocarburi fossili, principalmente n-butano. Il benzene, un’ex materia prima, rimane in uso, soprattutto nei paesi asiatici.
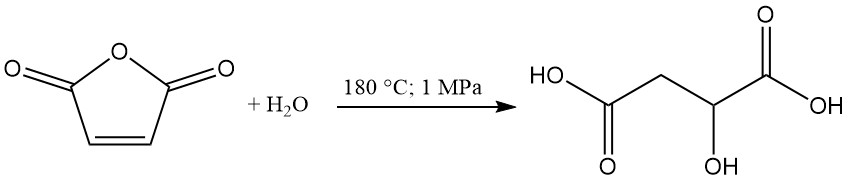
L’acido (R,S)-malico viene prodotto industrialmente negli Stati Uniti e in Canada mediante idratazione dell’anidride maleica. Alberta Gas è l’unico produttore statunitense con una capacità produttiva di circa 5000 tonnellate annue.
In questo processo, l’anidride maleica viene riscaldata a 180 °C a una pressione di 1 MPa per formare acido malico come prodotto primario. L’acido maleico e l’acido fumarico vengono generati come sottoprodotti. L’acido fumarico, grazie alla sua bassa solubilità in acqua, è separabile per filtrazione e riciclabile.
La successiva concentrazione del filtrato produce acido malico. L’acido grezzo viene purificato mediante ripetuti lavaggi, evaporazione e ricristallizzazione per ridurre le impurità di acido fumarico e maleico rispettivamente a 7,5 e <500 ppm.
Per ottenere acido malico di grado farmaceutico, sono necessari ulteriori passaggi di purificazione.
3.2. Produzione enzimatica di acido L-malico
L’acido L-malico enantiopuro, preferito per prodotti farmaceutici e polimeri, è difficile da ottenere tramite la risoluzione racemica dell’acido D,L-malico. La sintesi enzimatica offre un’alternativa selettiva e più delicata.
L’idratazione dell’acido fumarico ad acido L-malico, catalizzata dalla fumarasi, è il principale processo enzimatico. Questo può essere ottenuto utilizzando enzimi purificati, cellule permeabilizzate o liofilizzate o cellule intere.
Microrganismi come Saccharomyces cerevisiae, Brevibacterium flavus, Brevibacterium ammoniagenes e Rhizopus oryzae mostrano alti tassi di conversione, tra l’80% e circa il 100%, nella catalisi cellulare. L’immobilizzazione rende il processo più economico consentendo il riutilizzo del catalizzatore.
3.3. Biosintesi dell’acido malico da parte di microrganismi
La produzione microbica di acido malico offre vantaggi rispetto alla sintesi chimica, tra cui la formazione esclusiva di acido L-malico e l’utilizzo di substrati diversi e rinnovabili.
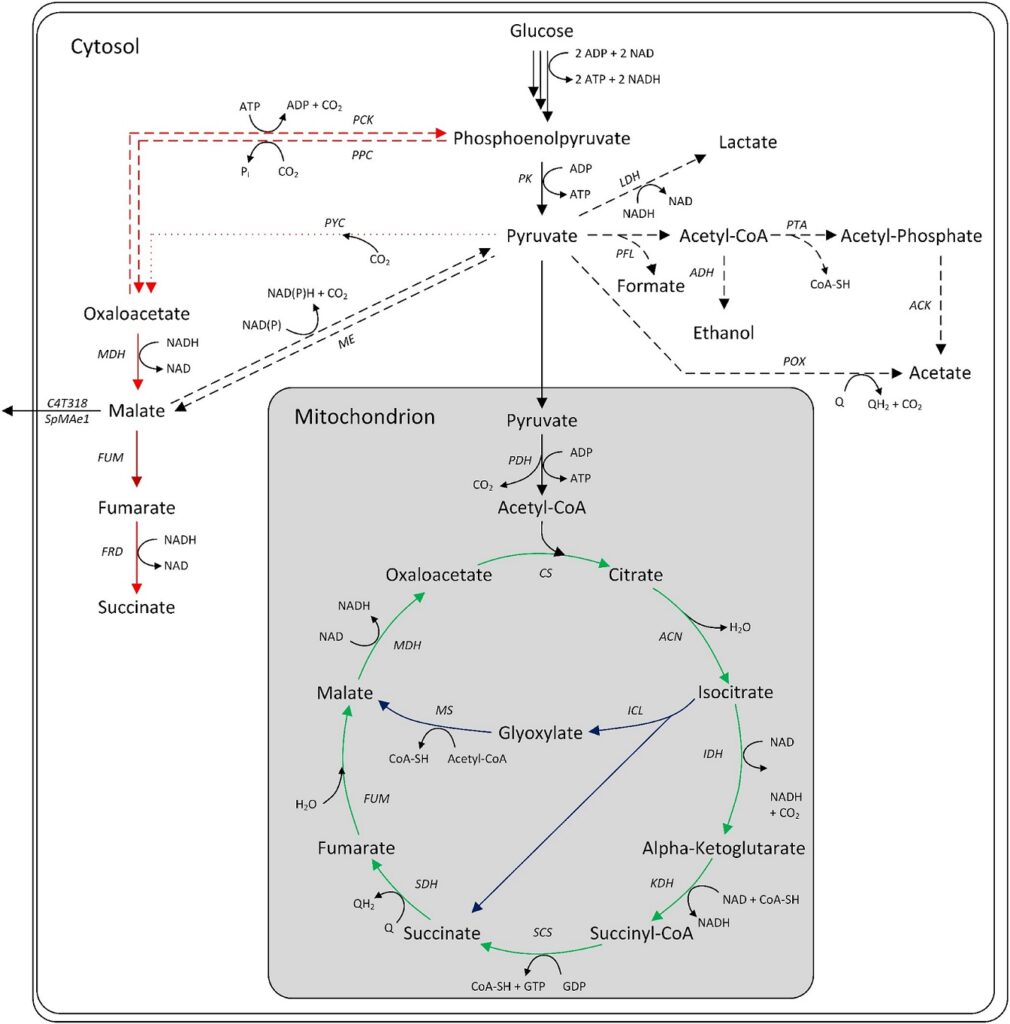
Esistono tre principali vie intracellulari per la produzione microbica di acido malico: il ciclo ossidativo degli acidi tricarbossilici (TCA), il ciclo riduttivo del TCA (rTCA) e il ciclo del gliossilato. Il TCA ossidativo, situato nel mitocondrio, converte l’acetil-CoA in citrato, che viene successivamente ossidato a L-malato con perdita di anidride carbonica.
La resa teorica massima è di 1 mol/mol. Alcune specie di Aspergillus possiedono isoforme citosoliche del TCA, consentendo una via riduttiva del TCA. Questa via, ATP-neutrale, carbossila il piruvato in ossalacetato, che viene convertito in L-malato dalla malato deidrogenasi. È possibile una resa teorica di glucosio di 2 mol/mol.
Il ciclo del gliossilato converte il citrato in succinato e gliossilato, con successiva condensazione a L-malato. La resa massima è di 1 mol/mol, che può aumentare a 1,33 mol/mol se l’ossalacetato consumato viene reintegrato tramite la carbossilazione del piruvato.
I microrganismi utilizzati nella produzione di acido L-malico includono microrganismi naturali (come Aspergillus flavus, Aspergillus oryzae, Ustilago trichophora e Rhizopus delemar) e funghi e batteri geneticamente modificati.
4. Usi dell’acido malico
L’acido (R,S)-malico condivide proprietà fisico-chimiche con l’acido citrico e l’acido tartarico, ma possiede un profilo aromatico più delicato. Questa caratteristica ne favorisce l’applicazione in prodotti alimentari in cui l’acidità dell’acido citrico è indesiderata. Alcuni esempi includono l’imballaggio alimentare e la panificazione.
Nell’industria alimentare, l’acido malico è ampiamente utilizzato (circa l’85-90%) come acidificante e regolatore di acidità. Il suo sapore differisce da quello dell’acido citrico, offrendo un’acidità meno intensa ma più persistente. Questa proprietà contribuisce a mascherare il retrogusto dei dolcificanti artificiali e a creare profili aromatici equilibrati nelle bevande.
Le interazioni sinergiche tra acido malico e dolcificanti consentono una riduzione dell’uso di dolcificanti fino al 20% e potenziali risparmi sui costi. L’uso di polvere di acido malico anidro offre ulteriori vantaggi economici.
Le principali applicazioni includono dolciumi, marmellate, gelatine e frutta e verdura in scatola. Le normative sugli additivi alimentari nella maggior parte dei paesi ne consentono l’uso.
Gli acidi malici enantiomerici, acido (R)-(+)-malico e acido (S)-(-)-malico, possono essere ottenuti dalla risoluzione dell’acido (R,S)-malico o dalla fermentazione microbica dell’acido fumarico.
Oltre all’industria alimentare, l’acido malico viene utilizzato come agente tampone e chelante nei prodotti per la cura della persona e per la pulizia. Le applicazioni farmaceutiche includono il suo utilizzo come componente di farmaci, mentre la produzione di semiconduttori lo utilizza nei processi di lucidatura e pulizia.
Inoltre, l’acido malico viene impiegato nei mangimi per animali e come componente in miscele a bassa temperatura di transizione.
L’acido malico è un acido dicarbossilico, che ne consente l’utilizzo come elemento costitutivo di polimeri. Copolimeri e omopolimeri dell’acido malico presentano proprietà quali idrofilia, biocompatibilità e biodegradabilità, trovando potenziali applicazioni in settori come la somministrazione di farmaci e la scienza dei materiali.
I principali produttori di acido malico includono Bartek (Canada), le aziende giapponesi Fuso Chemical e Mitsubishi Corporation Life Sciences, Isegen (Sudafrica), Polynt (Italia), Thirumalai Chemicals (India), le aziende cinesi Changmao Biochemical Engineering Company, Anhui Sealong Biotechnology e Jinhu Lile Biotechnology Industry, nonché Tate & Lyle (Regno Unito) e Yongsan Chemicals (Corea).
5. Tossicologia dell’acido malico
L’acido malico mostra una bassa tossicità acuta nei test sugli animali. I valori di LD50 orale variano da 1,6 a 5 g/kg in tutte le specie. I valori di LD50 per via endovenosa e intraperitoneale sono significativamente inferiori.
Studi sulla somministrazione orale cronica su ratti e cani hanno rivelato effetti avversi minimi, tra cui principalmente lievi alterazioni del peso corporeo e del consumo di mangime. Studi sulla tossicità riproduttiva hanno prodotto risultati negativi.
Studi dermatologici indicano moderata irritazione cutanea nei conigli e grave irritazione oculare nei conigli. L’acido malico è un forte irritante per la pelle delle cavie.
Le valutazioni di mutagenicità hanno prodotto risultati incoerenti. L’acido malico di per sé non si è dimostrato mutageno in vari test, ma i suoi pirolizzati e derivati clorurati hanno mostrato proprietà mutagene.
Studi sull’irritazione cutanea hanno riportato effetti dose-dipendenti, con un pH più elevato correlato a un aumento dell’irritazione. Test predittivi su pazienti con dermatite atopica hanno indicato una potenziale reattività cutanea a diete ricche di acido malico. L’acido malico ha anche influenzato la velocità di rinnovamento cellulare a seconda dei valori di pH.
Studi clinici di efficacia e sicurezza non hanno riportato tossicità.
Studi di tossicità cronica sull’acido malico su ratti e cani hanno stabilito livelli senza effetto osservato (NOEL) rispettivamente di 5000 ppm e 50000 ppm.
I dati sulla tossicità cronica dell’acido fumarico nei ratti indicano un NOAEL (No Observed Adverse Effect Level) di circa 600 mg/kg di peso corporeo/giorno. Data la conversione metabolica dell’acido fumarico in acido malico all’interno del ciclo di Krebs, l’estrapolazione tra specie è considerata valida.
La valutazione dell’esposizione all’acido malico dalla concentrazione alimentare a mg/kg/giorno ha prodotto risultati incerti. Gli intervalli stimati variavano tra 2-200 mg/kg/giorno e 25-2500 mg/kg/giorno. L’applicazione dei fattori di conversione EFSA ha risolto questa incertezza, determinando un NOAEL di 260 mg/kg/giorno.
Riferimenti bibliografici
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- https://scijournals.onlinelibrary.wiley.com/doi/10.1002/jctb.6269
- https://pubmed.ncbi.nlm.nih.gov/11358110/
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse9535
- https://onlinelibrary.wiley.com/doi/10.1002/9780470995327.ch157
- https://echa.europa.eu/registration-dossier/-/registered-dossier/11511/7/6/1
- https://www.orgsyn.org/demo.aspx?prep=cv4p0201
