Acido maleico: proprietà, reazioni, produzione e usi
Cos’è l’acido maleico?
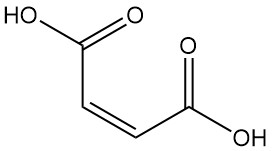
L’acido maleico, noto anche come acido cis-butenedioico, è un acido dicarbossilico con formula C4H4O4. Si presenta come un solido cristallino incolore con un leggero odore.
L’acido maleico non è presente in natura ed è stato sintetizzato per la prima volta nel 1834 riscaldando l’acido malico. L’acido maleico ha acquisito importanza industriale dopo l’inizio della produzione commerciale nel 1919 tramite l’ossidazione catalitica in fase gassosa del benzene.
L’acido maleico e la sua anidride divennero disponibili in commercio rispettivamente nel 1928 e nel 1933. L’acido maleico, da solo, ha applicazioni industriali limitate, ma viene utilizzato come precursore per resine maleinate e copoliesteri.
Sommario
1. Proprietà fisiche dell’acido maleico
L’acido maleico forma cristalli prismatici monoclini quando cristallizzato. È molto solubile in acqua ed etanolo, solubile in acetone e acido acetico glaciale, leggermente solubile in etere e insolubile in benzene.
La Tabella 1 riassume le proprietà fisiche dell’acido maleico.
| Proprietà | Valore |
|---|---|
| Numero CAS | [110-16-7] |
| Formula chimica | C4H4O4 |
| Peso molecolare | 116,07 g/mol |
| Punto di fusione | 130,5 °C |
| Densità | 1,590 g/cm3 |
| pKa1 a 25 °C | 1,94 |
| pKa2 a 25 °C | 6,23 |
| Calore di formazione | -788,3 kJ/mol |
| Calore di combustione | -1358,9 kJ/mol |
| Solubilità in acqua |
|
| Punto di infiammabilità | 127 °C |
2. Reazioni dell’acido maleico
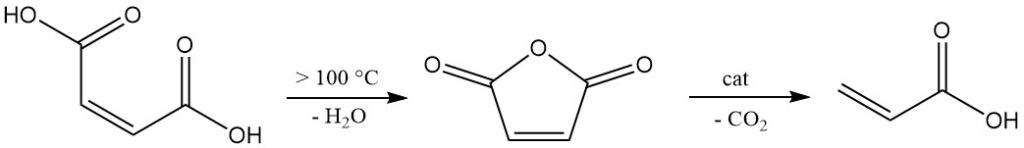
L’acido maleico mostra un’elevata reattività dovuta alla presenza sia di gruppi carbossilici che di un doppio legame. Oltre i 100 °C, viene disidratato eliminando acqua per formare anidride maleica. Un ulteriore riscaldamento, soprattutto con catalizzatori, favorisce la decarbossilazione per produrre acido acrilico.
L’acido maleico partecipa alle tipiche reazioni degli acidi carbossilici, come l’esterificazione e l’amidazione, ma non è in grado di formare cloruro acido.
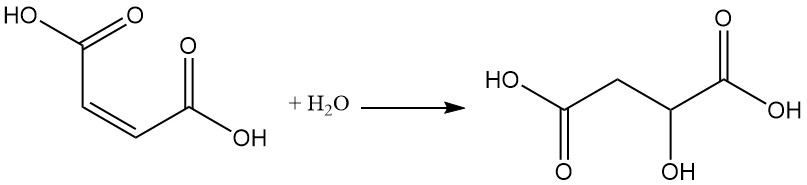
La presenza del doppio legame consente diverse reazioni, come l’aggiunta di acqua a temperatura e pressione elevate, che porta alla formazione di acido malico.
La reazione dell’acido maleico con l’ozono produce acido gliossilico.
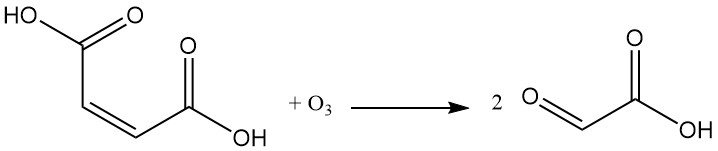
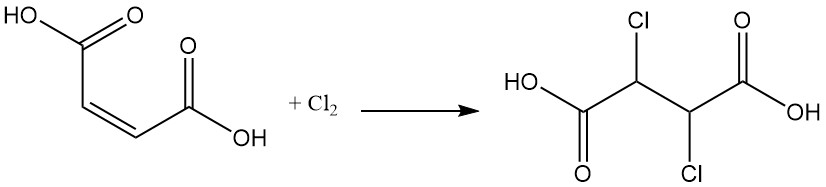
L’aggiunta di alogeni forma composti dell’acido dialogenosouccinico; ad esempio, l’aggiunta di dicloro all’acido maleico produce acido diclorosuccinico.
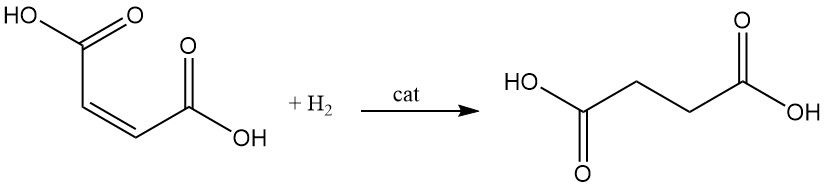
L’idrogenazione catalitica del doppio legame dell’acido maleico porta alla formazione di acido succinico.
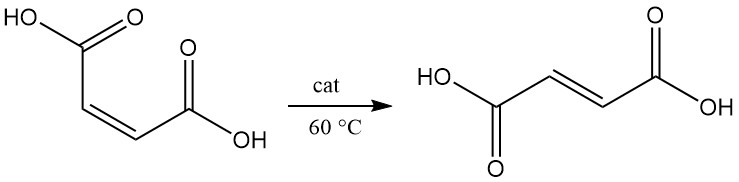
L’isomerizzazione dell’acido maleico ad acido fumarico avviene lentamente, anche a 100 °C. In presenza di un catalizzatore, la conversione avviene in modo quasi quantitativo, anche a 60 °C.
3. Produzione di acido maleico
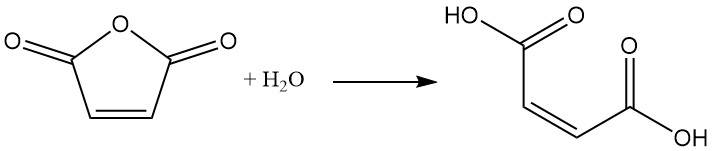
Il metodo più comune per la produzione di acido maleico è l’idratazione controllata dell’anidride maleica con una piccola quantità di acqua. Dopo il raffreddamento della miscela di reazione, il prodotto, l’acido maleico, precipita come solido.
Il liquido surnatante (liquore madre) viene quindi separato. L’acido maleico solido viene essiccato sotto vuoto.
Il liquido madre può essere diluito e riciclato alla fase di idratazione per un’ulteriore produzione di acido maleico oppure indirizzato all’unità di disidratazione per la produzione di anidride maleica, eliminando la necessità di un trattamento separato degli effluenti. Tuttavia, questo metodo richiede apparecchiature in acciaio resistente alla corrosione a causa delle condizioni gravose.
In alternativa, l’acido maleico può essere ottenuto direttamente dall’acqua di lavaggio generata durante la produzione di anidride maleica. Questo processo consente di risparmiare l’energia necessaria per la disidratazione in forma di anidride. Tuttavia, richiede la purificazione e la concentrazione dell’acqua di lavaggio.
L’acqua di lavaggio deve essere trattata con carbone attivo per rimuovere le impurità. Il carbone esaurito viene quindi smaltito. La soluzione purificata deve essere concentrata sotto vuoto perché le temperature elevate favoriscono la formazione di acido fumarico e le apparecchiature in acciaio al cromo-nichel utilizzate in questo processo si corrodono oltre gli 80 °C.
Anche i flussi di acqua di lavaggio arricchita provenienti da processi di ossidazione come o-xilene e naftalene, utilizzati nella produzione di anidride ftalica, possono essere utilizzati come materiale di partenza per la produzione di acido maleico, insieme all’acido fumarico e all’anidride maleica.
4. Usi dell’acido maleico

L’acido maleico è un componente importante nella produzione di poliestere, utilizzato per modanature laminate rinforzate con fibre e vernici per veicoli.
Viene utilizzato come materiale di partenza per la sintesi di numerose altre sostanze chimiche.
L’acido maleico può essere convertito in acido fumarico, un altro prezioso prodotto chimico industriale.
Grazie alle sue proprietà acide, può essere utilizzato come regolatore di acidità in alcuni alimenti e bevande.
Migliora l’adesione tra vari materiali, come metalli zincati (acciaio zincato) e nylon, utilizzato con adesivi a base di metilmetacrilato.
L’acido maleico viene applicato nei processi di tintura e finitura delle fibre naturali.
La forma ionizzata (ione maleato) agisce come inibitore delle reazioni delle transaminasi nella ricerca biochimica.
L’acido maleico è utilizzato come agente tampone, agente schiumogeno e regolatore di pH nei prodotti per la pulizia e nelle applicazioni per la cura della casa.
5. Tossicologia dell’acido maleico
Il principale problema tossicologico dell’acido maleico è il suo effetto irritante e corrosivo locale su pelle, mucose e occhi. Studi dimostrano che una soluzione acquosa al 20% può causare irritazione cutanea lieve e reversibile nell’uomo, mentre concentrazioni inferiori (<5%) possono irritare significativamente gli occhi.
Gli esperimenti sugli animali confermano che questa azione irritante locale è la caratteristica tossicologica più importante.
L’acido maleico mostra una moderata tossicità acuta orale e cutanea. I valori di LD50 riportati sono:
- 708 mg/kg (ratto, orale)
- 2400 mg/kg (topo, orale)
- 1560 mg/kg (coniglio, cutaneo)
- >1000 mg/kg (cavia, cutaneo)
Il danno renale è un potenziale effetto tossico sistemico dell’acido maleico. Alterazioni morfologiche e funzionali renali sono state osservate in ratti e cani in seguito a iniezione intraperitoneale e esposizione per inalazione.
Questo danno assomiglia alla sindrome di Fanconi, potenzialmente causata dall’interazione dell’acido maleico con il glutatione nelle cellule renali, che porta alla formazione di radicali liberi e perossidi. Inoltre, l’acido maleico sembra influenzare i meccanismi di trasporto degli ioni sodio e idrogeno.
Studi sull’esposizione cronica nei ratti maschi (250-750 mg/kg/die fino a due anni) hanno mostrato un aumento della mortalità, danni renali e ritardo della crescita in tutti i gruppi di dosaggio. Sono stati osservati anche danni al fegato e ai testicoli nel gruppo trattato con il dosaggio più elevato.
Non è stata evidenziata alcuna cancerogenicità o genotossicità in questi studi, sebbene non fossero specificamente progettati per questo scopo.
Riferimenti
- Maleic and Fumaric Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Maleic-Acid
Sono un chimico organico appassionato e continuo ad apprendere su vari processi di chimica industriale e prodotti chimici. Garantisco che tutte le informazioni su questo sito web siano accurate e meticolosamente referenziate ad articoli scientifici.
